僵蚕中黄曲霉毒素的测定及风险评估
2024-03-05马晓静张亦萌崔业波马彧
马晓静 张亦萌 崔业波 马彧
(四平市食品药品检验所 吉林四平 136000)
0 引言
僵蚕又名白僵蚕、姜虫、天虫等,为蚕蛾科昆虫家蚕(Bombyx mori Linnaeus)4~5 龄的幼虫感染(或人工接种)白僵菌(Beauvria bassiana(Bals.)Vuillant)而致死的干燥体。其用药历史悠久,具有息风止痉、祛风止痛、化痰散结之功效[1-3]。僵蚕是常用的动物药,临床使用量每年约为2 000 t。僵蚕中营养物质丰富,在其加工、运输及贮存的过程中极易因处置方法不当被黄曲霉毒素污染。常见的黄曲霉毒素(aflatoxin,AF)有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)和黄曲霉毒素M1(AFM1)等,其中AFB1具有强烈的肝毒性和致癌性,被世界卫生组织列为Ⅰ类致癌物[4-10]。近年来,僵蚕药材中黄曲霉素的污染备受关注。本研究采用高效液相色谱法对24 批次僵蚕药材及其饮片中黄曲霉毒素残留进行测定,并采用暴露限值法对AFB1进行安全风险评估,以期为僵蚕的质量评价奠定基础。
1 仪器与试药
1.1 仪器
电子天平BT125D 型(精度:0.000 1 g,北京赛多利斯仪器天平有限公司);Agilent1260 高效液相色谱仪(配有Agileng 1260Ⅱ型荧光检测器,安捷伦科技限公司);光化学柱后衍生器KRC-25 型(青岛普瑞邦生物工程有限公司);TDL-5-A 型台式离心机(上海安亭科学仪器厂)。
1.2 试药
黄曲霉毒素混合对照品溶液(AFB1、AFB2、AFG1、AFG2标示浓度分别为1.08 μg/mL、0.33 μg/mL、1.01 μg/mL、0.30 μg/mL,批号:610061-202107,中国食品药品检定研究院);免疫亲和柱(规格:3 mL,青岛普瑞邦生物工程有限公司);甲醇和乙腈(Flsher Scientific,色谱纯)。纯化水为自制,其他试剂均为分析纯。24 批次僵蚕均为药店采购,样品信息详见表1。

表1 样品信息Table 1 Information of the sample
2 方法与结果
2.1 色谱条件
以YMC-C18为色谱柱(4.6×250 mm,5 μm),以甲醇-乙腈-水(40∶18∶42)为流动相;流速为1.0 mL/min;柱温为30℃;检测器:荧光检测器,激发波长为360 nm,发射波长为450 nm。
2.2 对照品溶液的制备
精密量取黄曲霉毒素混合对照品1 mL,置于10 mL 量瓶中,加入70%甲醇稀释至刻度,作为对照品储备液。精密量取上述对照品储备液1 mL,置于25 mL 量瓶中,加入70%甲醇稀释至刻度,摇匀,即得。
2.3 供试品溶液的制备
取僵蚕药材粉末(过二号筛)约15 g,精密称定,置于均质瓶中;加入氯化钠3 g,精密加入70%的甲醇溶液75 mL,12 000 r/min 高速搅拌2 min,以5 000 r/min 离心5 min;精密量取上清液15 mL,置于50 mL量瓶中,用水稀释至刻度,摇匀,以5 000 r/min 速度离心10 min;精密量取上清液20 mL,通过免疫亲合柱,流速控制在3 mL/min;用水20 mL 洗脱,弃去洗脱液,使空气进入柱体;将水挤出柱体,再用1.5 mL甲醇洗脱,收集洗脱液,置于2 mL 量瓶中;加水稀释至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,取续滤液,即得。
2.4 空白溶液的制备
除不添加样品外,按照“2.3”项下的方法同法制备空白溶液,即得。
2.5 专属性试验
分别精密吸取对照品溶液、供试品溶液、空白溶液各10 μL 注入液相色谱仪,按照“2.1”项下的色谱条件进行测定。结果表明4 种黄曲霉毒素的色谱峰分离度良好,空白溶液无干扰,见图1。

图1 僵蚕黄曲霉毒素HPLC 图Fig.1 HPLC diagram of aflatoxin of Bombyx Batryticatus
2.6 方法学考察
2.6.1 线性关系
分别精密吸取“2.2”项下的对照品溶液2 μL、5 μL、8 μL、10 μL、13 μL 注入液相色谱仪,记录峰面积,以进样量(ng)为横坐标,以峰面积为纵坐标,绘制标准曲线,结果见表2。

表2 线性关系、检出限和定量限Table 2 Linear,LOD and LQD
2.6.2 回收率试验
取编号为JC-1 的样品15 g,共计6 份,以AFB1限度5 μg/kg 作准确度考察,分别精密加入“2.2”项下的对照品储备液0.8 mL,按照“2.3”项下同法处理,按“2.1”项下的色谱条件进行测定。结果显示,黄曲霉毒素B1、B2、G1、G2的平均回收率分别为91.96%、87.94%、92.96%、84.10%,RSD 分别为2.44%、2.80%、2.56%、2.59%。
2.6.3 精密度试验
精密量取“2.2”项下溶液10 μL,按照“2.1”项下色谱条件,注入液相色谱仪中,连续进样6 次。结果显示,黄曲霉毒素B1、B2、G1、G2峰面积的RSD 值分别为1.2%、1.6%、2.1%、1.7%,表明仪器精密度良好。
2.6.4 重复性试验
取编号为JC-1 的样品15 g,共计6 份,分别精密加入“2.2”项下的对照品储备液0.2 mL,按照“2.3”项下的方法制备供试品溶液,分别精密吸取10 μL,注入液相色谱仪,按照“2.1”项的色谱条件进行测定,记录峰面积并计算含量。结果显示,AFB1、AFB2、AFG1、AFG2含量的RSD 值分别为1.53%、2.09%、1.21%、1.79%,表明方法的重复性良好。
2.6.5 检出限
取编号为JC-1 的样品15 g,精密加入上述“2.2”项下的对照品溶液2 mL,其他操作同“2.3”项下方法同法处理,以信噪比法3∶1 时计算检出限,结果见表2。
2.6.6 定量限
取编号为JC-1 的样品15 g,精密加入上述“2.2”项下的对照品溶液5 mL,其他操作同“2.3”项下方法同法处理,以信噪比法10∶1 时计算定量限,结果见表2。
2.7 测定结果
取上述24 批次僵蚕药材及其饮片样品,按照“2.3”项下方法制备供试品溶液,分别吸取10 μL,按照“2.1”项下色谱条件进样测定,并根据标准曲线计算黄曲霉毒素B1、B2、G1、G2的含量,结果见表3。
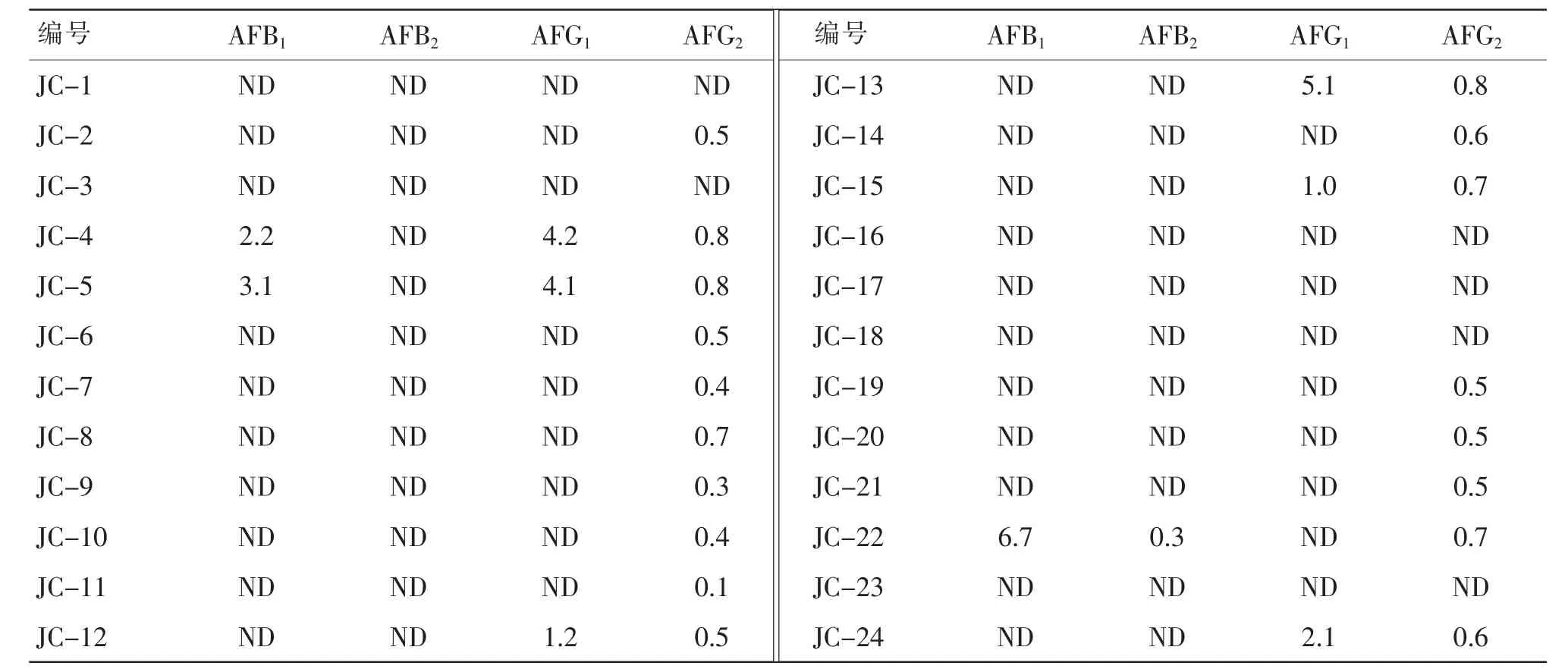
表3 黄曲霉毒素测定结果(μg/kg)Table 3 Results of content determination of AF(μg/kg)
2.8 AFB1 风险评估
黄曲霉毒素是目前已知的最强的致癌物之一,其毒性的主要靶器官是肝脏,有研究学者利用黄曲霉毒素生物标志物对黄曲霉毒素诱导肝癌的发生进行了评估,发现控制黄曲霉毒素的污染可以避免肝癌和相关死亡病例,且AFB1对于乙型肝炎病毒携带者的致癌风险更大。
中药中有害残留物的风险评估程序,包括危害识别、危害特征描述、暴露评估和风险描述4 个步骤。本研究应用暴露限值法(MOE)对AFB1暴露的潜在致癌风险进行评估,由剂量-反应曲线推算得到的人群致癌参考。得到人群膳食暴露量的比值和人群摄入量的比值来描述风险。MOE>10 000,则表明真菌毒素摄入量在安全范围内,不会对人体健康产生威胁;MOE 值≤10 000,则表明真菌毒素的摄入量可能对人体健康产生威胁[11-18]。根据公式(1)和(2)进行计算。
式中,ADD——居民消费僵蚕对AFB1的日均暴露量(μg/(kg·d));C——僵蚕中AFB1的平均含量(μg/kg);IR——日均摄入量(kg/d),2020 年版《中国药典》一部中僵蚕的用量为0.01 kg/d;BW——人体平均体重(kg),按60 kg 计算;POD——致癌效应,基于人群流行病学数据确定,参考EFSA 建立的剂量-反应关系,BMDL10(对照组中出现10%肝癌发生率的95%统计学可信区间的下限值)为0.87 μg/(kg·d)。
参考世界卫生组织(WHO)和USEPT 对于未检出数据的相关经验指南,未检出值以检出限(LOD)的1/2 计[19]。本研究中僵蚕AFB1含量的平均值为0.76μg/kg,采用公式(1)计算可得,居民消费僵蚕对AFB1的日均暴露量(ADD)为0.000 13 μg/(kg·d),采用公式(2)计算可得,服用僵蚕AFB1暴露的平均人群MOE 值为6 692,僵蚕样品中的MOE值≤10 000,提示僵蚕药材AFB1暴露水平可能会对人体健康产生不良影响。
3 讨论与结论
本研究采用高效液相色谱法对24 批次僵蚕的黄曲霉毒素进行测定,其中黄曲霉毒素G1检出率为25%,黄曲霉毒素G2检出率为75%,黄曲霉毒素B1的检出率为12.5%,黄曲霉毒素B2的检出率为4.2%,且有一批黄曲霉毒素B1含量超出2020 年版《中国药典》一部中收载僵蚕品种项下的规定限值5 μg/kg[20]。
黄曲霉毒素的污染问题严重影响药材质量,必须开展样本筛查及风险评估进行质量控制,在风险管理中,基础筛查数据具有指导意义,AFB1的毒性是砒霜的68 倍,其合理的定量风险评估对药用资源的可持续发展以及药效的合理利用具有重要意义。本研究采用暴露限值法对僵蚕中的AFB1进行风险评估,研究结果表明,僵蚕中AFB1的MOE≤10 000,提示僵蚕中AFB1的暴露水平可能会对人体健康产生不良影响且存在潜在的风险点。由于黄曲霉毒素具有较强的致癌性、肝毒性等毒性特点,因此有必要加强对僵蚕药材及饮片黄曲霉毒素的监控,并进行质量安全风险评估,以保障僵蚕用药的安全性。
