幽门螺杆菌毒力基因数字PCR 检测体系的建立
2024-03-05范宏博蔡永洪李月玥梁志坚张力玲马婷婷胡松青胡良勇
范宏博 蔡永洪 李月玥 梁志坚 张力玲 马婷婷 胡松青 胡良勇*
(1.华南理工大学食品科学与工程学院 广东广州 510630;2.广州计量检测技术研究院)
0 引言
幽门螺杆菌(Helicobacter pylori,Hp)是国际癌症研究机构(IARC)定级的I 类致癌物,被列为“12种最危险的耐药细菌” 之一,Hp 感染是全世界人民共同面对的一个重要公共卫生问题。据统计,约90%的非贲门部胃癌与Hp 感染有关[1]。在我国,Hp感染率约为50%,且Hp 感染是导致胃癌的主要病因,根除Hp 可有效降低胃癌的发生风险[2]。
Hp 的致病性源于其分泌的多种毒力因子,其中毒力因子细胞毒素相关蛋白A(cagA)和细胞空泡毒素A(vacA)是Hp 存活和致病的最关键因素[3]。根据是否含cagA 基因进行分类,Hp 可分为cagA 阳性(I型)和cagA 阴性(II 型)菌株。I 型菌株可比II 型菌株引起更严重的胃粘膜损伤和炎症,以及更高的致癌概率[4]。中国、日本和韩国等东亚国家分离的菌株90%以上含cagA 基因[5]。vacA 基因编码的空泡毒素能引起细胞空泡化变性,调控细胞的自噬、炎症和凋亡,还能通过诱导调节性T 细胞的分化使Hp 逃避免疫系统的清除[6]。
我国居民的Hp 感染率很高,但对于Hp 感染者是否都要接受治疗仍存在争议,这主要由于不恰当的治疗会增加耐药性[7]。而对感染者开展Hp cagA和vacA 基因检测,测定是否含有毒力基因以及毒力基因含量高低,可作为治疗的重要指导依据。目前,Hp分型和毒力基因含量检测的方法主要为qPCR法,但qPCR 法无法检测微量核酸DNA,不适于复杂样品或低浓度感染检验[8-9]。此外,qPCR 法属于半定量法,需要依赖标准曲线进行拷贝数定量分析,当不同实验室间采用参考标准不一致时,qPCR 法检测结果的可比性和互认性较差。因此,qPCR 法在Hp 分型和毒力基因检测诊断中存在一定局限[10]。
数字PCR 法(digital PCR,dPCR)是实现靶基因拷贝数绝对定量的第三代PCR 检测方法,除了兼具普通PCR 法和qPCR 法的优点外,还具有高重复性、高灵敏度和高PCR 抑制剂耐受性,可用微量样品检测极低浓度的细菌或病毒感染[11-12]。目前,已有学者探究dPCR 法在Hp 毒力基因cagA、vacA 检测中的应用,并证实dPCR 法比快速脲酶法和尿素呼气法等传统检测方法更灵敏[13-15]。然而,dPCR 法在Hp 毒力基因检测中的灵敏度、精密度和最适反应条件等未见相关评估研究,不利于该方法的广泛应用和相关检测标准的建立。因此,本研究以Hp 标准菌株为材料,通过优化反应条件和反应体系,探究dPCR法检测Hp 毒力基因的适用性,旨在为Hp 诊疗提供更可靠的检测方法。
1 材料与方法
1.1 菌株
Hp 标准菌株(ATCC43504)、金黄色葡萄球菌(ATC C6538)、嗜酸乳杆菌(ATCC4356)、大肠杆菌(ATCC25312)和唾液链球菌(ATCC7073)(宁波泰斯拓生物技术有限责任公司)。
1.2 试剂和仪器
脱纤维羊血、幽门螺旋杆菌固体培养基、幽门螺旋杆菌抑菌剂(海博生物技术有限公司);TaqPCR Mastermix、核酸染料、高保真PCR 预混液、细菌基因组DNA 提取试剂盒(YDP302)、DNA Marker DL2000(天根生化科技(北京)有限公司);微滴发生卡、2×Supermix 预混液、可穿透热封铝箔、96 孔反应板、微滴分析油、微滴发生卡密封垫、微滴生成仪、QX200 微滴读取仪、T100 梯度PCR 仪和PX1 热封仪(Bio-Rad 公司)。
1.3 菌株复苏及基因组DNA 提取
取冻存的Hp 菌种,解冻后吸取菌液滴加至配制的固体培养基上,涂布均匀后在三气培养箱中培养3~5 d。用生理盐水将培养的Hp 菌落冲洗下来,并吹打成悬浮液。采用细菌基因组DNA 提取试剂盒提取Hp 和大肠杆菌等细菌的基因组DNA。金黄色葡萄球菌等细菌的菌液由直接采购获得,经37℃培养1 h 后,同样采用试剂盒提取基因组DNA。
1.4 引物设计与合成
根据NCBI 数据库(https://www.ncbi.nlm.nih.gov/)提供的基因序列,选择Hp cagA(GQ161098.1)和vacA(AP017632.1)基因,采用Primer 5 软件设计引物和探针。经Blast 比对分析获得最佳引物和探针,cagA引物序列为F-TGAGTGGCTCAAGCTCGTGA,R-CTTG GTGGAAAACTTGAACGAA,探针序列为FAM-CAGA ATAATCTTTCATATTCTT-MGB;vacA 引物序列为F-CAATTCAAAGAGCGCCTAGCC,R-TCATCAGTA TTTCGCACCACACA,探针序列为FAM-TATCCATGCGGTTATTGTTGT-MGB,引物和探针均由北京擎科生物科技股份有限公司合成。
1.5 检测体系建立和优化
Hp 毒力基因dPCR 检测体系的反应体积为20 μL,初始反应体系为:2×Supermix 预混液10 μL,上游和下游引物(10 μmol/L)各0.8 μL,探针0.4 μL,DNA模板1 μL,加灭菌超纯水至20 μL;初始PCR 反应程序为:95℃10 min;95℃30 s,60℃1 min,40 个循环;98℃10 min。为优化反应条件,依次设置8 个引物工作浓度和5 个退火温度,筛选最佳检测条件。
Hp dPCR 检测操作步骤如下:将配置的20 μL反应体系加入微滴发生卡的Sample 孔,将70 μL 微滴生成油加入Oil 孔,覆盖密封垫并将微滴生成卡置于微滴生成仪中,仪器自动制备微滴。将制备的微滴转移至96 孔反应板,使用可穿透热封铝箔在热封仪中封膜。将封膜的96 孔反应板放入PCR 仪,按设定条件进行PCR 反应。反应结束后,将96 孔反应板放入微滴读取仪,在QuantaSoft 软件中选择反应孔并填入对应信息,测定和采集数据。
1.6 检测特异性评估
以Hp 基因组DNA 为阳性对照,以超纯水为空白对照,采用初始dPCR 反应体系和反应程序,分别对金黄色葡萄球菌、大肠杆菌、嗜酸乳杆菌、唾液链球菌的基因组DNA 进行检测,根据结果进行特异性评估。
1.7 检测灵敏度评估
以提取的Hp DNA 为模板,根据质量浓度稀释至dPCR 法最佳检测范围内,并采用梯度法进一步稀释。其中,vacA 基因的浓度梯度依次为4 980.0、1 102.0、228.0、18.5、7.3、2.0 和0.7 copies/μL,cagA 基因的浓度梯度依次为4 600.0、1 130.0、171.0、35.5、8.5 和2.2 copies/μL,采用dPCR 法进行检测,根据结果进行灵敏度评估。
1.8 检测精密度评估
以Hp DNA 为模板,各设置3 个浓度。其中,vacA基因为430.5、54.8 和8.5copies/μL,cagA 基因为517.0、48.5 和10.0 copies/μL,采用dPCR 法进行检测(n=6)。根据检测结果计算标准偏差(SD)和变异系数(CV),以CV 值评估方法精密度和重复性。
2 结果与分析
2.1 引物和探针检验
图1A 和图1C 分别为vacA 和cagA 的dPCR检测散点图,蓝色微滴为阳性,黑色微滴为阴性,阳性和阴性显著分成2 簇,且中间弥散的微滴较少,说明扩增效果好,且引物和探针特异性良好。图1B 和图1D 为特异性检测的直方图,左侧低荧光强度的峰为阴性,右侧较高荧光强度的峰为阳性,阴性峰和阳性峰显著分开,说明引物和探针适用于Hp vacA和cagA 基因定量检测。

图1 Hp 毒力基因dPCR 检测用引物和探针检验Fig.1 Primers and probes for dPCR detection of Hp virulence genes
2.2 特异性检验
以唾液链球菌、金黄色葡萄球菌、嗜酸乳杆菌和大肠杆菌作为质控菌,对Hp 毒力基因cagA 和vacA的dPCR 检测法进行特异性评估,结果见图2。由图2 可知,以Hp DNA 样品为模板,针对vacA(图2A)和cagA(图2B)的检测结果均为阳性,而其他菌种的DNA 检测结果均为阴性。结果表明,该方法在检测Hp vacA 和cagA 时不受其他常见菌种的干扰,可满足特异性要求。

图2 Hp vacA(A)和cagA(B)的dPCR 检测特异性检验Fig.2 Testing of the specificity of dPCR for Hp vacA(A)and cagA(B)
2.3 最佳引物浓度筛选
Hp 毒力基因vacA 和cagA 的dPCR 检测最佳引物浓度优化结果见图3,图中引物工作浓度从左至右依次为:50、150、250、350、450、550、650 和750 nmol/L。由图3 可知,在引物浓度较高的情况下,阳性微滴和阴性微滴可显著分开,且荧光强度之差随引物浓度升高而增大。vacA 基因的荧光强度差在650nmol/L 时达到折点(图3A),cagA 基因的荧光强度差在550 nmol/L时达到折点(图3B),因此,分别选定650 nmol/L 和550 nmol/L 为2 种毒力基因的最佳引物工作浓度。
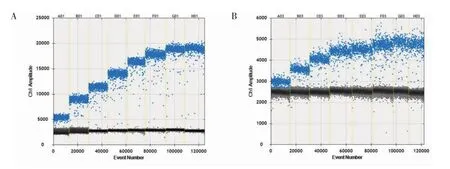
图3 Hp 毒力基因dPCR 检测引物浓度优化Fig.3 Optimization of primer concentration for dPCR detection of Hp virulence genes
2.4 最佳退火温度筛选
Hp vacA(A)和cagA(B)的dPCR 检测最佳退火温度筛选结果见图4。图4A 中的温度从左至右依次为:52.5℃、55.0℃、57.9℃、60.4℃和62.0℃,各温度条件下,阳性微滴和阴性微滴均明显分开,且荧光强度之差随温度升高而减小,在55.0℃时达到折点,因此选定55.0℃为vacA dPCR 检测的最佳退火温度。图4B 中的温度从左至右依次为:55.0℃、57.9℃、60.4℃、62.0℃和63.0℃,可知57.9℃为cagA dPCR检测的最佳退火温度。
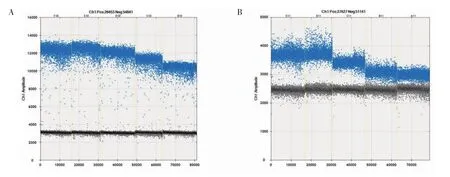
图4 Hp 毒力基因dPCR 检测退火温度优化Fig.4 Optimization of annealing temperature for dPCR detection of Hp virulence genes
2.5 灵敏度检验
检测灵敏度分析结果见图5,图5A 和5B 为vacA检验分析图。线性分析显示,其拟合度值为R2=0.999 1,线性范围内的相关性r=0.999,说明在此浓度范围内,该方法可准确检测vacA 基因。同理,图5C 和5D 为cagA 检验分析图,线性分析显示其拟合度值为R2=0.999 5,线性范围内的相关系数r=0.999,说明在此浓度范围内,该方法可准确检测cagA 基因。此外,以灭菌超纯水为模板对检测限进行分析,证明该方法对毒力基因vacA、cagA 的检测限分别为0.26 copies/μL和1.25 copies/μL,即每个反应体系中(20 μL)最少可准确检测5.2 和25 个拷贝。

图5 Hp 毒力基因dPCR 检测的灵敏度检验Fig.5 Sensitivity testing of dPCR detection for Hp virulence genes
2.6 精密度检验
Hp 毒力基因vacA 和cagA dPCR 法检测的精密度分析结果见表1。由表1 可知,在不同样品浓度条件下,dPCR 检测毒力基因的变异系数(CV)均小于10%,表明该方法具有较高的精密度。

表1 Hp 毒力基因dPCR 检测的精密度检验Table 1 Precision tests of dPCR detection for Hp virulence genes
3 讨论
准确诊断是防控Hp 感染及相关疾病的重要前提,目前,针对cagA 和vacA 检测的方法主要有粪便抗原检测法、血清抗体检测法和PCR 法。粪便抗原检测法需要Hp 达到一定密度才能检出阳性,而在感染早期和干预治疗后,Hp 密度较低,易出现假阴性。血清抗体检测法要求抗体达到一定浓度,而人体感染Hp 数周后才产生抗体,且根除Hp 感染后血清抗体可维持6 个月以上,易造成假阳性[8]。PCR 法具备快速、经济和灵敏等优势,但RT-PCR 法和qPCR法定量时需与参考标准比较,目标基因扩增效率易受复杂体系影响,且无法检测微量DNA[16]。dPCR 法是可实现痕量DNA 直接绝对定量的检测方法,兼具RT-PCR 法和qPCR 法的优点,更有高灵敏度、精准度和抑制剂耐受性。dPCR 法已逐渐应用于稀有病原体检测、病毒载量检测和转基因成分分析等领域[17]。
基于dPCR 法的优势,本研究根据Hp vacA 和cagA 基因设计引物与探针,检验结果显示,阳性微滴与阴性微滴均明显分离(图1),说明引物和探针的特异性好,满足检测需求。根据CNAS-GL039《分子诊断检验程序性能验证指南》的要求,本研究同时对dPCR 检测法的灵敏度和精密度进行分析,证明该方法可灵敏地检测样品中的Hp DNA,vacA 和cagA基因的检测限分别低至0.26 copies/μL 和1.25 copies/μL(图5),并保持较高的精密度(CV<10%)(表1)[18]。对检测体系的优化结果显示,vacA 和cagA 基因的最佳引物工作浓度分别为650 nmol/L 和550 nmol/L(图3),最佳Tm 分别为55.0℃和57.9℃(图4),此时阳性微滴和阴性微滴最大分离。此外,dPCR 法在检测基因载量时,可直接对样品中靶标基因进行绝对计量,并溯源至国际基本单位摩尔,因而在开展室间质控、结果比对时具有优势[19]。本研究建立的Hp 毒力基因检测体系可满足流行病学调查、感染早期和治疗后期诊断、室间质评、检测规范制定和检测质量评估等众多检测需求。
4 结论
本研究建立的Hp 毒力基因vacA 和cagA dPCR检测体系的灵敏性、特异性和精密性较好,可广泛适用于Hp 毒力评估的常规检测、结果互认和标准制定。Hp 感染是全世界人民共同面对的重要公共卫生问题,本检测体系的建立可为Hp 防控提供一个更加精准、可靠的技术参考。
