牛磺熊去氧胆酸通过调节内质网应激抑制转化生长因子β1所诱导的心肌成纤维细胞纤维化
2024-03-04张含林林辉郭航远
张含林 林辉 郭航远
312000 绍兴市人民医院(浙江大学绍兴医院)心内科
国际糖尿病联合会预测,到2040年,糖尿病的患病率将达10.4%(6.42亿)。糖尿病的主要并发症之一是糖尿病性心肌病(diabetic cardiomyopathy,DCM)[1]。DCM的特征是代谢紊乱,通常伴有局部炎症、氧化应激、心肌纤维化和心肌细胞凋亡[2]。在心肌纤维化过程中,细胞外基质主要来源于心肌成纤维细胞(cardiac fibroblasts,CFs)[3]。转化生长因子β1(transforming growth factor beta 1,TGF-β1)被认为是诱导CFs向肌成纤维细胞转化的最强的促纤维化细胞因子[4]。DCM中,高糖等因素可活化TGF-β1,从而促进CFs活化,表现为表达收缩蛋白,如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达增加,并合成大量的细胞外基质,包括波形蛋白(Vimentin)和Ⅰ型胶原蛋白(CollagenⅠ)[5-6]。目前研究认为,内质网应激(endoplasmic reticulum stress,ERS)在DCM发病和进展中起着关键作用[7]。同型半胱氨酸内质网应激泛素样结构域1(homocysteine-inducible, endoplasmic reticulum stress-inducible, ubiquitin-like domain member 1,Herpud1)是一种广泛表达于内质网膜上的蛋白。Herpud1已被报道与糖尿病和阿尔茨海默病等多种疾病有关[7]。我们前期研究发现,Herpud1介导的ERS在动脉粥样硬化和血管平滑肌细胞(vascular smooth muscle cell,VSMC)可塑性中起重要作用[8],敲除Herpud1可保护血管紧张素Ⅱ诱导的内皮细胞凋亡[9]。牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA)是公认的ERS抑制剂[10]。有研究发现,TUDCA可减轻压力负荷引起的心功能障碍[11],并通过抑制ERS减少糖尿病小鼠心肌缺血再灌注后巨噬细胞和中性粒细胞的浸润,从而减少心肌细胞凋亡和炎症反应[12]。我们推测,TUDCA通过Herpud1介导的ERS通路可抑制CFs活化。但TUDCA对DCM的缓解作用及其可能机制仍需要进一步验证。本研究旨在通过TUDCA干预TGF-β1诱导的CFs,比较药物干预前后CFs的活化情况,为临床应用TUDCA治疗DCM提供实验依据,并阐明Herpud1基因在TGF-β1诱导的CFs活化中的关键作用。
1 材料与方法
1.1 实验动物和主要试剂
6周龄的SPF级SD大鼠,均自南京大学模式动物研究所购得。根据《国家卫生研究院实验动物关爱使用指南》,所有动物方案均经绍兴市人民医院动物关爱利用委员会批准。所有动物实验均在绍兴市人民医院实验动物中心完成,动物使用许可证号:SYXK(浙)2017-0007,SPF级环境,湿度为40%~60%,室温为22~28℃,昼夜交替循环时间为12 h。食物和水自由供应。TUDCA、链脲佐菌素(streptozotocin,STZ)和嘌呤霉素均为美国MCE公司产品。高糖DMEM培养基、0.25%胰蛋白酶、链霉素-青霉素混合液、Lipofectamine 3000、Opti-MEM培养基及胎牛血清(fetal bovine serum,FBS)均为美国Gibco公司产品。TGF-β1和Ⅱ型胶原酶为美国Cell signaling公司产品。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、转录激活因子6(activating transcription factor 6,ATF6)、α-SMA、Vimentin、Herpud1、CollaganⅠ、Anti-beta Actin和Troponin T抗体均为美国Abcam公司产品。5-Brdu为美国Sigma公司产品。异硫氰酸荧光素标记的山羊抗兔IgG、辣根过氧化物酶标记的山羊抗兔IgG和Western blot相关试剂均为江苏碧云天生物技术有限公司产品。siHerpud1、Control组的病毒和转染的P液为上海吉凯生物公司产品。对照质粒以及Herpud1过表达质粒为上海和元生物公司产品。HE染色、马松染色以及免疫组织化学试剂盒均为北京索莱宝公司产品。Transwell小室为美国Corning公司产品。
1.2 模型构建和实验分组
为确定TGF-β1对ERS通路相关因子及纤维化相关因子的影响,用TGF-β1诱导高糖培养下的CFs,采用随机数字表法将CFs分为Control组、6 h、12 h和24 h组。为确定Herpud1在心脏中的表达,分别提取原代心肌细胞和CFs进行下一步的研究。为检测TUDCA对CFs活性的影响,将高糖培养下的CFs用不同浓度(0、1、10、100、1 000和10 000 μM,1 d)TUDCA干预。为明确TUDCA对TGF-β1诱导的CFs活化及ERS通路相关蛋白的影响,采用随机数字表法将高糖培养下的CFs分为HG(25 mmol/L葡萄糖)组、TGF-β1(10 ng/ml)组,TGF-β1+TUDCA 100(100 μM)组、TGF-β1+TUDCA 1 000(1 000μM)组。为验证Herpud1对CFs的敲除效率,采用随机数字表法将CFs分为NC、siNC、siRNA1、siRNA2和siRNA3组。为了明确敲除Herpud1对CFs的激活、增殖和迁移的影响,选择敲除效率最高的Herpud1 siRNA1进行下一步研究,采用随机数字表法将CFs分为HG+siNC、TGF-β1+siNC、HG+siHerpud1、TGF-β1+siHerpud1组。为了验证Herpud1在TUDCA抑制CFs纤维化中的作用,将高糖培养下的CFs分为TGF-β1、TUDCA(TGF-β1+TUDCA)、TUDCA+oeVec(TGF-β1+TUDCA+oeVec)、TUDCA+oeHerpud1(TGF-β1+TUDCA+oeHerpud1)组。
1.3 CFs和心肌细胞的分离培养
自行繁育的3~7 d SD乳鼠用体积分数为70%的乙醇消毒,腹腔麻醉后颈椎脱臼法处死,在无菌条件下剪开胸骨,立即取出心脏置于含有肝素钠的冷D-Hank’s溶液中,显微镜下去除残留的大血管和筋膜,缓冲液反复漂洗去除血液,用眼科剪剪成1.5~2.0 mm3的组织块,用D-Hank’s液仔细漂洗。组织块转移至15 ml离心管中,加入3 g/L的Ⅱ型胶原酶6 ml,37℃下置于水平摇床上摇动90 min,取上清液立即加入6 ml含体积分数10% FBS的DMEM培养基终止胶原酶反应,1 500 r/min离心5 min,再悬浮在含有10% FBS、100 IU/ml青霉素和100 g/ml链霉素的DMEM(高糖)中。然后,采用差速贴壁法分离CFs,在37℃培育90 min后,收集上清液,贴壁细胞就是小鼠心肌细胞(mCF),将上清液转移到新的培养皿中,同时加入5-Brdu(B5002,sigma)抑制CFs的生长,24 h后,显微镜下可见跳动的小鼠心肌细胞(mCM)。观察细胞生长情况,细胞达80%~90%融合时传代,即为原代培养的第一代,第二代至第三代CFs被用于实验。
1.4 细胞免疫荧光法鉴定CFs
采用细胞免疫荧光法鉴定CFs的纯度,鉴定标准为Vimentin(+)、α-SMA(-)和Cardiac Troponin T(-)符合三条即为CFs。将CFs均匀种于六孔板中,细胞融合到60%,弃去培养基,磷酸盐缓冲盐水(PBS)冲洗3遍,用4%多聚甲醛处理20 min,用PBS清洗3次,每次5 min,加入体积分数0.2%的Triton X-100 15 min,用PBS清洗3次,每次5 min。用5%牛血清白蛋白在室温下孵育30 min以阻断非特异性结合,然后在4℃下用抗Anti-alpha smooth muscle Actin抗体(Abcam,ab7817,1∶400)和抗Vimentin抗体(Abcam,ab92547,1∶400),Cardiac Troponin T(Abcam,ab209813,1∶400)处理过夜。第二天,清洗细胞以去除游离抗体,然后用Alexa Fluor 486山羊抗兔抗体(Life Technologies)进行染色,并用1 μg/ml DAPI核染色(D9564;Sigma Aldrich)进行反染色。所有的荧光图像都是用Nikon Eclipse Ti-U荧光显微镜获得的。
1.5 CCK-8法检测CFs活力
采用CCK-8比色法(C0037、碧云天),按生产厂家的方法测定TUDCA对CFs的毒性。培养条件:取第三代对数期CFs制成细胞悬液接种于96孔板,每孔加入细胞悬液100 μl(细胞数为每孔5×103个),在培养箱(37℃、5%CO2)中培养24 h,然后分别加入0、1、10、100和1 000 μM、10和100 mM的TUDCA培养24 h。处理后,细胞用PBS冲洗,每孔加入100 ml含有CCK-8的DMEM溶液(10 μl),然后在37℃孵育2 h,用酶标仪测定在450 nm处的吸光度(OD)值。
1.6 Transwell实验检测细胞迁移能力
使用Transwell实验评估CFs的迁移。CFs生长至70%~80%汇合时,血清饥饿过夜,加入药物干预,之后用胰蛋白酶消化并对它们进行计数,将0.15×106个细胞铺在Transwell(8 μm孔径)的顶部,该Transwell已用0.5% BSA的Hank’s平衡盐溶液包被。底部腔室含有10%血清的培养基,用作化学引诱剂。5 h后,用PBS洗涤孔,用棉签轻轻擦拭Transwell的顶面以除去非迁移细胞。在室温下向孔中加入冰冷的甲醇10 min,用自来水洗涤孔5次。然后通过加入苏木精对细胞进行染色,使其保持接触3 min,最后在自来水中冲洗孔2次。在显微镜的×20物镜下拍摄每个Transwell的照片,并为每个well拍摄6个随机选择的视野,避开外部边缘。Image J用于量化每个膜上的细胞数量。
1.7 Western blot法检测ERS通路相关蛋白和纤维化因子的表达
CFs进行相应的干预后,用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液(Beyotime,中国)裂解,然后在冰上孵育30 min。细胞裂解产物在4℃下12 000 r/min离心10 min,用BCA蛋白分析试剂盒(Beyotime,P0012)测定蛋白浓度。蛋白质样本是在5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)加载缓冲液中稀释,煮沸5 min。提取的蛋白质用10%的聚丙烯酰胺凝胶电泳法分离,转移到聚偏氟乙烯(PVDF;MA)膜上。在室温下用5%脱脂牛奶封闭60 min后加入Herpud1、GRP78、ATF6、α-SMA、Vimentin 、Cardiac Troponin T 和CollagenⅠ的多克隆抗体4℃孵育过夜。次日,用PBST洗涤后,加入相应的辣根过氧化物酶标记的二抗,在37℃下作用1 h,用ECL Western blotting底物(Pierce;Thermo Scientific)显示Western blot,并用Quantity One软件进行分析。每组实验独立重复3次。
1.8 统计学方法

2 结果
2.1 CFs的鉴定
将从健康SD乳鼠中分离的CFs进行鉴定,显微镜下观察CFs呈现不规则的长梭形,且无搏动功能。用细胞免疫荧光法鉴定CFs的纯度,见图1。

CFs中波形蛋白(Vimentin)、心肌肌钙蛋白T(Cardiac troponin T)和α-平滑肌肌动蛋白(α-SMA)的表达
2.2 TGF-β1上调CFs中ERS相关伴侣蛋白和纤维化因子
心肌纤维化主要累及CFs。在此,我们从细胞水平研究了TGF-β1对ERS相关因子和纤维化因子表达的影响。用10 ng/ml TGF-β1刺激CFs 0、6、12和24 h,发现24 h后细胞纤维化标志物CollagenⅠ、Vimentin和α-SMA的表达均显著高于Control组(均为P<0.05),ERS通路相关蛋白Herpud1、GRP78和ATF6的表达均升高(均为P<0.05),见图2。

Herpud1:同型半胱氨酸内质网应激泛素样结构域1;GRP78:葡萄糖调节蛋白78;ATF6:转录激活因子6;Vimentin:波形蛋白;α-SMA:α-平滑肌肌动蛋白;CollagenⅠ:Ⅰ型胶原蛋白;A:Western blot检测TGF-β1在不同时间处理下ERS通路相关蛋白的表达,与Control组比较,aP<0.05;与6 h组比较,bP<0.05;与12 h组比较,cP<0.05(n=3);B:Western blot检测TGF-β1在不同时间处理下纤维化相关因子的表达,与Control组比较,aP<0.05;与6 h组比较,bP<0.05;与12 h组比较,cP<0.05(n=3)

Herpud1:同型半胱氨酸内质网应激泛素样结构域1;CollagenⅠ:Ⅰ型胶原蛋白;α-SMA:α-平滑肌肌动蛋白;Vimentin:波形蛋白;TGF-β1:转化生长因子β1;HG:高糖;A:Herpud1的敲除效率,与NC组比较,aP<0.05;B:Western blot检测敲除Herpud1后纤维化相关因子的表达,与HG+siNC组比较,aP<0.05;与TGF-β1+siHerpud1组比较,bP<0.05(n=3);C:Transwell实验检测CFs的迁移
2.3 下调Herpud1基因的表达可抑制TGF-β1所诱导的CFs纤维化
通过体外培养心脏组织中的原代细胞,我们发现Herpud1在CFs中的表达明显高于心肌细胞,见图3。Herpud1在CFs中的高表达是否意味着Herpud1具有调节CFs活化的作用?为了研究Herpud1是否与CFs活化及纤维化有直接关系,我们转染siRNA-Herpud1以下调CFs中Herpud1基因的表达。与NC组相比,针对Herpud1的3个siRNA序列(siRNA1、siRNA2、siRNA3)显著降低Herpud1的表达(均为P<0.05),见图4A。在随后的实验中,我们选择了产生最大效应的小干扰RNA序列(siRNA1),并在有或无TGF-β1刺激的情况下瞬时转染CFs。与siNC组相比,siRNA-Herpud1(Herpud1 siRNA)显著降低CFs中Herpud1蛋白的水平,同时也降低了纤维化标志物CollagenⅠ、Vimentin和α-SMA的水平(均为P<0.05),见图4B,表明下调Herpud1可抑制TGF-β1诱导的CFs纤维化。同时,Transwell实验也验证了下调Herpud1可抑制CFs的迁移,见图4C。以上实验表明,敲除Herpud1可抑制CFs中TGF-β1的促纤维化作用。
2.4 TUDCA对CFs的毒性
通过CCK-8测定,检测不同浓度的TUDCA在24 h内对CFs的毒性。鉴于10 mM TUDCA在24 h后即可引起细胞毒性,因此选择100和1 000 μM TUDCA进行后续实验,见图5。

OD:吸光度;TUDCA:牛磺熊去氧胆酸;与0 μM TUDCA组比较,aP<0.05
2.5 TUDCA抑制TGF-β1诱导的CFs活化和ERS
首先,我们研究了TUDCA对ERS通路相关蛋白的影响。Western blot结果显示,TGF-β1刺激的ATF6、GRP78和Herpud1蛋白水平高于HG组,然而,相较于TGF-β1干预组,TUDCA干预显著降低了这些蛋白的水平,并且1 000 μM TUDCA产生的作用强于100 μM TUDCA(P<0.05),见图6。免疫荧光染色结果显示,TGF-β1刺激的α-SMA的表达显著升高,TUDCA干预逆转了TGF-β1对α-SMA的作用,见图7A。Western blot结果显示,TGF-β1刺激的CollagenⅠ、Vimentin和α-SMA蛋白水平高于对照组,然而,TUDCA干预逆转了TGF-β1对这些蛋白的影响(P<0.05),见图7B。进一步实验表明,TUDCA干预可抑制TGF-β1诱导的CFs活化和ERS。
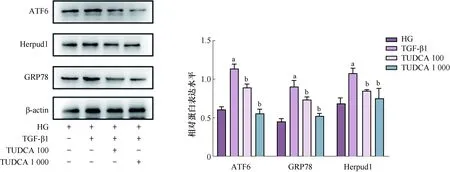
ATF6:转录激活因子6;Herpud1:同型半胱氨酸内质网应激泛素样结构域1;GRP78:葡萄糖调节蛋白78;HG:高糖;TGF-β1:转化生长因子β1;TUDCA:牛磺熊去氧胆酸;Western blot检测ERS通路信号因子的表达,与HG组比较,aP<0.05;与TGF-β1组比较,bP<0.05(n=3)

TGF-β1:转化生长因子β1;TUDCA:牛磺熊去氧胆酸;α-SMA:α-平滑肌肌动蛋白;Vimentin:波形蛋白;CollagenⅠ:Ⅰ型胶原蛋白;HG:高糖;A:免疫荧光染色法检测CFs纤维化因子的表达(×100);B:Western blot检测TUDCA对纤维化相关因子的影响,与HG组比较,aP<0.05;与TGF-β1组比较,bP<0.05(n=3)
2.6 过表达Herpud1逆转了TUDCA对TGF-β1诱导的CFs纤维化的抑制作用
最后,我们研究了TUDCA对TGF-β1诱导的CFs纤维化的抑制作用是否通过Herpud1介导。使用过表达的方法促进CFs中Herpud1蛋白的表达。
结果表明,TUDCA可抑制TGF-β1所诱导的Herpud1的水平,同时,TUDCA对TGF-β1诱导的CFs纤维化的抑制作用可被Herpud1过表达所抑制,但在TUDCA+oeVec处理的细胞中不能实现(P<0.05),见图8。这些结果表明,Herpud1过表达可逆转TUDCA对TGF-β1诱导的CFs纤维化的抑制作用。

Vimentin:波形蛋白;α-SMA:α-平滑肌肌动蛋白;CollagenⅠ:Ⅰ型胶原蛋白;Herpud1:同型半胱氨酸内质网应激泛素样结构域1;TGF-β1:转化生长因子β1;TUDCA:牛磺熊去氧胆酸;Western blot检测过表达Herpud1后纤维相关因子的表达,与TGF-β1组比较,aP<0.05;与TUDCA+oeVec组比较,bP<0.05(n=3)
3 讨论
近年来,糖尿病及其并发症的患病率呈逐年上升趋势,严重影响居民的健康生活,成为一个日益严重的公共健康风险[13]。DCM是发生在糖尿病患者身上的一种独立于冠心病、心脏瓣膜病等心血管疾病的影响心脏结构和功能的病变[14]。DCM的主要病理特征是心肌间质纤维化、心脏重构和舒张功能障碍,最终发展为收缩功能障碍的心力衰竭[15]。其发病机制非常复杂,但确切的机制目前未明。因此,在这里我们主要探索心肌纤维化的机制及阻断或延缓其进展的药物。CFs活化所导致的细胞外基质的沉积被认为是心肌纤维化的基础。其中,TGF-β被认为是心肌纤维化过程中的一个关键调节因子,在CFs活化中起着重要的调控作用[16]。DCM中,高糖可增加CFs中TGF-β1基因的转录和下游信号的激活,促进DCM心肌纤维化过程[17]。因此,抑制TGF-β1介导的CFs活化可有效预防和控制DCM。寻找潜在的抑制心肌纤维化、改善心脏功能的药物对治疗糖尿病具有十分重要的作用。
内质网是真核细胞中主要负责蛋白质合成、折叠和修饰的细胞器。正确折叠和修饰的蛋白质被运送到高尔基体,与胞膜融合,释放到细胞外空间。糖尿病本身是一种错误折叠蛋白疾病,大量错误折叠或未折叠的蛋白于内质网腔积聚,引起ERS并激活未折叠蛋白反应[18]。目前研究认为ERS与DCM的发生发展相关。许多药物可通过抑制ERS来减少心肌细胞凋亡,改善心脏功能,延缓DCM的发生发展[8]。值得注意的是,ERS与TGF-β信号转导、氧化应激和蛋白尿密切相关[19]。Herpud1是锚定在内质网的跨膜蛋白,其N端和C端均暴露于细胞质中,是UPR的下游靶蛋白和ERAD的组成部分和调节者[20]。Herpud1蛋白的表达水平与ERS的程度呈正相关。研究发现,Herpud1基因的启动子区存在ERS反应原件,在ERS状态下,多种特异的转录因子(如XBP-1、CHOP等)与ERS反应原件结合以促进Herpud1基因的转录[20]。我们的前期研究发现,Herpud1参与动脉粥样硬化的形成。通过转染Herpud1 siRNA,我们发现沉默内皮细胞中的Herpud1蛋白,可部分逆转内皮细胞损伤,改善内皮功能[9, 21]。但是,Herpud1在DCM的中的表达和作用并不明确。目前有关糖尿病和细胞表型改变的研究中,Herpud1被报道可影响胰岛素的分泌,参与骨骼肌的糖代谢[22-23]。Herpud1在成骨细胞分化过程中同样发挥重要作用,Herpud1敲除可抑制前成骨细胞向成骨细胞分化,减少骨矿物质的沉积[24]。我们的前期研究表明,敲除Herpud1能抑制血管平滑肌细胞由收缩型向合成型分化,减轻动脉粥样硬化的形成[8]。然而,Herpud1在DCM发病和CFs活化中的作用和机制并不清楚。通过预实验体外培养心脏组织中的各种细胞,我们发现Herpud1在CFs中的表达明显高于心肌细胞。Herpud1在CFs中的高表达是否意味着Herpud1具有调节CFs活化的作用呢?通过体外培养CFs,我们发现沉默Herpud1基因可逆转TGF-β1诱导的CFs活化。上述结果提示,Herpud1可能在DCM的CFs活化中起重要作用。
TUDCA是公认的ERS抑制剂。TUDCA的化学名称为3α,7β二羟基胆烷酰-N-牛磺酸,是由牛磺酸结合熊去氧胆酸,通过肠道菌群二次加工的产物。TUDCA目前主要用于治疗胆囊胆固醇结石、原发硬化性胆管炎、原发胆汁性肝硬化等[10]。有研究发现,TUDCA可减轻压力负荷引起的心功能障碍[11],并通过抑制ERS减少糖尿病小鼠心肌缺血再灌注后巨噬细胞和中性粒细胞的浸润,从而减少心细胞凋亡和炎症反应[12]。相关实验证明,TUDCA通过抑制TSP-1/TGF-β1途径减轻慢性间歇性低氧所诱导的肺纤维化[25]。并且作为ERS的抑制剂,TUDCA可通过减轻ERS来缓解压力负荷所致的心肌重构[26]。但截至目前,并未有研究探究TUDCA在DCM中的作用及其可能机制,以及ERS在DCM中的作用。本研究发现,TUDCA通过下调Herpud1来调节ERS,进而延缓TGF-β1介导的心肌纤维化,过表达Herpud1后,则可缓解TUDCA对TGF-β1介导的心肌纤维化的抑制作用。提示TUDCA有可能成为治疗DCM心肌纤维化的有效药物。
本研究以Western blot为主要分析方法。然而,其只能用于定性鉴定蛋白质或粗略地半定量蛋白质水平。对于未来的研究,还需要更多的重复性实验和成纤维细胞特异性敲除的动物模型来证实本研究的结论。此外,有研究表明,高糖等因素可活化TGF-β1,随后与其Ⅱ型受体结合,继而募集并结合TGF-β1 RI,然后引起受体Smads蛋白家族的胞浆蛋白磷酸化,促进CFs活化[6]。因此,仍需进一步的研究来明确ERS调节成纤维细胞活化的机制。
综上所述,本研究首次发现TUDCA能通过ERS通路来抑制TGF-β1所诱导的CFs纤维化。本研究初步证实了TUDCA对心肌纤维化的抑制作用,为后续临床开展相关研究探索TUDCA干预DCM患者提供了科学依据,为拓展TUDCA的临床适应证提供了实验基础。进一步的实验证明,Herpud1在DCM的发生发展中发挥了重要的作用,调节CFs内Herpud1水平有望成为干预DCM的新的研究方向。
利益冲突:无
