苦参醇F对溃疡性结肠炎小鼠的干预作用Δ
2024-03-04何旭东倪皓雨何金彪李敏胡蕴铠龚弟鸿姚金铃俞捷杨兴鑫云南中医药大学中药学院昆明650500
何旭东,倪皓雨,何金彪,李敏,胡蕴铠,龚弟鸿,姚金铃,俞捷 ,杨兴鑫 (云南中医药大学中药学院,昆明 650500)
溃疡性结肠炎(ulcerative colitis,UC)是一种以结肠黏膜连续性炎症累积为特征的炎症性肠病,以血性腹泻为主要临床症状,还包括腹痛、便血、体重减轻、里急后重、呕吐等其他症状[1],严重影响患者的生活质量。目前,UC的主要治疗药物是抗炎药物和免疫调节药物,这些药物虽可缓解UC症状,但长期服用会导致患者皮肤坏死、血小板减少、造血功能抑制等[2]。因此,有必要寻找新的UC治疗策略。
研究表明,抑制炎症反应、促进肠道黏膜愈合可有效缓解UC[3]。苦参醇F(kushenol F,KSC-F;结构式见图1)是中药苦参的特征性成分,属异戊烯基黄酮类,有抗菌、抗肿瘤、抗炎等药理活性[4],具有良好的开发前景。研究表明,10 mg/kg的KSC-F可通过降低核因子κB(nuclear factor-κB,NF-κB)的磷酸化水平以及NF-κB抑制因子激酶(inhibitor of NF-κB kinase,IKK)和白细胞介素1β(interleukin-1β,IL-1β)、IL-6的mRNA表达水平来抑制炎症反应,从而缓解炎症相关症状[5]。UC属于慢性炎症性肠道疾病,炎症反应是其发展和恶化的重要机制之一,抑制炎症反应、减轻炎症损伤是治疗UC的关键,但KSC-F能否通过抑制结肠炎症相关蛋白的表达来抑制炎症反应,进而发挥抗UC作用尚不清楚。为此,本研究拟初步探究KSC-F对UC的干预作用,以期为UC治疗新药的先导化合物的开发提供参考。
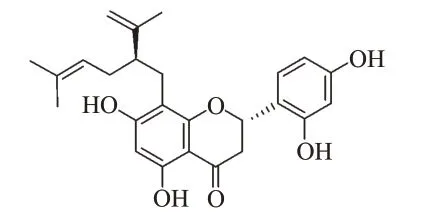
图1 KSC-F的结构式
1 材料
1.1 主要仪器
本研究所用主要仪器包括SpectraMax®Plus 384型光吸收酶标仪(美国Molecular Devices公司),Eclipse E100型正置光学显微镜、Nikon DS-Ri1-U3型数码显微成像系统(日本Nikon公司),LightCycler®96型实时荧光定量(PCR)仪购自瑞士Roche公司,ChemiDoc XRS型化学发光成像系统[赛默飞世尔(中国)科技有限公司],RM2016型病理切片机(上海徕卡仪器有限公司),JB-P5型组织包埋机(武汉俊杰电子有限公司),KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司),Milli-Q型超纯水系统(美国Millipore公司)等。
1.2 主要药品与试剂
KSC-F对照品(货号JOT-10801,纯度>98%)购自成都普菲德生物技术有限公司;柳氮磺吡啶肠溶片(批号09221203,规格0.25 g)购自上海信谊天平药业有限公司;葡聚糖硫酸钠(dextran sulfate sodium,DSS;货号160110)产自美国MP Biomedicals公司,购自广州亿宁生物技术有限公司;IL-1β、IL-6、IL-8、IL-10、IL-17、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(ELISA)检测试剂盒均购自江苏酶联生物科技有限公司;兔源IL-1β、叉头框蛋白O1(forkhead box O1,FOXO1)、磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)、p38促分裂原活化的蛋白激酶(p38 mitogenactivated protein kinase,p38 MAPK)、磷酸化p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、β-肌动蛋白(β-actin)抗体(货号分别为26048-4-AP、18592-1-AP、20584-1-AP、14064-1-AP、28796-1-AP、66444-1-lg、20536-1-AP)均购自美国Proteintech公司;兔源磷酸化PI3K(phosphorylated PI3K,p-PI3K)抗体(货号17366S)购自美国Cell Signaling Technology公司;蛋白定量试剂盒(BCA法)、RIPA裂解缓冲液购自上海碧云天生物技术股份有限公司;环保型脱蜡液、通用型组织固定液、苏木精-伊红(HE)染液套装均购自武汉塞维尔生物科技有限公司;实时聚合酶链反应(real-time PCR,RT-PCR)检测试剂盒购自赛默飞世尔(中国)科技有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、5%脱脂奶粉、10×电转液、10×TBST缓冲液、5×Tris甘氨酸-电泳缓冲液均购自北京索莱宝科技有限公司。
1.3 实验动物
SPF级雄性C57BL/6J小鼠,体重20~22 g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号为SCXK(京)2019-0010。所有动物均饲养于温度18~22 ℃、相对湿度50%~60%、每12 h光明/黑暗交替的环境下,自由摄食、饮水,经适应性喂养1周后进行后续实验。本研究方案经云南中医药大学动物实验伦理审查委员会审批,批件号为R-062023111。
2 方法
2.1 分组、造模与给药
将30只小鼠随机分为5组,分别为正常组、模型组、阳性对照组、KSC-F 50 mg/kg组(KSC-F50组)、KSC-F 100 mg/kg组(KSC-F100组),每组6只。除正常组小鼠饮用水外,其余各组小鼠均饮用3%DSS水溶液,连续7 d;与此同时,KSC-F50、KSC-F100组小鼠分别灌胃KSCF 50、100 mg/kg,阳性对照组小鼠灌胃柳氮磺吡啶703 mg/kg,正常组和模型组小鼠灌胃等体积生理盐水,每天1次,连续10 d。KSC-F的剂量参考Jo等[5]的研究;柳氮磺吡啶的剂量则根据成人(体重70 kg)临床剂量换算而得;所有灌胃药液均以N,N-二甲基乙酰胺(2.5%)+吐温80(2.5%)+生理盐水(95.0%)的混合溶液为溶剂。
2.2 一般情况观察及疾病活动指数计算
实验期间,于每天给药前称定并记录各组小鼠体重,观察其粪便排泄情况。于末次给药后、采样前,参照相关文献方法[6]计算各组大鼠的疾病活动指数(disease activity index,DAI),DAI=(体重减少比例评分+粪便出血评分+粪便硬度评分)/3。各项具体评分标准如表1所示,DAI评分>0.5表明UC模型复制成功[6]。

表1 DAI评分标准
2.3 样本采集
末次给药后,各组小鼠腹腔注射1%戊巴比妥钠(50 mg/kg)进行麻醉,于眼眶取血,血样在室温下放置1 h后,在4 ℃下以3 000 r/min离心15 min,分离上层血清,备用。取血后,各组小鼠以颈椎脱位法处死,打开腹腔,完整取出其结肠组织,测量结肠长度后,部分结肠组织用4%多聚甲醛溶液固定,用于病理形态观察;另一部分结肠组织于-80 ℃下保存,用于后续指标检测。
2.4 结肠组织病理形态观察
取“2.3”项下固定的各组小鼠结肠组织适量,经乙醇逐级脱水、二甲苯透明后,行常规石蜡包埋、切片。切片烘干后行脱蜡及乙醇脱水处理,再依次用苏木精、伊红染液染色,经二甲苯透明后,以中性树胶封片,使用光学显微镜进行病理形态观察及图像采集。
2.5 血清及结肠组织中炎症因子水平检测
取“2.3”项下各组小鼠血清样品适量,按相应试剂盒说明书方法操作,以酶标仪检测血清中IL-1β、IL-6、IL-8、IL-10、TNF-α水平。取“2.3”项下各组小鼠冻存的结肠组织适量,加入磷酸盐缓冲液(pH7.4),匀浆,于4 ℃下以12 000 r/min离心15 min,收集上清液,以BCA法定量后,按相应试剂盒说明书方法操作,以酶标仪检测结肠组织中IL-1β、IL-6、IL-8、IL-10、IL-17、TNF-α水平。
2.6 结肠组织中炎症因子mRNA表达水平检测
采用RT-PCR法检测。取“2.3”项下冻存的正常组、模型组、KSC-F50组、KSC-F100组小鼠结肠组织各适量,利用Trizol试剂提取其总RNA并逆转录为cDNA,再以所得cDNA为模板进行PCR扩增。总反应体积为20 μL,包括SYBR Premix Ex TaqⅡ(9 μL)、上游引物(0.3 μL)、下游引物(0.3 μL)、cDNA模板(2 μL)和ddH2O(8.4 μL)。反应条件如下:95 ℃预变性30 s;95 ℃变性5 s,62 ℃退火和延伸20 s,共40个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用2-ΔΔCt法计算目的基因mRNA的表达水平。各目的基因PCR扩增的引物序列和产物长度见表2。

表2 各目的基因PCR扩增的引物序列和产物长度
2.7 结肠组织中炎症相关蛋白表达水平检测
采用Western blot法检测。取“2.3”项下冻存的正常组、模型组、KSC-F50组、KSC-F100组小鼠结肠组织各适量,加入RIPA裂解液,于4 ℃下研磨后,再于冰上放置30 min,以3 500 r/min离心15 min,收集上清液,以BCA法定量后作变性处理。取变性后的蛋白样品适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转至PVDF膜上,以5%脱脂奶粉封闭;洗膜后,加入IL-1β、FOXO1、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK、p-Akt、β-actin一抗(稀释比例均为1∶1 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶5 000),室温孵育2 h;洗膜3次,利用化学发光酶标底物显色后,置于化学发光成像系统下成像。以β-actin为内参,使用Image J软件分析各目的蛋白的条带灰度值,以目的蛋白与内参的灰度值比值表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 21.0软件对数据进行统计分析。数据均以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 KSC-F对UC小鼠一般情况及结肠组织病理形态的影响
在饮用DSS水溶液后,模型组小鼠的体重整体呈下降趋势,DAI评分较正常组显著升高(P<0.01)且超过0.5;结肠较正常组显著缩短(P<0.01),结肠组织的隐窝结构大量受损,杯状细胞明显减少,炎症细胞浸润严重。经药物干预后,各药物组小鼠体重减轻的情况有所改善,DAI评分均较模型组显著降低(P<0.01);同时,小鼠结肠均较模型组显著延长(P<0.01),结肠组织的隐窝结构形态得到明显改善,且可见大量杯状细胞,炎症细胞浸润情况亦有所减轻。结果见图2。
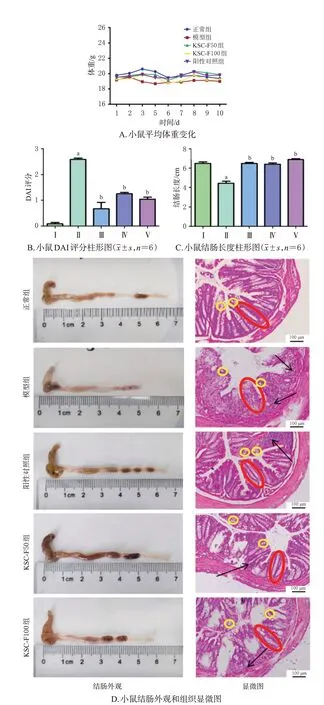
图2 KSC-F对UC小鼠一般情况及结肠组织病理形态的影响
3.2 KSC-F对UC小鼠血清及结肠组织中炎症因子水平的影响
与正常组比较,模型组小鼠血清促炎因子IL-1β、IL-6、IL-8、TNF-α水平均显著升高(P<0.01),抗炎因子IL-10虽有下降但差异无统计学意义(P>0.05)。与模型组比较,各药物组血清IL-1β、IL-6(KSC-F50组除外)、IL-8、TNF-α水平均显著降低,IL-10水平均显著升高(P<0.05或P<0.01)。结果见图3。
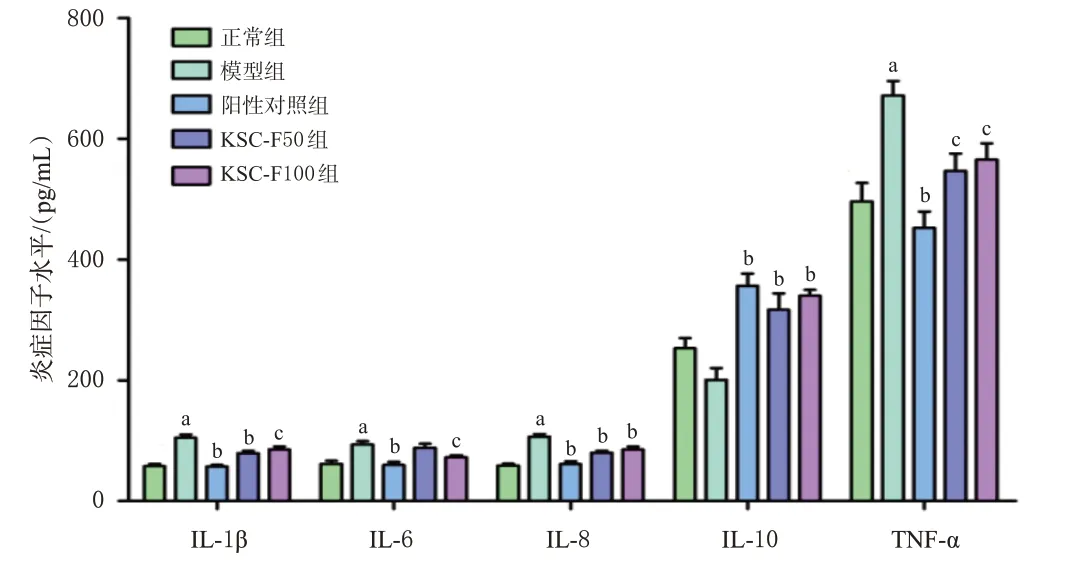
图3 KSC-F对UC小鼠血清炎症因子水平的影响(±s,n=6)
与正常组比较,模型组小鼠结肠组织中促炎因子IL-1β、IL-6、IL-8、IL-17、TNF-α水平均显著升高(P<0.05或P<0.01),抗炎因子IL-10虽有下降但差异无统计学意义(P>0.05)。与模型组比较,各药物组小鼠结肠组织中IL-1β(阳性对照组除外)、IL-6、IL-17、TNF-α(阳性对照组、KSC-F100组除外)水平均显著降低,IL-10水平(阳性对照组除外)均显著升高(P<0.05或P<0.01),IL-8虽有下降但差异均无统计学意义(P>0.05)。结果见图4。
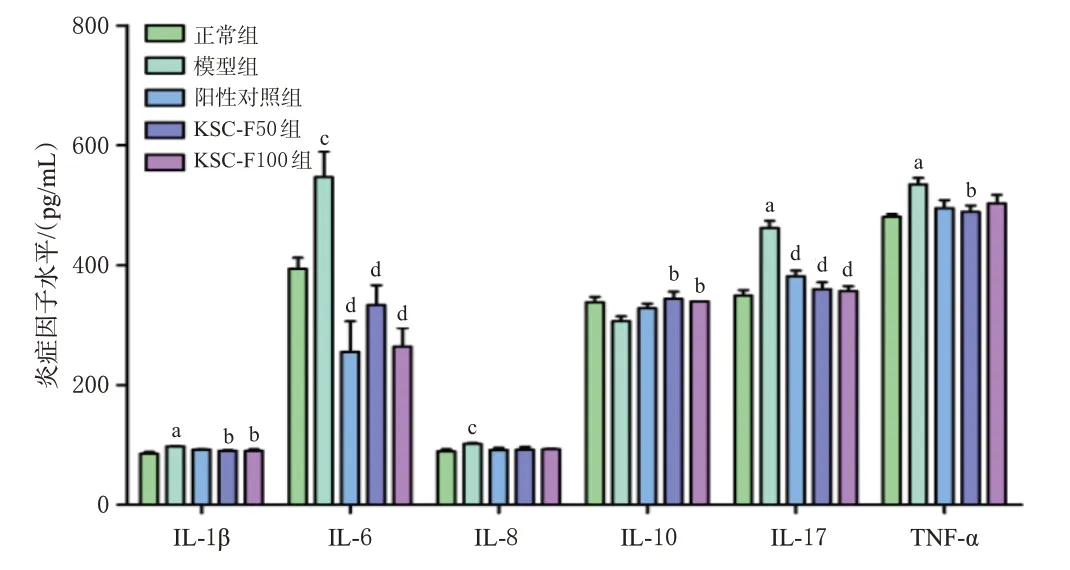
图4 KSC-F对UC小鼠结肠组织中炎症因子水平的影响(±s,n=6)
3.3 KSC-F对UC小鼠结肠组织中炎症因子mRNA表达的影响
与正常组比较,模型组小鼠结肠组织中IL-1β、IL-17、TNF-α mRNA的表达水平均显著升高(P<0.01),IL-6 mRNA虽有升高、IL-10 mRNA虽有下降,但差异均无统计学意义(P>0.05)。与模型组比较,各药物组小鼠结肠中IL-1β(KSC-F50除外)、IL-17、TNF-α(KSC-F50除外)mRNA的表达水平均显著降低(P<0.01),IL-6、IL-10 mRNA的表达虽有回调但差异均无统计学意义(P>0.05)。结果见图5。
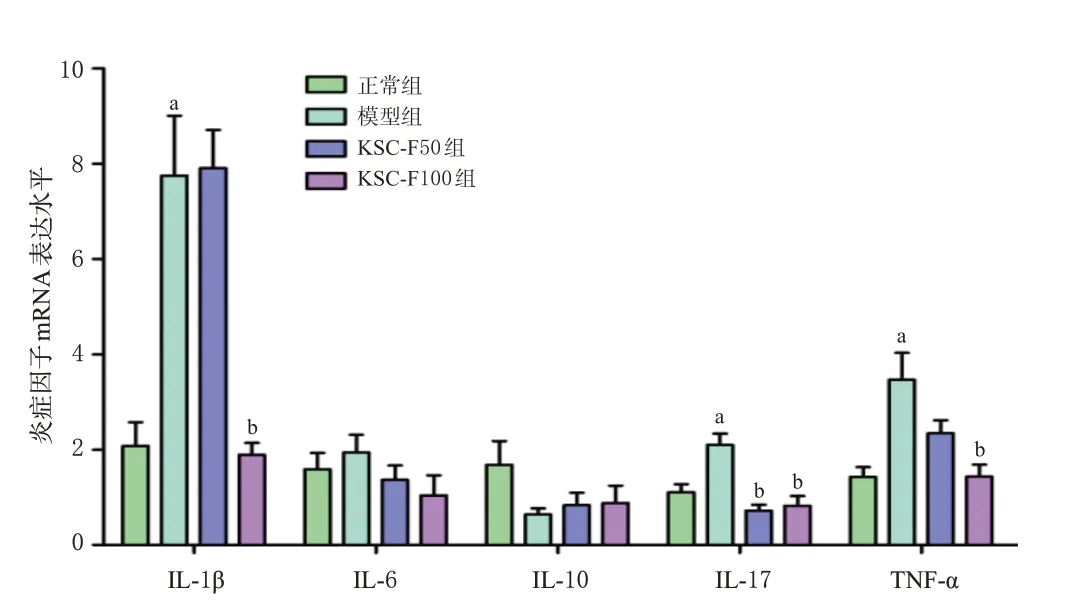
图5 KSC-F对UC小鼠结肠组织中炎症因子mRNA表达的影响(±s,n=6)
3.4 KSC-F对UC小鼠结肠组织中炎症相关蛋白表达的影响
与正常组比较,模型组小鼠结肠组织IL-1β、p-Akt、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK蛋白的表达水平虽有升高,FOXO1蛋白的表达水平虽有降低,但差异均无统计学意义(P>0.05);与模型组比较,KSC-F100组小鼠结肠组织中p-Akt、p-PI3K、p-p38 MAPK蛋白的表达水平均显著降低,FOXO1蛋白的表达水平显著升高(P<0.05或P<0.01)。结果见图6。
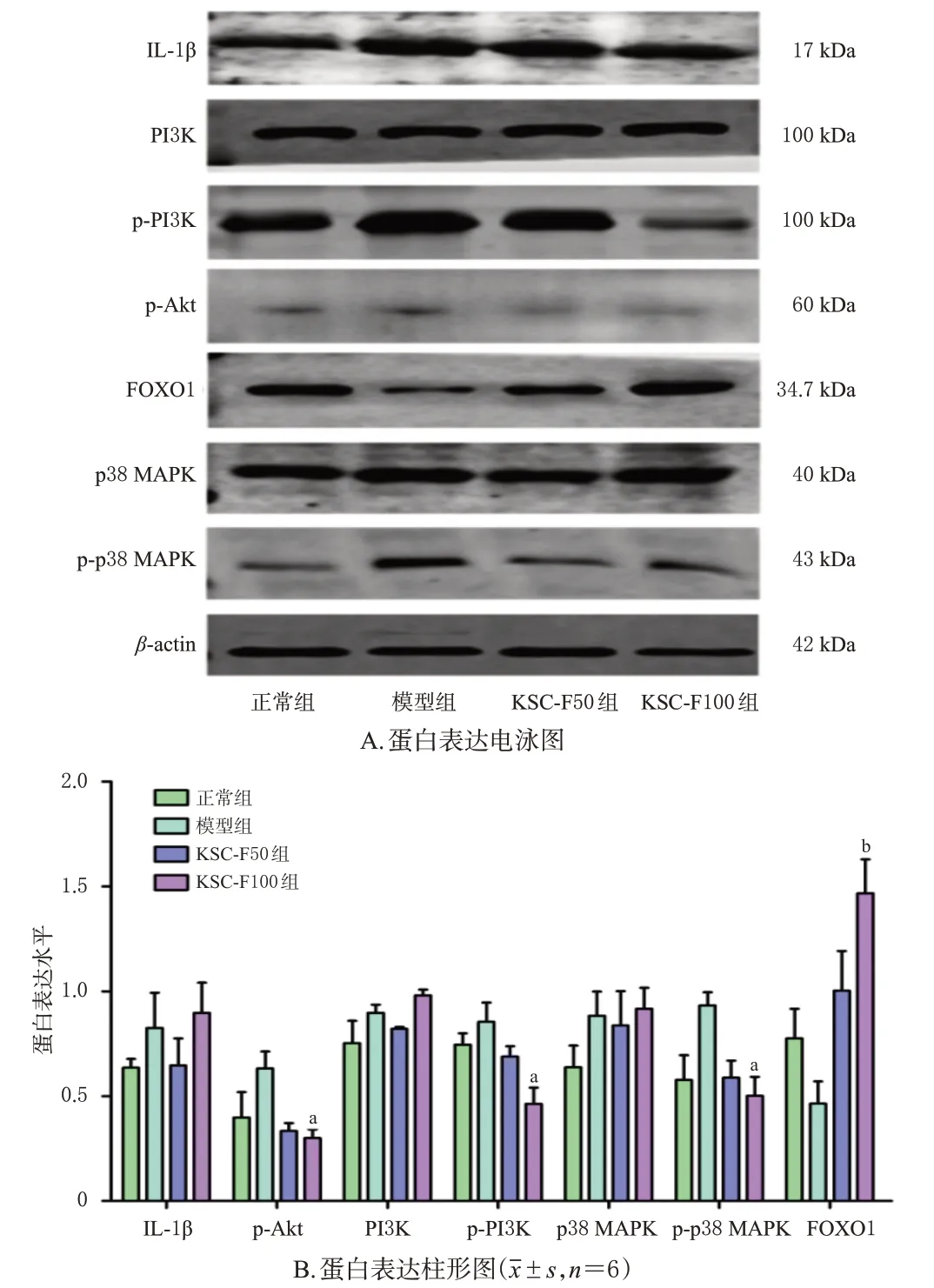
图6 KSC-F对UC小鼠结肠组织中炎症相关蛋白表达的影响
4 讨论
UC的典型临床症状包括大便出血、腹泻和体重减轻[1]。目前,UC的发病原因尚不明确,但可能与自身免疫、遗传、感染和过敏等因素有关[2]。UC的病理特征为存在于结肠黏膜至直肠近端的持续性、弥散性炎症[7]。此外,在发病过程中,PI3K/Akt信号通路及FOXO-1、IL-1β、p38 MAPK蛋白被激活,进而促进中性粒细胞和巨噬细胞释放炎症因子,引发炎症反应;炎症反应又导致结肠黏膜血管扩张、血管通透性增加,血液和免疫细胞渗入组织间隙,从而引起组织水肿、纤维化和溃疡形成[8-11]。可见,控制炎症反应、减轻炎症损伤是治疗UC的关键。柳氮磺吡啶是临床治疗UC的常用药物,其抗炎活性确切,故被选作本研究的阳性对照药物。
在结肠炎症中,促炎因子TNF-α上调会破坏结肠上皮屏障,促进IL-6、IL-1β产生;与此同时,作为抗炎因子的IL-10则可维持胃肠道稳态[12]。KSC-F是从苦参中发现的一种异戊烯基黄酮类成分,已被证实具有抗肿瘤、抗菌、抗炎等药理活性[4-5]。本研究结果显示,50、100 mg/kg的KSC-F可改善UC小鼠体重减轻的情况,显著降低DAI评分,显著增加结肠长度及结肠组织中杯状细胞数量,改善隐窝结构形态,减轻炎症细胞浸润,能不同程度地降低模型小鼠血清中IL-1β、IL-6、IL-8、TNF-α和结肠组织中IL-1β、IL-6、IL-17、TNF-α水平,以及结肠组织中IL-1β、IL-17、TNF-α mRNA的表达水平,提示KSCF具有改善UC小鼠结肠组织病变和炎症反应的作用。
PI3K的激活可活化Akt,从而促进炎症细胞的激活和炎症因子的产生[8]。此外,活化的Akt可负反馈调节FOXO1的表达,从而进一步增加IL-1β的表达,而IL-1β可进一步激活p38 MAPK,从而加剧炎症反应[13-15]。研究表明,MHY2013可通过抑制Akt和p38 MAPK的激活,增加FOXO1蛋白的表达,抑制IL-1β的转录,从而减轻胰岛素抵抗引起的炎症反应,提示PI3K、Akt、p38 MAPK蛋白的激活与炎症反应的发生发展密切相关[15]。本研究结果显示,在DSS诱导的模型组小鼠中,其结肠组织中IL-1β、p-Akt、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK蛋白的表达虽较正常组有所上升,FOXO1蛋白的表达虽有所下降,但差异均无统计学意义。本课题组推测这些蛋白可能参与了UC的发生发展,但可能并非主要机制,有待进一步验证。本研究结果还显示,50、100 mg/kg的KSC-F能不同程度地下调p-Akt、p-PI3K、pp38 MAPK蛋白的表达,同时上调FOXO1蛋白的表达,提示KSC-F可通过抑制PI3K、Akt、p38 MAPK蛋白的激活,增加FOXO1蛋白的表达来缓解UC小鼠的炎症反应。
柳氮磺吡啶已被广泛应用于UC、克罗恩病和类风湿性关节炎等炎症性疾病的临床治疗,成人用药剂量为57 mg/(kg·d),按成人体重70 kg换算,小鼠给药剂量为703 mg/(kg·d)。本研究结果证实,100 mg/(kg·d)的KSC-F对UC小鼠炎症反应具有明显的抑制作用,且剂量低于阳性对照药,提示KSC-F的临床有效剂量可能更低。
综上所述,KSC-F可通过抑制PI3K、Akt、p38 MAPK蛋白的激活,抑制IL-1β、IL-6、TNF-α等促炎因子的释放,促进抗炎因子IL-10的分泌,减轻结肠组织炎症损伤,从而改善UC小鼠的相关症状。但KSC-F能否通过影响其他机制(如肠道微生物、体内免疫系统)来发挥抗UC作用仍有待后续研究深入探讨。
