高迁移率族蛋白1对低氧状态下肺动脉平滑肌细胞的影响研究
2024-03-04李鸣远李倩武云
李鸣远,李倩,武云
作者单位:830054 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第一附属医院全科医学科
肺动脉高压(pulmonary arterial hypertension,PAH)是一种由多因素所致的呼吸系统疾病,表现为进行性肺血管重塑、肺动脉压持续升高,随着病情持续进展,会引发右心室代偿性肥厚,最终导致右心衰竭[1]。以中小肺动脉壁增厚和管腔闭塞为特征的肺血管重塑是PAH患者肺血管阻力和肺动脉压升高的主要原因。肺动脉平滑肌细胞(pulmonary arterial smooth muscle cell,PASMC)作为肺血管壁的主要成分,其异常增殖和迁移是肺血管重塑的主要特征,也是PAH发生和疾病进展的基础[2-3]。细胞焦亡是一种新型程序性细胞死亡形式,表现为细胞膜不断扩张,引起细胞肿胀、破裂,并释放大量促炎因子。在低氧环境下PASMC会发生细胞焦亡,这与PAH的发病机制密切相关[4]。
高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种染色质相关蛋白,在某些应激条件下,其从巨噬细胞、单核细胞、内皮细胞或其他免疫活性细胞中释放,并通过与受体结合来促进细胞增殖、迁移和分化[5]。HMGB1现已被确定为PAH的生物标志物,在PAH患者的肺组织和血清中HMGB1水平异常升高,并且与疾病严重程度呈正相关[6]。HMGB1靶向治疗可能成为PAH的有效治疗策略。然而,HMGB1如何驱动PAH发病的分子机制仍有待阐明。基于此,本研究以PASMC为研究对象,观察HMGB1对低氧状态下PASMC增殖和迁移的影响,并进一步探讨HMGB1中和抗体(HMGB1 Ab)治疗PAH的可能机制。
1 材料与方法
1.1 主要材料与试剂
本实验时间为2022年3月—2023年9月。PASMC购于武汉云克隆科技股份有限公司,HMGB1 Ab购于沈阳万类生物科技有限公司,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain like receptor protein 3,NLRP3)炎症小体激动剂——单钠尿酸盐(monosodium urate,MSU)购于美国InvivoGen公司,胎牛血清、牛血清白蛋白、DMEM培养基及胰酶购于美国Hyclone公司,CCK-8细胞增殖检测试剂盒购于上海贝博生物科技有限公司,Triton X-100购于武汉伊莱瑞特生物科技股份有限公司,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染料购于北京康瑞纳生物科技有限公司,TRIzol RNA提取试剂盒购于美国Invitrogen公司,cDNA第一链合成试剂盒和探针法荧光定量PCR检测试剂盒购于南京诺唯赞生物科技股份有限公司,Bradford蛋白质定量试剂盒购于北京百奥莱博科技有限公司,封闭用脱脂奶粉购于北京伊塔生物科技有限公司,RIPA裂解液和ECL试剂液购于上海碧云天生物技术研究所,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购于美国Thermo Fisher公司,AlexaFluor 488荧光标记的山羊抗兔IgG抗体和辣根过氧化物酶标记的山羊抗兔IgG抗体购于北京百奥莱博科技有限公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、HMGB1、NLRP3、天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)、gasdermin D(GSDMD)、白介素1β(interleukin 1β,IL-1β)、白介素18(interleukin 18,IL-18)兔多克隆抗体以及GAPDH兔多克隆抗体购于英国Abcam公司。
1.2 PASMC培养、分组及处理
将PASMC置于含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2条件下培养,常规传代,选用第3~5代细胞进行后续实验。将PASMC分为4组:(1)对照组:PASMC置于37 ℃、21% O2、5% CO2培养箱中常氧培养24 h;(2)低氧组:PASMC置于37 ℃、3% O2、5% CO2培养箱中低氧培养24 h;(3)HMGB1 Ab组:PASMC置于37 ℃、3% O2、5% CO2培养箱中低氧培养24 h,加入终浓度为20 μg/ml的HMGB1 Ab培养3 h;(4)HMGB1 Ab+MSU组:PASMC置于37 ℃、3% O2、5% CO2培养箱中低氧培养24 h,加入终浓度为20 μg/ml的HMGB1 Ab培养3 h,然后采用终浓度为200 g/L的MSU活化细胞3 h。
1.3 CCK-8法检测细胞增殖活力
将PASMC以5×103个/孔的密度种植在96孔板中,每组设置6个复孔,分组及处理同1.2。按照CCK-8细胞增殖检测试剂盒说明书,每孔加入10 μl CCK-8,继续培养4 h,采用酶标仪测定各孔在450 nm波长处的OD值,代表细胞增殖活力。
1.4 细胞划痕实验检测细胞迁移能力
胰酶消化各组PASMC,制备细胞悬液,按照5×105个/孔的密度将PASMC种植在划好标记线的6孔板中,生长24 h待细胞铺满后,使用10 μl无菌枪头在细胞的中央区域垂直划线,使划痕与标记线相交,PBS洗去划下的细胞。将细胞放入37 ℃、5% CO2条件下培养。24 h后取出细胞培养板,在显微镜下观察划痕并拍照,以0 h作为对照,采用Image Pro Plus分析划痕愈合情况,计算划痕愈合率〔划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%〕,代表细胞迁移能力。
1.5 免疫荧光染色观察PASMC中α-SMA表达情况
将PASMC以1×104个/孔的密度种植于含盖玻片的24孔板上,过夜培养至细胞爬片贴壁后,进行对应分组处理。采用PBS洗涤爬片,采用4%多聚甲醛溶液固定10 min,吸去多余液体,再次采用PBS洗涤后加入0.3%Triton X-100透化10 min,采用PBS洗涤,采用5%牛血清白蛋白封闭非特异性结合位点。在玻片上滴加α-SMA兔多克隆抗体(1∶200),放入湿盒内于4 ℃孵育过夜。次日,采用PBS洗涤后滴加AlexaFluor 488荧光标记的山羊抗兔IgG抗体(1∶500),常温下避光孵育2 h。采用PBS再次洗涤后,进行DAPI细胞核染色,采用抗荧光淬灭封片剂封固,晾干,荧光共聚焦显微镜下观察细胞染色情况并拍照。
1.6 实时荧光定量反转录聚合酶链式反应(real time quantity polymerase chain reaction,qRT-PCR)检测PASMC中HMGB1及细胞焦亡相关因子(NLRP3、Caspase-1、GSDMD、IL-1β、IL-18)的mRNA相对表达量
采用TRIzol法提取各组PASMC总RNA,吸取1 μl总RNA样品,通过微量光度计测定样品纯度与浓度,采用1.5%琼脂糖凝胶电泳法检测RNA完整性。按照cDNA第一链合成试剂盒说明书步骤反转录合成cDNA。通过ABI QuantStudio5定量PCR仪测定各目的基因mRNA相对表达量,根据探针法荧光定量PCR检测试剂盒说明书配置反应体系,混匀后置于定量系统上,设置反应条件为:95 ℃ 15 min,1个循环;95 ℃ 10 s、60 ℃ 30 s,共40个循环,各引物序列见表1,采用2-ΔΔCt法分析目的基因相对表达量,以β-actin为内参基因。实验重复3次。

表1 引物序列Table 1 Primer sequence
1.7 Western blot法检测PASMC中HMGB1及细胞焦亡相关因子(NLRP3、Caspase-1、GSDMD、IL-1β、IL-18)相对表达量
取各组PASMC,加入适量RIPA裂解液,冰上静置裂解30 min,于4 ℃条件下以12 000 r/min离心10 min(离心半径12.5 cm),获取上清液即为蛋白,采用Bradford法测定其浓度。将蛋白加热变性,将经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离变性后的等量蛋白电转至PVDF膜上,采用5%脱脂牛奶封闭非特异性结合位点后,分别加入稀释的HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18抗体液(1∶1 000),以GAPDH作为内参蛋白,于4 ℃孵育过夜。次日,加入稀释后的相应二抗液(1∶5 000),室温孵育1 h,滴加ECL试剂液覆盖,曝光显色,采用Image J软件分析各目的蛋白条带灰度值,以目的蛋白与内参蛋白条带灰度值之比作为蛋白相对表达量。实验重复3次。
1.8 统计学方法
采用Gradpad Prism软件(8.0版本)进行数据处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖活力
C C K-8 法检测结果显示,对照组、低氧组、HMGB1 Ab组、HMGB1 Ab+MSU组细胞增殖活力分别为(0.53±0.06)、(0.89±0.09)、(0.55±0.06)、(0.87±0.09)。四组细胞增殖活力比较,差异有统计学意义(F=32.514,P<0.001);其中低氧组细胞增殖活力高于对照组,差异有统计学意义(P<0.05);HMGB1 Ab组细胞增殖活力低于低氧组,差异有统计学意义(P<0.05);HMGB1 Ab+MSU组细胞增殖活力高于HMGB1 Ab组,差异有统计学意义(P<0.05)。
2.2 细胞迁移能力
细胞划痕实验检测结果显示,对照组、低氧组、HMGB1 Ab组、HMGB1 Ab+MSU组划痕愈合率分别为(40.25±4.21)%、(77.56±7.94)%、(41.68±4.30)%、(76.67±7.82)%。四组划痕愈合率比较,差异有统计学意义(F=241.996,P<0.001);其中低氧组划痕愈合率高于对照组,差异有统计学意义(P<0.05);HMGB1 Ab组划痕愈合率低于低氧组,差异有统计学意义(P<0.05);HMGB1 Ab+MSU组划痕愈合率高于HMGB1 Ab组,差异有统计学意义(P<0.05)。
2.3 PASMC中α-SMA表达情况
免疫荧光染色结果显示,与对照组比较,低氧组细胞荧光染色强度明显增强,α-SMA表达增加;与低氧组比较,HMGB1 Ab组细胞荧光染色强度明显减弱,α-SMA表达减少;与HMGB1 Ab组比较,HMGB1 Ab+MSU组细胞荧光染色强度明显增强,α-SMA表达增加,见图1。
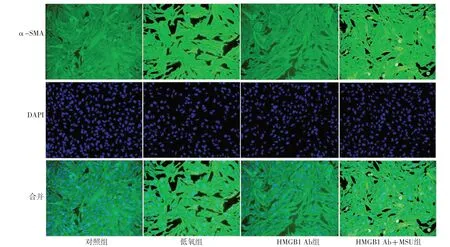
图1 各组PASMC中α-SMA表达情况(免疫荧光染色,×100)Figure 1 Expression of α-SMA in PASMC in each group
2.4 PASMC中HMGB1及细胞焦亡相关因子的mRNA相对表达量
qRT-PCR检测结果显示,四组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA相对表达量比较,差异有统计学意义(P<0.05);其中低氧组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA相对表达量高于对照组,差异有统计学意义(P<0.05);HMGB1 Ab组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA相对表达量低于低氧组,差异有统计学意义(P<0.05);HMGB1 Ab+MSU组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA相对表达量高于HMGB1 Ab组,差异有统计学意义(P<0.05),见表2。
表2 四组PASMC中HMGB1及细胞焦亡相关因子的mRNA相对表达量比较(±s,n=3)Table 2 Comparison of mRNA relative expression levels of HMGB1 and pyroptosis related factors in PASMC among the four groups
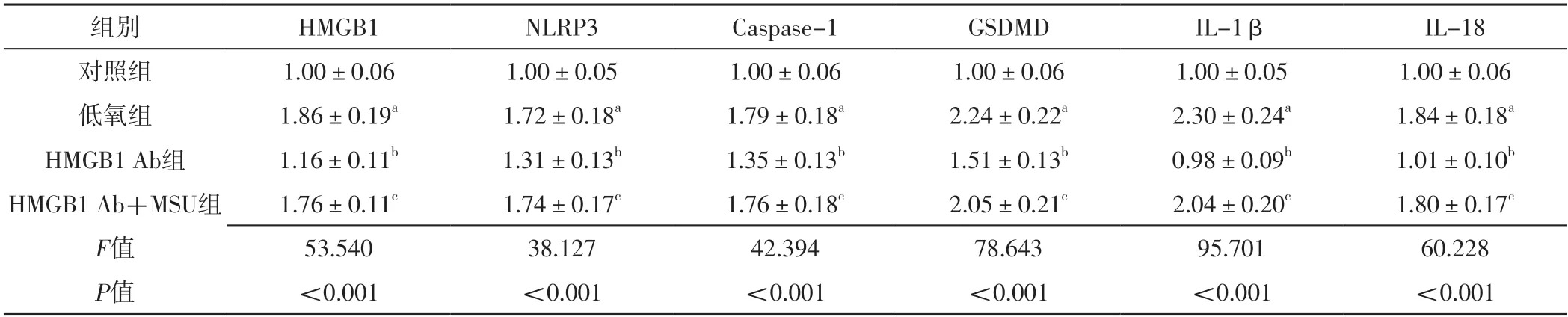
表2 四组PASMC中HMGB1及细胞焦亡相关因子的mRNA相对表达量比较(±s,n=3)Table 2 Comparison of mRNA relative expression levels of HMGB1 and pyroptosis related factors in PASMC among the four groups
注:HMGB1 Ab=高迁移率族蛋白1中和抗体,MSU=单钠尿酸盐;a表示与对照组比较,P<0.05;b表示与低氧组比较,P<0.05;c表示与HMGB1 Ab组比较,P<0.05。
组别HMGB1NLRP3Caspase-1GSDMDIL-1βIL-18对照组1.00±0.061.00±0.051.00±0.061.00±0.061.00±0.051.00±0.06低氧组HMGB1 Ab1.86±0.19a1.72±0.18a1.79±0.18a2.24±0.22a2.30±0.24a1.84±0.18a组1.16±0.11b1.31±0.13b1.35±0.13b1.51±0.13b0.98±0.09b1.01±0.10b HMGB1 Ab+MSU组1.76±0.11c1.74±0.17c1.76±0.18c2.05±0.21c2.04±0.20c1.80±0.17c F值53.54038.12742.39478.64395.70160.228 P值<0.001<0.001<0.001<0.001<0.001<0.001
2.5 PASMC中HMGB1及细胞焦亡相关因子相对表达量
W e s t e r n b l o t 检测结果显示,四组P A S M C中H M G B 1、N L R P 3、C a s p a s e-1、G S D M D、IL-1β、IL-18相对表达量比较,差异有统计学意义(P<0.05);其中低氧组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18相对表达量高于对照组,差异有统计学意义(P<0.05);HMGB1 Ab组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18相对表达量低于低氧组,差异有统计学意义(P<0.05);HMGB1 Ab+MSU组PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18相对表达量高于HMGB1 Ab组,差异有统计学意义(P<0.05),见表3、图2。
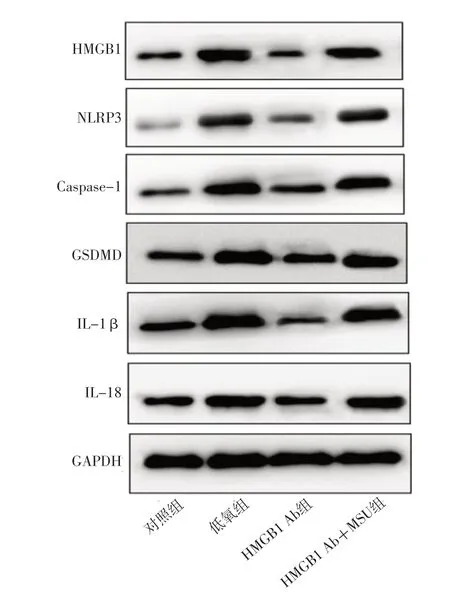
图2 Western blot法检测四组PASMC中HMGB1及细胞焦亡相关因子相对表达量的SDS-PAGE图Figure 2 Electrophoretic map of protein relative expression levels of HMGB1 and pyroptosis related factors in PASMC of four groups
表3 四组PASMC中HMGB1及细胞焦亡相关因子相对表达量比较(±s,n=3)Table 3 Comparison of protein relative expression levels of HMGB1 and pyroptosis related factors in PASMC among the four groups
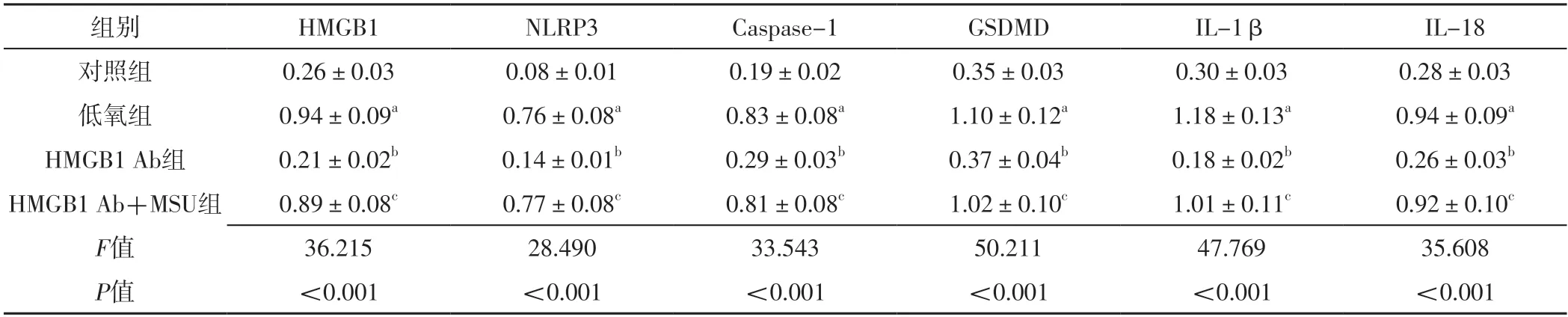
表3 四组PASMC中HMGB1及细胞焦亡相关因子相对表达量比较(±s,n=3)Table 3 Comparison of protein relative expression levels of HMGB1 and pyroptosis related factors in PASMC among the four groups
注:a表示与对照组比较,P<0.05;b表示与低氧组比较,P<0.05;c表示与HMGB1 Ab组比较,P<0.05。
组别HMGB1NLRP3Caspase-1GSDMDIL-1βIL-18对照组低氧组0.26±0.030.08±0.010.19±0.020.35±0.030.30±0.030.28±0.03 0.94±0.09a0.76±0.08a0.83±0.08a1.10±0.12a1.18±0.13a0.94±0.09a HMGB1 Ab组0.21±0.02b0.14±0.01b0.29±0.03b0.37±0.04b0.18±0.02b0.26±0.03b HMGB1 Ab+MSU组0.89±0.08c0.77±0.08c0.81±0.08c1.02±0.10c1.01±0.11c0.92±0.10c F值36.21528.49033.54350.21147.76935.608 P值<0.001<0.001<0.001<0.001<0.001<0.001
3 讨论
PAH作为一种慢性破坏性心肺疾病,对人类健康造成严重威胁,遗传因素和环境因素均是PAH发生发展的主要因素,长期暴露于高海拔或继发性肺部疾病状态可造成肺泡缺氧,导致肺动脉压逐渐升高,造成心肺结构与功能被破坏[7-8]。PASMC具有收缩和舒张功能,可调节血压和血流量,维持血液循环。正常状态下,PASMC处于稳定的终末分化阶段,表现为收缩型;而缺氧引起血管收缩异常,导致肺血管阻力可逆性增加,使PASMC由收缩型向合成型转化,并获得异常的增殖和迁移能力,引起肺血管重塑[9]。α-SMA是PASMC由收缩型向合成型转化的标志物[10]。为了探索PAH发展的机制及有效治疗方案,通常采用低氧诱导PASMC来模拟体外PAH模型。本研究结果显示,低氧状态下PASMC增殖、迁移能力异常增高,α-SMA表达也明显增加。
HMGB1是一种普遍存在的DNA结合蛋白,在各种病理生理过程中起着重要作用。HMGB1可以从坏死或受损细胞中被动释放,在低氧条件下也可以由免疫细胞或组织主动分泌。当HMGB1进入细胞外空间时,能够与受体结合,并作为损伤相关分子发挥作用;此外,HMGB1还通过作用于模式识别受体来传导细胞信号,诱导促炎细胞因子的释放,并加速炎症反应[11-13]。目前,大量研究表明,HMGB1在PAH的发病过程中发挥重要作用,其可能是PAH的潜在治疗靶点[14-15]。ZABINI等[16]在特发性PAH和PAH患者血清中均检测到HMGB1水平升高,并发现HMGB1通过激活c-Jun氨基末端激酶而促进PASMC和原代人动脉内皮细胞(primary arterial endothelial cell,PAEC)的增殖,从而诱导血管重塑;ZHANG等[17]研究表明,HMGB1通过上调内质网应激相关蛋白表达而促进PASMC的增殖和迁移,并发现利用甘草酸干扰HMGB1表达或4-苯基丁酸抑制内质网应激均能够减缓PAH的进展;LI等[18]研究指出,HMGB1介导的晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)表达的增加促进了炎症反应,导致严重的肺功能障碍,加重了缺氧性PAH的症状。本研究结果显示,加入HMGB1 Ab处理后,PASMC增殖、迁移能力降低,α-SMA表达也明显减少,表明HMGB1 Ab能够抑制低氧诱导的PASMC异常增殖与迁移。
细胞焦亡是不同于凋亡和坏死的细胞死亡形式,NLRP3炎症小体是介导细胞焦亡的关键因子,其与ASC相互作用,募集Caspase-1前体并促进Caspase-1成熟体的产生,一方面,激活的Caspase-1剪切GSDMD后形成GSDMD-N端片段,该片段与脂质结合后会破坏细胞膜,并释放大量促炎因子;另一方面,激活的Caspase-1促进促炎细胞因子IL-1β和IL-18的成熟与释放,从而招募炎性细胞聚集,加重炎症反应[19-21]。近年来,关于细胞焦亡参与PAH的研究报道越来越多,在低氧状态下PASMC焦亡水平明显增加,而敲低PASMC中的程序性死亡配体1(programmed death-ligand 1,PD-1)可抑制细胞焦亡,并减轻肺血管纤维化[22];低氧可诱导胶质瘤相关癌基因家族锌指1(gliomaassociated oncogene family zinc finger 1,GLI1)异常表达,而抑制GLI1可减弱PASMC焦亡,起到抑制PAH进展的作用[23];敲低驱动蛋白家族成员23(kinesin family member 23,KIF23)可抑制PASMC焦亡和增殖,进而抑制PAH中肺动脉压升高、右心室肥厚和降低肺血管阻力[24]。本研究结果显示,HMGB1 Ab可以抑制PASMC中HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA及其蛋白相对表达量,推测HMGB1 Ab抑制低氧诱导的PASMC异常增殖与迁移的作用可能与调控细胞焦亡有关。为了进一步验证这一推测,采用NLRP3炎症小体激动剂——MSU处理PASMC,结果显示,PASMC增殖、迁移能力又明显升高,α-SMA表达明显增加,同时HMGB1、NLRP3、Caspase-1、GSDMD、IL-1β、IL-18 mRNA及其蛋白相对表达量升高,提示HMGB1 Ab通过抑制细胞焦亡来抑制低氧诱导的PASMC异常增殖与迁移。
4 结论
综上所述,HMGB1与低氧状态下PASMC增殖、迁移相关,HMGB1 Ab能够抑制低氧诱导的PASMC异常增殖与迁移,该作用与其抑制细胞焦亡有关,这可为PAH的治疗提供新思路。但本研究仅从细胞水平上证实了HMGB1对低氧状态下PASMC的影响,而HMGB1参与PAH发生发展的具体机制仍未完全阐明,HMGB1 Ab能否在体内通过抑制PASMC异常增殖和迁移来改善肺血管重塑仍有待进一步探讨。
作者贡献:李鸣远、武云进行文章的构思与设计;李鸣远、李倩进行研究的实施与可行性分析,资料收集、整理;李鸣远进行论文撰写,统计学处理;武云进行论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
