卡瑞利珠单抗联合重组人血管内皮抑制素及榄香烯治疗晚期非小细胞肺癌的有效性及安全性
2024-03-04薛倩何强陈虹吴红海许佳睿侯春立
薛倩,何强,陈虹,吴红海,许佳睿,侯春立
作者单位:1.050000 河北省石家庄市,中国人民解放军联勤保障部队第九八〇医院临床药学科 2.050000 河北省石家庄市,中国人民解放军联勤保障部队第九八〇医院肿瘤科
非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌的80%~85%,在肺癌中最为常见,其发病率、病死率极高,患者5年生存率不到15%[1]。因此,探索肺癌新的治疗方法、延长患者生存期、降低患者死亡率是临床亟待解决的问题。肺癌早期最常用的治疗方式为手术切除肿瘤病灶,但肺癌早期临床表现多具有隐蔽性,大多数患者仅表现为咳嗽、咳痰等上呼吸道感染症状,很多患者未给予足够重视,确诊时已发展至中晚期[2-3]。晚期NSCLC主要采用药物治疗,其中抗血管生成药主要抑制肿瘤血管生成,干扰肿瘤营养供应,抑制肿瘤生长,降低转移率。榄香烯的主要活性成分是中药提取物,其是一种具有抗肿瘤作用的中成药,目前临床认为其具有一定的活血化瘀、抗肿瘤、提高机体免疫功能、增强机体抗肿瘤能力的作用[4]。研究显示,过多使用传统化疗药物不仅不能延长患者生存时间,还可能产生蓄积毒性,从而威胁患者生命健康[5]。目前,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)逐渐受到人们关注,而卡瑞利珠单抗是ICIs的一种,其可激发机体免疫反应,从而达到抗肿瘤目的[6-7]。本研究旨在探究卡瑞利珠单抗联合重组人血管内皮抑制素及榄香烯治疗晚期NSCLC的有效性及安全性,现报道如下。
1 对象与方法
1.1 研究对象
选取2019年7月—2020年7月中国人民解放军联勤保障部队第九八〇医院收治的首次就诊的100例晚期NSCLC患者为研究对象。纳入标准:(1)符合《中华医学会肺癌临床诊疗指南(2018版)》[8]中NSCLC的诊断标准;(2)TNM分期为ⅢB~Ⅳ期;(3)预计生存期超过3个月;(4)符合化疗指征并满足化疗的基本要求。排除标准:(1)存在心、肝、肾等重要脏器功能障碍者;(2)存在严重高血压或出血性疾病者;(3)存在凝血功能障碍和出血体质者;(4)存在其他恶性肿瘤和精神疾病者;(5)妊娠期或哺乳期妇女;(6)有肿瘤治疗史者;(7)存在自身免疫性疾病者;(8)对本研究所用药物过敏者;(9)肺鳞癌出现咯血及病灶包绕大血管者。采用随机数字表法将患者分为联合治疗组与常规治疗组,各50例。两组性别、年龄、病程、有吸烟史者占比、有饮酒史者占比、淋巴结转移者占比、肿瘤远处转移者占比、TNM分期、病理类型比较,差异无统计学意义(P>0.05),见表1。本研究经中国人民解放军联勤保障部队第九八〇医院伦理委员会批准(伦理号:2021-KY-45),患者及其家属对本研究知情且同意参加本研究。

表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 治疗方法
患者入院后均行常规对症支持治疗,采用盐酸昂丹司琼(福安药业集团宁波天衡制药有限公司生产,国药准字H10960146)和地塞米松(广东罗浮山国药股份有限公司生产,国药准字H44024841)预防化疗期间出现恶心呕吐和过敏等症状;其中盐酸昂丹司琼静脉滴注,8 mg/次,2次/d;地塞米松静脉滴注,5 mg/次,1次/d。后采用一线化疗方案治疗:盐酸吉西他滨(浙江海正药业股份有限公司生产,国药准字H20093417)1 000 mg/m2静脉滴注d1、d8;顺铂(齐鲁制药有限公司生产,国药准字H20023461)75 mg/m2静脉滴注d1,21 d为1个周期,持续治疗3个周期。
常规治疗组:在化疗基础上采用重组人血管内皮抑制素(山东先声麦得津生物制药有限公司生产,国药准字S20050088)联合榄香烯注射液〔石药集团远大(大连)制药有限公司生产,国药准字H20110114〕治疗,15 mg重组人血管内皮抑制素加入500 ml 0.9%氯化钠溶液稀释,缓慢静脉滴注3~4 h,d1~d14;400 mg榄香烯注射液加入500 ml 10%葡萄糖溶液稀释,静脉滴注,并进行心电监护,注意患者血压、心率及呼吸变化。21 d为1个周期,持续治疗3个周期。
联合治疗组:在常规治疗组方案基础上给予卡瑞利珠单抗(苏州盛迪亚生物医药有限公司生产,国药准字S20190027)200 mg/次,静脉滴注30~60 min,1次/3周。21 d为1个周期,持续治疗3个周期。
1.3 观察指标
1.3.1 临床疗效
治疗后参照美国国立癌症研究所制定的实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1评价患者的临床疗效[9]。临床疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stabilization disease,SD)和疾病进展(progress disease,PD)。CR表示所有病灶完全消失,肿瘤标志物水平下降至参考范围;PR表示患者临床症状完全改善,病灶直径减少一半;SD表示患者临床症状有所改善,病灶直径增大<25%或缩小<50%;PD表示患者临床症状没有好转甚至加重,有新的病灶出现。客观有效率(objective response rate,ORR)=CR率+PR率;疾病控制率(disease control rate,DCR)=1-PD率。
1.3.2 肿瘤标志物
治疗前后抽取患者空腹静脉血5 ml,3 500 r/min离心10 min(离心半径10 cm),取上清液并置于-80 ℃冰箱中保存备用,采用电化学发光法测定糖类抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)。
1.3.3 毒副作用发生情况
治疗期间观察患者毒副作用(神经系统损伤、甲状腺功能减退、胃肠道反应、蛋白尿等)发生情况,参照美国国立癌症研究所发布的通用毒性评价标准4.0版,将毒副作用分为0~Ⅳ级,分级越高表示毒副作用越严重[10]。
1.4 随访
自患者入组之日起开始随访,随访方式为门诊或电话随访,患者均随访36个月,随访截至2023-07-31。记录患者的生存状态,包括生存、复发或死亡。统计患者的总生存时间(overall survival,OS)和无进展生存时间(progression-free survival,PFS)。OS为患者入组至死亡或末次随访的时间,PFS为患者入组至疾病进展或死亡的时间。
1.5 统计学方法
采用SPSS 22.0统计学软件处理数据。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验,同组治疗前后比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,并采用Log-rank检验进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
治疗后,联合治疗组ORR和DCR高于常规治疗组,差异有统计学意义(χ2=3.934,P=0.047;χ2=10.746,P=0.001),见表2。
2.2 肿瘤标志物
治疗前两组CA125、CEA及CYFRA21-1比较,差异无统计学意义(P>0.05);治疗后两组CA125、CEA及CYFRA21-1分别低于本组治疗前,且联合治疗组CA125、CEA及CYFRA21-1低于常规治疗组,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后CA125、CEA及CYFRA21-1比较(±s)Table 3 Comparison of CA125,CEA and CYFRA21-1 between the two groups before and after treatment
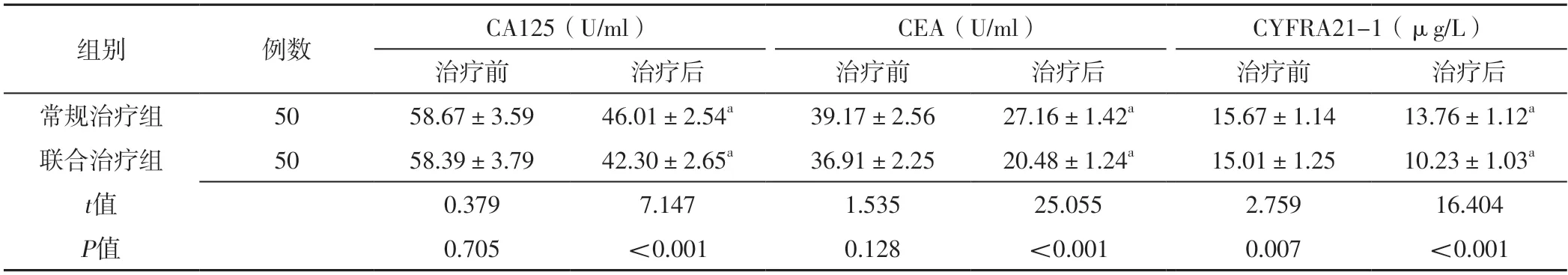
表3 两组治疗前后CA125、CEA及CYFRA21-1比较(±s)Table 3 Comparison of CA125,CEA and CYFRA21-1 between the two groups before and after treatment
注:CA125=糖类抗原125,CEA=癌胚抗原,CYFRA21-1=细胞角蛋白19片段抗原21-1;a表示与本组治疗前比较,P<0.05。
组别例数CA125(U/ml)CEA(U/ml)CYFRA21-1(μg/L)治疗前治疗后治疗前治疗后治疗前治疗后常规治疗组5058.67±3.59 46.01 42.30±2.54a39.17±2.5627.16±1.42a15.67±1.1413.76±1.12a联合治疗组5058.39±3.79±2.65a36.91±2.2520.48±1.24a15.01±1.2510.23±1.03a t值0.3797.1471.53525.0552.75916.404 P值0.705<0.0010.128<0.0010.007<0.001
2.3 毒副作用
治疗期间,联合治疗组和常规治疗组Ⅰ~Ⅱ级、Ⅲ~Ⅳ级神经系统损伤、甲状腺功能减退、胃肠道反应、蛋白尿发生率比较,差异无统计学意义(P>0.05),见表4。
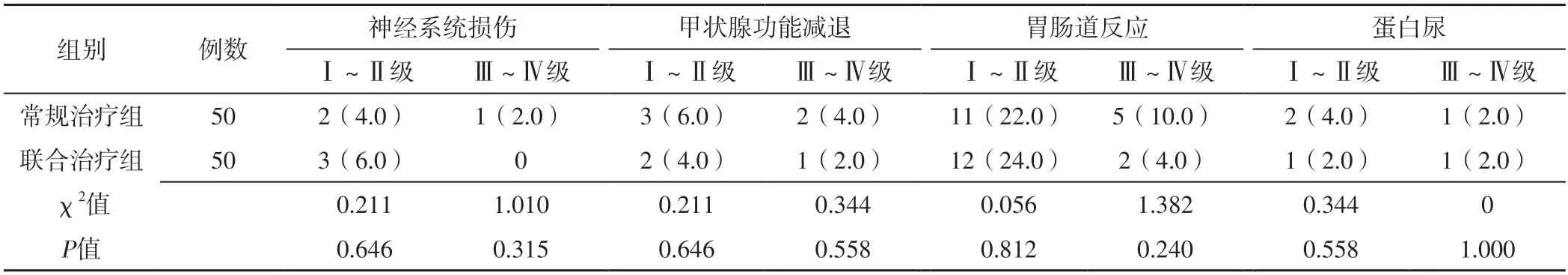
表4 两组毒副作用发生率比较〔n(%)〕Table 4 Comparison of incidence of side effects between the two groups
2.4 OS和PFS
随访期间常规治疗组失访6例,联合治疗组失访4例。常规治疗组患者中位OS为9.0个月,生存率为27.3%;联合治疗组患者中位OS为27.5个月,生存率为45.7%。联合治疗组生存率高于常规治疗组,差异有统计学意义(χ2=7.573,P=0.006),见图1。常规治疗组患者中位PFS为7.0个月,无进展生存率为13.6%;联合治疗组患者中位PFS为24.5个月,无进展生存率为28.3%。联合治疗组无进展生存率高于常规治疗组,差异有统计学意义(χ2=7.596,P=0.006),见图2。
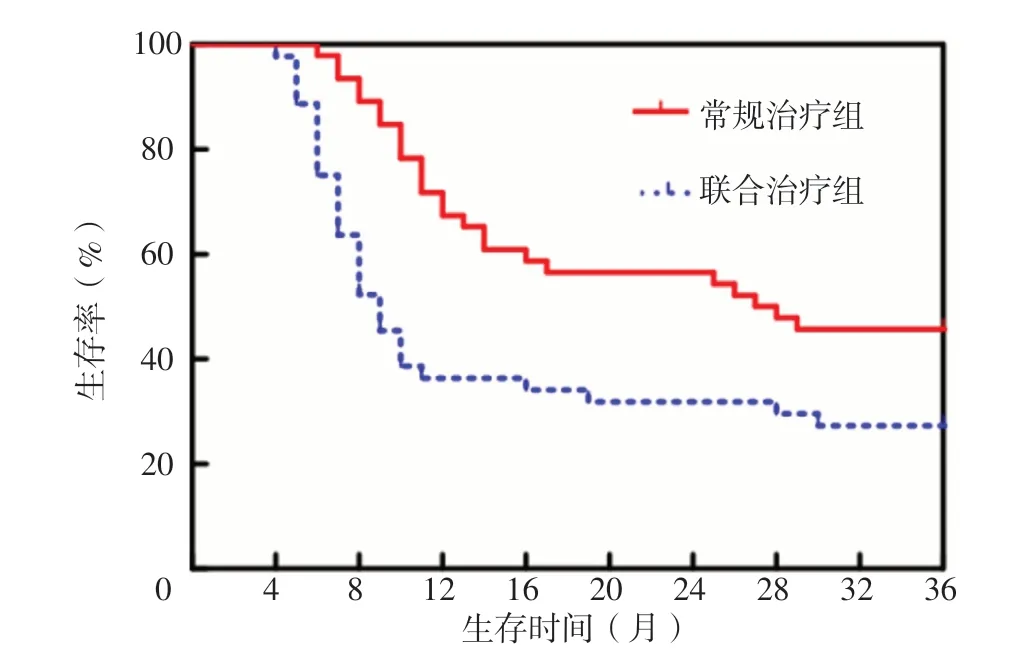
图1 联合治疗组和常规治疗组生存曲线Figure 1 Survival curve of combined treatment group and conventional treatment group
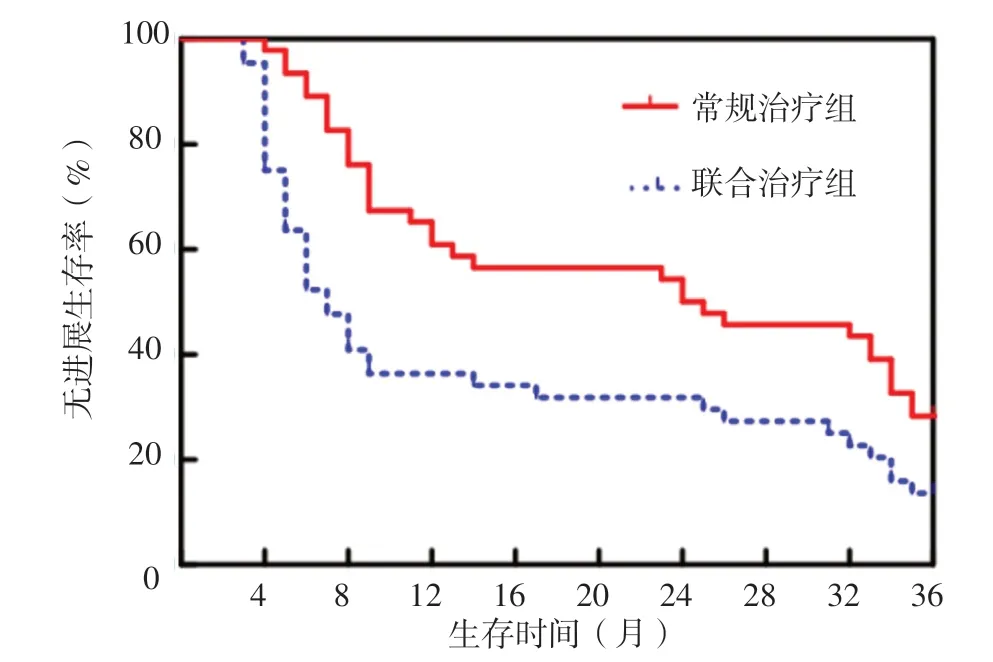
图2 联合治疗组和常规治疗组无进展生存曲线Figure 2 Progression-free survival curve of combined treatment group and conventional treatment group
3 讨论
NSCLC为临床最常见的一类肺癌,晚期NSCLC患者首选靶向治疗,但存在耐药性等不足[11]。现阶段,免疫治疗成为研究的热点,特别是ICIs的应用取得了令人鼓舞的成果[12]。ICIs可通过重新激活机体免疫细胞来杀伤肿瘤,并利用免疫记忆取得持久抗肿瘤效果,从而有效延长患者OS[13]。以程序性死亡蛋白1(programmed death protein 1,PD-1)/程序性死亡蛋白配体1(programmed death protein ligand 1,PD-L1)为靶点的ICIs已在多种肿瘤治疗中得到有效应用[14],但获益人群仍有限,后续需将重点放在扩大受益人群方面。卡瑞利珠单抗在NSCLC患者中的治疗已取得一定成果,其可通过与PD-1靶向结合而阻断PD-L1及程序性死亡配体2之间的相互作用,进而促使免疫功能恢复,达到抗肿瘤的目的[15]。目前,联合应用不同作用机制的药物逐渐成为治疗晚期肺癌的新思路。抗血管生成药可改善机体免疫抑制状态,其与ICIs均能优化肿瘤微环境,相关研究结果显示,二者联合可发挥协同作用,提升抗肿瘤效果[16]。重组人血管内皮抑制素相较于天然血管内皮抑制素t1/2较长,生物活性、稳定性较高[17]。榄香烯注射液可作用于细胞S期,能有效抑制肿瘤细胞有丝分裂、肿瘤血管生成和细胞增殖,诱发细胞凋亡,减少恶性肿瘤细胞扩散[18]。
本研究结果显示,治疗后联合治疗组患者ORR和DCR均高于常规治疗组,CA125、CEA、CYFRA21-1均低于常规治疗组,生存率和无进展生存率均高于常规治疗组。提示卡瑞利珠单抗、重组人血管内皮抑制素及榄香烯具有协同作用,三者联合可控制肿瘤进展,有效提高晚期NSCLC患者的临床疗效和生存状况。这可能是由于榄香烯注射液具有抑制肿瘤增殖和扩散的作用;卡瑞利珠单抗可通过促进机体免疫应答恢复正常而阻止癌细胞免疫逃逸,改变免疫监视功能失常状态,重新激活T淋巴细胞来杀伤肿瘤,并利用免疫记忆取得持久抗肿瘤效果;而重组人血管内皮抑制素也能有效抑制血管生成,重塑肿瘤免疫微环境,并通过促进免疫效应细胞转运到肿瘤部位而抑制肿瘤生长,从而提高疗效。既往研究表明,卡瑞利珠单抗联合化疗治疗NSCLC的效果良好,安全性也较高[19]。本研究结果还显示,治疗期间联合治疗组与常规治疗组Ⅰ~Ⅱ级、Ⅲ~Ⅳ级神经系统损伤、甲状腺功能减退、胃肠道反应、蛋白尿发生率比较无统计学差异。说明卡瑞利珠单抗联合抗血管生成药及榄香烯治疗不会增加晚期NSCLC患者的毒副作用发生情况。
4 结论
综上所述,卡瑞利珠单抗联合重组人血管内皮抑制素及榄香烯能有效提高晚期NSCLC患者的近期临床疗效,降低肿瘤标志物水平,提高生存率及无进展生存率,同时未增加患者毒副作用发生情况。但本研究为单中心研究,且纳入病例数较少,后期将联合多中心、扩大样本量、延长随访时间,进一步验证本研究结论。
作者贡献:薛倩进行文章的构思与设计,研究的实施与可行性分析,论文撰写及修订;何强、陈虹进行资料收集;吴红海、许佳睿进行资料整理;吴红海进行统计学处理;侯春立负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
