参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗晚期非小细胞肺癌的临床疗效
2024-03-04刘晶晶易良杰
刘晶晶,易良杰
作者单位:516000 广东省惠州市,广州中医药大学惠州医院肿瘤科
肺癌是全球发病率排名第二、死亡率排名第一的恶性肿瘤[1],非小细胞肺癌(non-small cell lung cancer,NSCLC)是常见的肺癌类型,约占肺癌患者的85%[2],由于其高侵袭性和缺乏有效的早期筛查标志物,70%的NSCLC患者确诊时已处于晚期[3]。卡瑞利珠单抗作为一种程序性死亡受体1(programmed cell death 1,PD-1)抑制剂,其联合化疗能有效改善中晚期NSCLC患者免疫功能,降低其血清肿瘤标志物水平,且近期治疗效果确切[4]。中医学对肿瘤有独特的认识和治疗优势,中医学认为,肿瘤为正气虚弱、邪毒趁虚而入所致,治疗应强调扶正祛邪[5]。参芪扶正注射液是一种纯中药注射制剂,其主要成分为党参和黄芪,具有健脾益气功效。现代药理学研究表明,参芪扶正注射液可抑制肿瘤细胞增殖、侵袭和转移,并可增强机体免疫功能,减轻化疗相关血细胞减少、胃肠道反应等毒副作用,在肿瘤辅助治疗中具有重要作用[6],但其较少用于PD-1抑制剂联合化疗一线治疗晚期NSCLC的辅助治疗。鉴于此,本研究旨在观察参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗晚期NSCLC的临床疗效,现报道如下。
1 对象与方法
1.1 研究对象
选取2021年4月—2023年4月广州中医药大学惠州医院收治的96例晚期NSCLC患者为研究对象,均经组织病理学明确诊断。纳入标准:(1)TNM分期为ⅢB~Ⅳ期;(2)近6个月内未接受抗肿瘤治疗;(3)至少有一处可评价临床疗效的病灶;(4)东部肿瘤协作组(Eastern Cancer Cooperation Group,ECOG)评分0~2分;(5)未伴有表皮生长因子受体基因突变或间变性淋巴瘤激酶基因融合者。排除标准:(1)其他类型肺癌者;(2)原发脑肿瘤或中枢神经转移瘤者;(3)严重感染、无法控制的高血压和糖尿病及严重心脏病者;(4)妊娠期或哺乳期妇女。采用随机数字表法将患者分为对照组和观察组,每组48例。两组患者年龄、性别、病理类型、TNM分期、胸腔积液发生率、肝转移发生率及ECOG评分比较,差异无统计学意义(P>0.05),见表1。本研究获得广州中医药大学惠州医院伦理委员会批准,所有患者及家属对本研究知情并签署知情同意书。
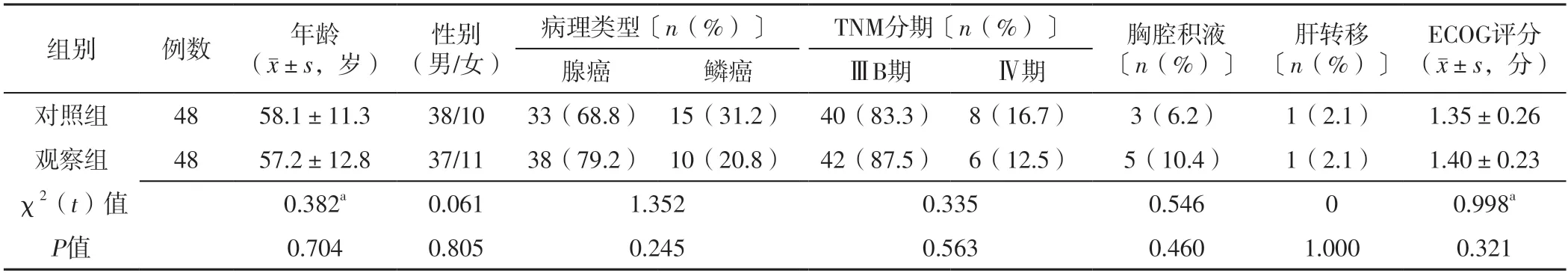
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2 治疗方法
1.2.1 对照组
对照组患者采用卡瑞利珠单抗联合化疗一线治疗,具体如下:注射用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司生产,国药准字S20190027)200 mg静脉滴注,每3周1次,21 d为1个周期,连续治疗4个周期。化疗一线方案:第1天给予注射用培美曲塞二钠(齐鲁制药有限公司生产,国药准字H20060672)500 mg/m2静脉滴注,第1、2天均给予卡铂注射液(江苏豪森药业集团有限公司生产,国药准字H20010743)75 mg/m2静脉滴注。
1.2.2 观察组
观察组患者在对照组基础上接受参芪扶正注射液辅助治疗,具体如下:参芪扶正注射液(丽珠集团利民制药厂生产,国药准字Z19990065)250 ml静脉滴注,1次/d,化疗前3 d开始使用,与化疗一线方案同步结束。
1.3 观察指标
1.3.1 主要观察指标
(1)临床疗效:治疗后参考《实体肿瘤疗效评价标准1.1版》[7]评价两组患者临床疗效,完全缓解:全部癌灶直径缩小至10 mm以内;部分缓解:全部癌灶直径缩小>30%;疾病稳定:介于完全缓解和部分缓解之间;疾病进展:全部癌灶直径增大>20%或出现一个或以上新发病灶。疾病控制率=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数,客观缓解率=(完全缓解例数+部分缓解例数)/总例数。(2)Ⅲ~Ⅳ级毒副作用:参考《抗癌药急性及亚急性毒性反应分度标准(WHO标准)》评价两组患者Ⅲ~Ⅳ级毒副作用发生情况[8],毒副作用主要包括贫血、恶心、呕吐、反应性皮肤毛细血管增生症(reactive cutaneous capillary endothelial proliferation,RCCEP)、脱发等。
1.3.2 次要观察指标
(1)T淋巴细胞亚群:治疗前后分别采集两组患者静脉血2 ml并置于肝素抗凝试管中混匀,加入CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5(美国BD公司生产)10 μl,避光室温静置30 min,加入氯化铵2 ml溶血15 min,采用DxFlEX流式细胞仪(美国贝克曼库尔特公司生产)检测CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞百分比。(2)血清细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)、趋化因子CXCL12水平:治疗前后分别采集两组患者静脉血3 ml并注入干燥试管中,室温静置,待血液凝固后取上层液并离心(3 000 r/min,离心半径10 cm,离心时间5 min),留取上清液,采用酶联免疫吸附试验检测血清CYFRA21-1、趋化因子CXCL12水平,其中CYFRA21-1试剂盒购自武汉吉立德生物科技有限公司、趋化因子CXCL12试剂盒购自上海臻科生物科技有限公司,所用仪器为SPECTROstar Nano酶标仪(德国BMG LABTECH公司生产)。(3)生活质量:治疗前后分别采用中文版肺癌患者生活质量测定量表(Functional Assessment of Cancer Therapy-Lung Cancer,FACT-L)[9]评估两组患者生活质量,该量表包括生理、社会/家庭、与医生关系、情感、功能、附加关注6个维度共44个条目,总分144分,得分越高提示患者生活质量越差。
1.4 统计学方法
采用SPSS 25.0软件进行数据处理。符合正态分布的计量资料以(±s)表示,两组间比较采用成组t检验,组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。双侧检验水准α=0.05。
2 结果
2.1 临床疗效
观察组患者疾病控制率为81.2%(39/48)、客观缓解率为62.5%(30/48),分别高于对照组的41.7%(20/48)、31.2%(15/48),差异有统计学意义(χ2值分别为15.875、9.412,P值分别为<0.001、0.002),见表2。
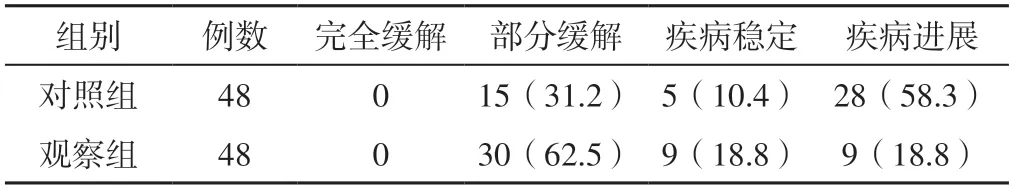
表2 两组患者临床疗效〔n(%)〕Table 2 Clinical efficacy of the two groups
2.2 Ⅲ~Ⅳ级毒副作用
观察组患者Ⅲ~Ⅳ级毒副作用发生率为2 5.0%(12/48),低于对照组的45.8%(22/48),差异有统计学意义(χ2=4.554,P=0.033),见表3。

表3 两组患者Ⅲ~Ⅳ级毒副作用发生情况〔n(%)〕Table 3 Incidence of toxic and side effects of grade Ⅲ-Ⅳ of the two groups
2.3 T淋巴细胞亚群
治疗前,两组患者CD3+T淋巴细胞、CD4+T淋巴细胞、C D8+T 淋巴细胞百分比比较,差异无统计学意义(P>0.05);治疗后,两组患者CD8+T淋巴细胞百分比比较,差异无统计学意义(P>0.05);治疗后,两组患者CD3+T淋巴细胞、CD4+T淋巴细胞百分比分别高于本组治疗前,且观察组患者高于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后T淋巴细胞亚群比较(±s,%)Table 4 Comparison of T lymphocyte subsets between the two groups before and after treatment

表4 两组患者治疗前后T淋巴细胞亚群比较(±s,%)Table 4 Comparison of T lymphocyte subsets between the two groups before and after treatment
注:a表示与本组治疗前比较,P<0.05。
CD3组别 例数+ T淋巴细胞百分比 CD4+ T淋巴细胞百分比 CD8+ T淋巴细胞百分比治疗前治疗后 治疗前治疗后治疗前治疗后对照组 48 59.3±6.8 63.2±10.1a 25.1±3.6 28.2±4.5a 26.3±3.9 27.2±4.5观察组 48 59.4±7.0 65.9±12.5a 25.4±3.9 30.1±5.1a 26.8±3.3 27.2±4.5 t值0.0712.0830.3922.1150.6780.223 P值0.9440.0400.6960.0370.4990.824
2.4 血清CYFRA21-1、趋化因子CXCL12水平及中文版FACT-L评分
治疗前,两组患者血清CYFRA21-1、趋化因子CXCL12水平及中文版F A C T-L 评分比较,差异无统计学意义(P>0.05);治疗后,两组患者血清CYFRA21-1、趋化因子CXCL12水平及中文版FACT-L评分分别低于本组治疗前,且观察组患者低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后血清CYFRA21-1、趋化因子CXCL12水平及中文版FACT-L评分比较(±s)Table 5 Comparison of serum CYFRA21-1,chemokine CXCL12 levels and Chinese version FACT-L scores between the two groups before and after treatment

表5 两组患者治疗前后血清CYFRA21-1、趋化因子CXCL12水平及中文版FACT-L评分比较(±s)Table 5 Comparison of serum CYFRA21-1,chemokine CXCL12 levels and Chinese version FACT-L scores between the two groups before and after treatment
注:CYFRA21-1=细胞角质蛋白19片段抗原21-1,FACT-L=肺癌患者生活质量测定量表;a表示与本组治疗前比较,P<0.05。
中文版FACT-L评分(分)治疗前治疗后治疗前治疗后治疗前治疗后对照组 48 20.4±5.2 12.0±2.8a 10.4±2.6 5.1±1.8a 76.2±10.6 50.2±6.4a观察组 48 20.7±5.0 9.4±2.2a10.6±2.2 3.0±1.0a 75.9±11.2 45.1±4.4a t值0.2885.0590.4077.0660.1264.558 P值0.774<0.0010.685<0.0010.900<0.001组别 例数CYFRA21-1(μg/L)趋化因子CXCL12(mg/L)
3 讨论
PD-1抑制剂可直接或间接地促使T淋巴细胞活化、增殖,增强机体抗肿瘤、抑制肿瘤进展能力,研究表明,与单独化疗相比,PD-1抑制剂一线或二线单独治疗及联合化疗均可提高晚期NSCLC患者的生存率[10]。卡瑞利珠单抗是一种PD-1抑制剂,于2019年5月在我国首次获批用于治疗复发或难治性经典霍奇金淋巴瘤,之后其在各种癌症治疗中得到广泛应用,其联合卡铂和培美曲塞或卡铂和紫杉醇已先后被批准作为晚期NSCLC治疗的新标准[11]。尽管PD-1抑制剂联合化疗治疗晚期NSCLC的效果良好,但部分患者治疗反应性低下,此外药物相关毒性作用也影响其治疗效果和治疗进程[12]。
中医学认为,NSCLC属于“肺积”“咳嗽”“息贲”“喘息”“痰饮”“胸痛”“劳咳”等范畴,《杂病源注犀烛·积聚癥瘕痃癖痞源流》中记载:“邪积胸中,阻塞气道,气不宣通,为痰为食为血,皆得与正相搏,邪既胜,正不得而制之,遂结成形而有块。”《医宗必读·积聚篇》亦云:“积之成也,正气不足,而后邪气踞之。”可见正虚是NSCLC的发病基础,正气不足,脏腑气血阴阳失衡,邪气乘虚而入,留滞阻于胸中,阻遏肺气,肺失宣降,津液输布不利,导致津聚为痰,痰瘀互结形成肿块,肿块久积酝毒,终成毒瘤。另外,正气虚还可导致机体免疫力降低、抗癌能力下降,加速癌细胞扩散。李爱杰等[13]研究结果显示,NSCLC患者外周血CD3+T淋巴细胞、CD4+T淋巴细胞、自然杀伤细胞水平均明显下降,且与患者预后不良有关。因此,扶持正气、去除邪气有助于调节NSCLC患者内环境,提高机体抗病能力,增强患者体质和免疫功能,进而增强患者抗肿瘤能力。
参芪扶正注射液是一种补气的中成药,其可治疗肺脾气虚导致的神疲乏力、少气懒言、自汗眩晕,临床主要用于癌症的辅助治疗。研究显示,参芪扶正注射液联合培美曲塞钠、顺铂可降低晚期肺癌患者肿瘤相关细胞因子表达水平,减轻其化疗毒副作用,进而延长其生存时间[14];参芪扶正注射液联合化疗可改善中晚期胃癌患者免疫功能[15]。本研究采用参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗晚期NSCLC患者,结果显示,观察组患者疾病控制率、客观缓解率分别高于对照组,Ⅲ~Ⅳ级毒副作用发生率低于对照组;治疗后,两组患者CD3+T淋巴细胞、CD4+T淋巴细胞百分比分别高于本组治疗前,且观察组患者高于对照组,提示参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗可提高晚期NSCLC患者的临床疗效,降低其毒副作用发生率,改善其免疫功能。分析原因为:参芪扶正注射液可抑制恶性肿瘤细胞增殖[16],促进半胱氨酸蛋白酶3、半胱氨酸蛋白酶9等肿瘤细胞凋亡基因表达,进而促进肿瘤细胞凋亡[17],下调血管内皮生长因子表达,抑制肿瘤转移[18],因此在晚期NSCLC治疗中增加参芪扶正注射液可增强免疫治疗以及化疗药物的抗肿瘤作用,其协同免疫和化疗药物可增强抗肿瘤作用、减轻毒副作用[19]。
CYFRA21-1是在肺组织中丰富表达的细胞角蛋白19的可溶性片段,在恶性上皮细胞中蛋白酶被激活可加速细胞降解,使大量细胞角蛋白片段释放入血,故血清CYFRA21-1水平被作为诊断肺癌[20]及预测肺癌患者免疫治疗反应性的标志物[21]。趋化因子CXCL12又称为基质细胞衍生因子1,其与受体趋化因子CXCR4结合可上调β-catenin和过氧化物酶体增殖激活受体表达水平,促使上皮-间质转化,增强肺癌细胞侵袭性[22];此外,其还可介导M2型巨噬细胞极化,促进NSCLC进展[23]。本研究结果显示,治疗后,两组患者血清CYFRA21-1、趋化因子CXCL12水平分别低于本组治疗前,且观察组低于对照组,提示参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗可降低晚期NSCLC患者肿瘤标志物水平。本研究结果还显示,治疗后,两组患者中文版FACT-L评分分别低于本组治疗前,且观察组患者低于对照组,提示参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗可提高晚期NSCLC患者生活质量,分析原因可能与患者临床疗效提高、毒副作用减少有关。
4 结论
综上所述,参芪扶正注射液辅助卡瑞利珠单抗联合化疗一线治疗可提高晚期NSCLC患者临床疗效,减少Ⅲ~Ⅳ级毒副作用,改善患者免疫功能和生活质量,降低患者肿瘤标志物水平。但本研究为单中心研究、样本量较小、观察时间较短,故所得结论仍有待多中心、大样本量研究进一步证实。
作者贡献:刘晶晶进行文章的构思与设计,研究的实施与可行性分析,数据收集、整理、分析,结果分析与解释,负责撰写、修订论文;易良杰负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。
