球毛壳菌小麦秸秆发酵产物抑制辣椒疫霉的稳定性及机制
2024-03-04廖宏娟谭佳思张志斌余璟蓉张馨月江玉梅朱笃
廖宏娟,谭佳思,张志斌,余璟蓉,张馨月,江玉梅,朱笃,2
球毛壳菌小麦秸秆发酵产物抑制辣椒疫霉的稳定性及机制
廖宏娟1,谭佳思1,张志斌1,余璟蓉1,张馨月1,江玉梅1,朱笃1,2
1江西师范大学生命科学学院/江西省亚热带植物资源保护与利用重点实验室,南昌 330022;2江西科技师范大学生命科学学院/江西省生物加工过程重点实验室,南昌 330013
【目的】由辣椒疫霉()侵染引起的疫病给辣椒等作物产业带来了巨大的经济损失。论文旨在明确球毛壳菌()代谢产物抑制辣椒疫霉的稳定性和抑菌机制,为研究与开发辣椒疫霉的微生物源抑菌剂提供参考。【方法】将球毛壳菌发酵粗提物分别在不同温度(40—121 ℃)、pH(1—13)、光照时间(0—12 d)和储存时间(0—60 d)条件下进行处理,采用菌丝生长抑制法测定经不同处理后粗提物对辣椒疫霉的抑制率,以探究粗提物抑制辣椒疫霉的热、酸碱、光和时间稳定性。利用光学显微镜观察粗提物对辣椒疫霉菌丝形态的影响,通过多种生理生化试验探究粗提物作用于辣椒疫霉12—72 h后,对辣椒疫霉细胞壁、细胞膜、活性氧代谢、蛋白质含量、还原糖含量和致病力的影响。【结果】在所设置的处理范围内,球毛壳菌发酵粗提物(1 mg·mL-1)经不同光照时间和储存时间处理后对辣椒疫霉的抑制率没有显著降低,抑制率维持在93%左右;粗提物在40—70 ℃的热处理范围内对辣椒疫霉的抑制率没有显著降低,70 ℃以上的热处理会显著降低粗提物对辣椒疫霉的抑制率,但抑制率不低于70%;粗提物在pH 1—5和9—13的酸碱处理范围内会显著降低对辣椒疫霉的抑制率,但抑制率也不低于70%。粗提物处理影响辣椒疫霉菌丝形态,使菌丝发生严重的扭曲皱缩现象,并影响活性氧代谢,使菌丝中的活性氧大量积累。辣椒疫霉经粗提物处理12—72 h后,其培养液中的碱性磷酸酶活性、-葡萄糖苷酶活性、核酸和蛋白质含量均显著升高,且其菌丝中的丙二醛和过氧化氢含量显著增加。辣椒疫霉菌丝中的过氧化氢酶活性、可溶性蛋白和还原糖含量则在粗提物处理12—72 h内显著降低,而超氧化物歧化酶、过氧化物酶、多聚半乳糖醛酸酶和-葡萄糖苷酶活性则仅在一定时间显著降低。【结论】在本试验所设置的处理范围内,球毛壳菌的小麦秸秆发酵粗提物抑制辣椒疫霉的效果不受光照及储存时间的影响,但超过70 ℃的热处理和pH 1—5和9—13的酸碱处理会显著降低粗提物对辣椒疫霉的抑制效果。此外,该粗提物通过改变菌丝形态,破坏细胞壁和细胞膜,引发细胞内物质泄漏,降低菌丝中蛋白质和还原糖含量,抑制抗氧化酶活性,干扰活性氧代谢使活性氧大量积累从而抑制辣椒疫霉。
球毛壳菌;辣椒疫霉;抑制率;抑制机制;抑制稳定性
0 引言
【研究意义】辣椒疫霉()是一种常见的土传蔬菜病菌,使辣椒和番茄等茄科、豆类和大多数瓜类作物患疫病,对蔬菜生产造成严重的经济损失[1-2]。目前主要使用化学农药防治作物疫病[3-5],但长期使用化学农药不仅使病菌产生抗药性,而且对环境和人类健康造成一定影响[6-7]。因此,迫切需要生产低毒、高活性、环保的天然产物杀菌剂来控制辣椒疫霉[8]。从微生物中提取的天然产物是抗辣椒疫霉化合物的良好来源,与化学杀菌剂相比,微生物源产物更加安全、环保[9]。球毛壳菌()是研究较多的生物防治真菌,其在培养基中或多种作物秸秆上发酵产生的具有抑制植物病原菌活性的次级代谢产物已被广泛报道[10]。此外,我国每年都会产生大量的小麦秸秆,但均未能被充分利用,绝大部分秸秆被丢弃或焚烧,造成严重的资源浪费和环境污染等问题。将球毛壳菌接种于小麦秸秆中发酵,不仅促进了小麦秸秆的资源化利用,而且在环保的同时还降低了发酵成本。因此,研究球毛壳菌的小麦秸秆发酵产物抑制辣椒疫霉的稳定性和抑菌机制,既有利于了解球毛壳菌在作物疫病防治中的潜在应用前景,也可为生产抑制辣椒疫霉的微生物源抑菌剂的研发提供参考,同时能增加对废弃小麦秸秆的利用。【前人研究进展】辣椒疫霉于1922年被首次报道,其能引发辣椒、豆角和南瓜等作物的疫病,从而严重影响作物的产量和品质[1,11-13]。目前,已发现多种微生物的代谢产物可不同程度地抑制辣椒疫霉,主要包括假单胞菌属()、毛壳菌属()、芽孢杆菌属()、木霉属()、致病杆菌属()、链霉菌属()、伯克霍尔德氏菌属()和曲霉属()[1]。球毛壳菌是毛壳菌属的模式种,其防治作物病害的研究最早可以追溯到1954年[10]。球毛壳菌产生的次级代谢产物种类繁多且结构新颖,其中的球毛壳菌素类(chaetoglobosins)和嗜氮酮类(azaphilones)物质对多种常见植物病原菌有良好的抑制效果[10,14-15]。球毛壳菌素属于细胞松弛素类物质,主要通过抑制植物病原菌的微丝合成,进而影响植物病原菌细胞骨架的构建,以达到抑菌目的[10]。Park等[16]和Yan等[17]从球毛壳菌发酵物中分离到的chaetoviridin A可显著抑制辣椒疫霉生长,该物质对辣椒疫霉的最小抑菌浓度(MIC)为33.3 µg·mL-1。Chaetoviridin A抑制大丽轮枝菌()的抑菌机制为增加菌丝中活性氧和氧化亚氮的产生[18]。Xiao等[19]发现球毛壳菌CDW7产生的黄柄曲霉素(flavipin)对辣椒疫霉有显著的抑制效果,半最大效应浓度(EC50)为2.76 µg·mL-1。Mondol等[20]在球毛壳菌M65的培养物中纯化出两种能显著抑制辣椒疫霉游动孢子运动的物质,分别为(3,5)-5-hydroxylasiodiplodin和dehydrovomifoliol,在100 µg·mL-1的浓度下,其对辣椒疫霉游动孢子运动的抑制率分别为100%和76%。除了球毛壳菌,其他微生物所产生的一些产物也对辣椒疫霉具有很好的抑制作用。伯氏致病杆菌()产生的马杜霉素Ⅱ(madumycin Ⅱ)对辣椒疫霉的EC50为35.32 µg·mL-1,马杜霉素Ⅱ主要通过抑制植物病原菌的蛋白质合成发挥抑菌作用[21-22]。洋葱伯克霍尔德氏菌()产生的硝吡咯菌素(pyrrolnitrin)能抑制辣椒疫霉,其抑菌机制为阻碍蛋白质、RNA和DNA的合成,且高浓度的硝吡咯菌素还会增加细胞膜通透性[23-24]。多黏类芽孢杆菌()产生的杀镰孢菌素(fusaricidins)对辣椒疫霉的MIC为16 µg·mL-1,且在叶面喷施杀镰孢菌素可显著抑制疫病[25]。杀镰孢菌素是一类环脂六肽化合物,对真菌和细菌均具有抑制活性,其作用机制为破坏细胞膜[26]。【本研究切入点】前期已优化了球毛壳菌固态发酵产抗植物病原菌活性物质的工艺,并发现球毛壳菌的小麦秸秆发酵产物对辣椒疫霉的体外抑制效果很好,1 mg·mL-1的粗提物对辣椒疫霉的抑制率可达92.86%[27],抑制辣椒疫霉的效果显著高于球毛壳菌在PDB培养基中发酵所得的粗提物[28]。此外,利用微生物发酵产物制备抑菌剂的研究很多,而能真正上市使用的产品却很少,其主要原因包括产物稳定性差、抑菌机制不清楚和田间抑制效果不明显等,因而限制了其应用。鉴于此,开展对球毛壳菌的小麦秸秆发酵产物抑制辣椒疫霉的稳定性和抑菌机制研究。【拟解决的关键问题】明确球毛壳菌小麦秸秆发酵产物抑制辣椒疫霉的热、酸碱、光和时间稳定性,探究该产物对辣椒疫霉菌丝形态、细胞壁、细胞膜和活性氧代谢等的影响,以了解其抑制辣椒疫霉的机制。
1 材料与方法
试验于2022年5月至2023年7月在江西师范大学生命科学学院/江西省亚热带植物资源保护与利用重点实验室完成。
1.1 材料
1.1.1 菌株 球毛壳菌DX-THS3为江西省抚州市东乡野生稻的内生真菌,由本课题组鉴定和保存。辣椒疫霉FU-4由江西农业大学农学院向妙莲教授赠送。
1.1.2 培养基 马铃薯葡萄糖琼脂(PDA)培养基(g·L-1):200 g马铃薯,葡萄糖20 g,琼脂18 g,pH自然。马铃薯葡萄糖液体(PDB)培养基(g·L-1):不加琼脂,方法同上。小麦秸秆固态培养基:取16 g小麦秸秆(60—100目)、4 g麦麸和80 mL蒸馏水于1 L锥形瓶中,并充分搅拌,于121 ℃灭菌20 min。
1.2 主要仪器与试剂
ZWY-2112B恒温摇床(上海智城有限公司);PQX-280A-12HM恒温培养箱(宁波莱福科技有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);H1750R高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);KQ5200超声波清洗器(昆山市超声仪器有限公司);SpectraMax M2酶标仪(Molecular Devices);B203光学显微镜(重庆奥特光学仪器有限责任公司)。分析纯丙酮、甲醇、乙酸乙酯(西陇科学股份有限公司);3,5-二亚硝基水杨酸和考马斯亮蓝G-250(北京索莱宝科技有限公司);2,7-二氯二氢荧光素二乙酸酯(DCFH-DA,碧云天生物技术有限公司);碱性磷酸酶试剂盒、过氧化氢含量试剂盒、-半乳糖苷酶试剂盒、过氧化氢酶试剂盒、-葡萄糖苷酶试剂盒、超氧化物歧化酶试剂盒、多聚半乳糖醛酸酶试剂盒和过氧化物酶试剂盒(苏州格锐思生物科技有限公司)。
1.3 粗提物制备
先将球毛壳菌接种至PDA培养基,于28 ℃培养7 d,待菌株活化后,刮取菌丝接种到PDB培养基中,并于28 ℃、160 r/min恒温摇床中培养4—5 d,即可得到球毛壳菌种子液,然后将球毛壳菌种子液接种到小麦秸秆固态培养基中并拌匀,每瓶接种量为10 mL,于26 ℃静置避光发酵25 d[27]。固态发酵结束后,用玻璃棒搅动发酵物,尽量使发酵物分散,然后加入丙酮,超声辅助提取30 min,重复3次,收集丙酮浸提液并减压旋蒸,最后用乙酸乙酯萃取3次,收集乙酸乙酯层,并将其减压旋蒸即可制得粗提物[27]。
1.4 粗提物抑制辣椒疫霉的稳定性测定
1.4.1 抑制率测定 采用菌丝生长抑制法测定粗提物(1 mg·mL-1)对辣椒疫霉的抑制率。将粗提物用甲醇充分溶解,使其浓度为100 mg·mL-1,并用0.22 μm的无菌滤头过滤掉粗提物溶液中的微生物。在含有49.5 mL PDA培养基(温度为50 ℃左右)的锥形瓶中加入500 μL粗提物溶液(100 mg·mL-1)并摇匀,然后倒平板制成1 mg·mL-1的含粗提物平板,以含有等体积甲醇的PDA培养基为对照。利用打孔器(直径6 mm)在辣椒疫霉菌落边缘取相同大小的菌块,并分别接种于粗提物和对照处理组的平板中央,每处理4个重复,于28 ℃恒温培养箱中黑暗培养[27]。待对照组中辣椒疫霉菌落生长至近培养皿边缘时,采用十字交叉法测量菌丝生长直径,抑制率计算公式:抑制率(%)=100×(对照组菌落直径-含药组菌落直径)/(对照组菌落直径-6 mm)[27,29]。
1.4.2 热稳定性测定 粗提物用甲醇充分溶解,使粗提物浓度为100 mg·mL-1,将粗提物溶液等量分装到EP管中,每管800 μL。将EP管分别放在40、50、60、70、80和90 ℃水浴锅中水浴2 h,另一样品则在121 ℃高压灭菌20 min,将未进行温度处理的样品(于4 ℃存放)作为对照。然后采用菌丝生长抑制法(详见1.4.1)测定不同温度处理下粗提物(1 mg·mL-1)对辣椒疫霉的抑制率,若抑制率与对照相比无显著差异,则说明稳定性高。
1.4.3 酸碱稳定性测定 粗提物用甲醇充分溶解,使粗提物浓度为100 mg·mL-1,并测量粗提物溶液的pH,测得该pH为7,再将粗提物溶液等量分装到EP管中,每管800 μL。将EP管中溶液的pH分别调到1、3、5、9、11、13,作用2 h后将pH调回7。再加入适量的甲醇,使各处理的粗提物浓度保持一致,将未处理的粗提物溶液(pH 7)作为对照。然后采用菌丝生长抑制法(详见1.4.1)测定不同pH处理下粗提物(1 mg·mL-1)对辣椒疫霉的抑制率,若抑制率与对照相比无显著差异,则说明稳定性高。
1.4.4 光稳定性测定 粗提物用甲醇充分溶解,使粗提物浓度为100 mg·mL-1,将粗提物溶液等量分装到EP管中,每管800 μL。将EP管放入25 ℃人工气候箱中进行光照处理,光照种类为直射的LED灯光,光照强度为7 500 lx,处理时间分别为2、4、6、8、10、12 d。将25 ℃避光保存的粗提物(光照 0 d)作为对照,然后采用菌丝生长抑制法(详见1.4.1)测定不同光照时间处理下粗提物(1 mg·mL-1)对辣椒疫霉的抑制率,若抑制率与对照相比无显著差异,则说明稳定性高。
1.4.5 时间稳定性测定 粗提物用甲醇充分溶解,使粗提物浓度为100 mg·mL-1,将粗提物溶液等量分装到EP管中,每管800 μL。将EP管放入25 ℃恒温培养箱中进行避光储存,储存时间分别为10、20、30、40、50、60 d。将新提取的粗提物(储存时间0 d)作为对照,采用菌丝生长抑制法(详见1.4.1)测定不同储存时间处理下粗提物(1 mg·mL-1)对辣椒疫霉的抑制率,若抑制率与对照相比无显著差异,则说明稳定性高。
1.5 粗提物抑制辣椒疫霉的机制
1.5.1 粗提物对辣椒疫霉菌丝形态影响的观察 在含1 mg·mL-1粗提物的PDA培养基中央接种辣椒疫霉菌块,在辣椒疫霉菌块周围约1 cm处45°斜插无菌盖玻片,于28 ℃恒温培养5 d左右。取出生长了部分菌丝的盖玻片,在光学显微镜观察辣椒疫霉菌丝的生长情况并拍照。以含等量粗提物溶剂(甲醇)的培养基为阴性对照。
1.5.2 胞外酶活性和大分子物质泄露量测定 取已活化的辣椒疫霉菌块接种到含有100 mL PDB培养基的250 mL锥形瓶中,于转速为120 r/min的25 ℃恒温摇床中避光培养。培养4 d后,向锥形瓶中加入粗提物,使瓶中粗提物浓度为1 mg·mL-1,并以粗提物的溶剂甲醇为阴性对照。加入粗提物后继续培养12、24、36、48、60和72 h,然后用多层纱布过滤,收集粗提物不同时间处理下的辣椒疫霉培养滤液。培养滤液中的碱性磷酸酶和-葡萄糖苷酶活性使用试剂盒检测,并通过测定培养滤液在260和280 nm处的吸光度值来反映辣椒疫霉菌丝的核酸和蛋白质泄漏量[30]。
1.5.3 丙二醛和过氧化氢含量测定 根据1.5.2中的方法对辣椒疫霉进行培养和处理,将辣椒疫霉菌丝收集在双层纱布上,并用超纯水洗涤3次,然后置于-80 ℃冰箱中保存。取适量菌丝用液氮研磨,然后利用试剂盒测定辣椒疫霉菌丝的丙二醛和过氧化氢含量。
1.5.4 可溶性蛋白质和还原糖含量测定 取1.5.3中保存的辣椒疫霉菌丝用液氮研磨,称取0.2 g菌丝粉末置于玻璃匀浆器中,并加入1.8 mL PBS缓冲液(0.01 mol·L-1,pH 7.2—7.4)快速进行匀浆处理,将获得的匀浆溶液5 000 r/min 4 ℃离心10 min,然后收集上清液用于可溶性蛋白质和还原糖含量测定。可溶性蛋白质含量根据蒋大程等[31]的方法进行测定,在试管中分别加入考马斯亮蓝G-250试剂(5 mL)和上清液(0.1 mL)并充分混匀,等待2 min后在595 nm处检测溶液的吸光值,最后根据绘制标准曲线来计算可溶性蛋白质含量。还原糖含量根据Diao等[32]的方法进行测定,取0.1 mL上清液,然后分别加入1.9 mL超纯水和1.5 mL 3,5-二亚硝基水杨酸,将混合物于100 ℃水浴中加热10 min,并立即将溶液冷却至室温,最后在540 nm处检测溶液的吸光值并根据制作的标准曲线计算还原糖含量。
1.5.5 抗氧化酶、多聚半乳糖醛酸酶和-葡萄糖苷酶活性测定 辣椒疫霉菌丝的3种抗氧化酶(超氧化物歧化酶、过氧化氢酶和过氧化物酶)、多聚半乳糖醛酸酶和-葡萄糖苷酶使用试剂盒进行活性测定。取1.5.3中保存的辣椒疫霉菌丝用液氮研磨,加入适量试剂盒所提供的提取液进行匀浆,然后按照试剂盒说明书进行测定。
1.5.6 活性氧积累观察 使用荧光探针(2,7-二氯二氢荧光素二乙酸酯,DCFH-DA)对辣椒疫霉菌丝的活性氧进行检测,荧光越强则说明活性氧含量越高。按照1.5.1的方法取获取长有辣椒疫霉菌丝的盖玻片,在盖玻片上滴入0.01 mol·L-1的DCFH-DA溶液,使溶液浸没菌丝,28 ℃孵育30 min,然后使用超纯水多次清洗菌丝,并制成临时装片,最后使用荧光显微镜观察菌丝的荧光情况并拍照,荧光检测的激发波长设为488 nm,发射波长设为525 nm[33]。
1.6 数据分析
利用IBM SPSS Statistics 21软件并采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)进行差异显著性检验,以<0.05作为差异显著性判断标准。利用Origin 2018软件进行图像绘制,图中数据为平均值±标准误。
2 结果
2.1 粗提物抑制辣椒疫霉的稳定性
pH为中性时,粗提物对辣椒疫霉的抑制率最高,随着pH逐渐升高或下降,其抑制效果也逐渐下降(图1-A)。较低的温度对粗提物抑菌活性无明显影响,但超过70 ℃会显著降低粗提物对辣椒疫霉的抑制率(图1-B)。而球毛壳菌发酵粗提物经长时间的光照和储存并不会显著降低其抑制辣椒疫霉的效果(图1-C、1-D)。以上结果表明,球毛壳菌粗提物对辣椒疫霉的抑制效果不受光照和储存时间的影响,但高温(70 ℃以上)、酸性(pH 1—5)和碱性(9—13)环境则会显著降低粗提物对辣椒疫霉的抑制效果。

柱上不同小写字母表示处理间在P<0.05水平差异显著
2.2 粗提物抑制辣椒疫霉的机制
2.2.1 粗提物改变辣椒疫霉菌丝的形态 通过光学显微镜观察粗提物对辣椒疫霉菌丝外部形态的影响。对照组的辣椒疫霉菌丝均显示出正常形态,菌丝饱满且表面光滑,呈粗细均匀的圆柱状(图2-A、2-B)。而经粗提物处理后的辣椒疫霉菌丝形态发生明显改变,菌丝发生扭曲变形,其表面粗糙干瘪,布满褶皱(图2-C、2-D)。

A、B:对照组在40倍和100倍镜下的菌丝形态图mycelia morphologies of the control group at 40× and 100× microscope;C、D:粗提物处理组在40倍和100倍镜下的菌丝形态图Mycelia morphologies of the crude extract treatment group at 40× and 100× microscope
2.2.2 粗提物破坏辣椒疫霉的细胞壁 碱性磷酸酶(AKP)通常存在于细胞壁和细胞膜之间,在细胞壁结构正常时,其在胞外的含量极低,但如果细胞壁被破坏,AKP则会泄漏到细胞外,因此可通过检测细胞外的AKP活性变化来反映细胞壁是否受到损坏[34-35]。粗提物对辣椒疫霉胞外AKP活性的影响如图3所示。粗提物处理组的AKP活性在12、24、36、48、60和72 h时均显著高于对照组,这说明粗提物可破坏辣椒疫霉细胞壁的完整性,造成菌体细胞壁通透性增加,使AKP泄漏到细胞外。而随着处理时间的延长,对照组的AKP活性出现增加的趋势,其原因主要是辣椒疫霉在不断死亡,而死亡的辣椒疫霉细胞壁通透性会增加,且易发生破裂。
2.2.3 粗提物破坏辣椒疫霉的细胞膜-半乳糖苷酶(-GAL)位于细胞膜内部,当细胞膜结构受损时,-GAL会泄露到胞外[35]。因此,可通过检测胞外-GAL活性变化来反映细胞膜结构是否受到破坏。粗提物对辣椒疫霉胞外-GAL活性的影响如图4-A所示。与对照相比,粗提物处理组能增加辣椒疫霉胞外的-GAL活性,特别是在12 h时,处理组的-GAL活性显著高于对照组,这说明粗提物能破坏辣椒疫霉的细胞膜,增加细胞膜的通透性,使胞内-GAL外泄。丙二醛(MDA)是细胞膜脂质过氧化生成的产物,会导致细胞膜的损伤,引发细胞中的大分子物质发生交联聚合,可通过检测其含量间接反映脂质过氧化程度以及膜系统受损程度[36-37]。如图4-B所示,与对照相比,粗提物处理会使辣椒疫霉菌丝的MDA含量显著增加,且MDA含量与处理时间总体上呈正比。结果表明,粗提物能刺激辣椒疫霉细胞膜脂质发生过氧化,造成细胞膜的损伤。

CK:阴性对照组negative control group;TS:1 mg·mL-1的粗提物处理组1 mg·mL-1 crude extract treatment group。*:TS与CK处理在P<0.05水平差异显著significant differences between TS and CK treatment at P<0.05 level。下同The same as below
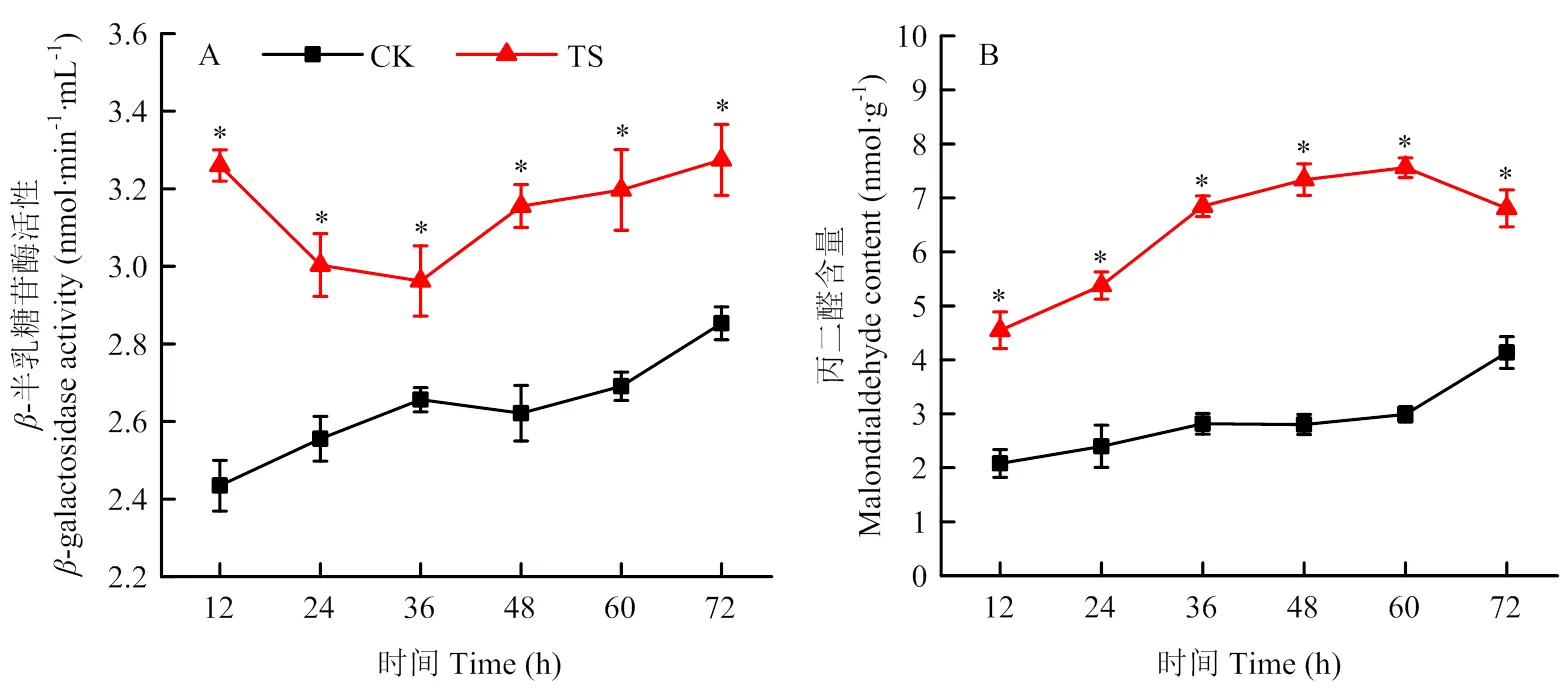
图4 粗提物对辣椒疫霉胞外β-半乳糖苷酶活性和菌丝丙二醛含量的影响
据报道,当细胞膜受到损伤或破坏,细胞中的蛋白质和核酸等大分子物质会泄漏[38]。核酸和蛋白质在260和280 nm波长处有较强的吸收峰,因此通过检测辣椒疫霉培养液在260和280 nm的吸光值来间接反映细胞膜是否受到破坏。由图5可知,经粗提物处理的辣椒疫霉培养液在260和280 nm处的吸光度始终高于对照组,说明粗提物破坏了辣椒疫霉细胞膜,造成核酸和蛋白质等细胞内容物的泄露。

图5 粗提物对辣椒疫霉核酸和蛋白质外泄的影响
2.2.4 粗提物降低辣椒疫霉菌丝的可溶性蛋白和还原糖含量 粗提物对辣椒疫霉可溶性蛋白和还原糖含量的影响如图6所示。与对照组相比,粗提物处理可显著降低辣椒疫霉菌丝中的可溶性蛋白和还原糖含量,并能持续72 h以上。
2.2.5 粗提物干扰辣椒疫霉活性氧的代谢 抑制抗氧化酶活性容易导致活性氧(ROS)产生与消除的动态平衡被破坏,进而导致氧化应激,影响细胞的正常生命活动。由图7可知,与对照相比,粗提物处理辣椒疫霉后,其菌丝中的抗氧化酶包括超氧化物歧化酶、过氧化氢酶和过氧化物酶的活性有不同程度的下降,且对过氧化氢酶活性的抑制作用最强(图7-A—C)。ROS具有多种形态,包括过氧化氢(H2O2)、超氧阴离子()、单线态氧(O1)以及羟基自由基(-OH)等,其中H2O2是ROS的典型代表之一[39]。经粗提物处理后,辣椒疫霉菌丝中过氧化氢含量显著升高,且与处理时间呈正相关(图7-D)。这表明辣椒疫霉的抗氧化酶被抑制,使得活性氧消除与生成的动态平衡被打破,活性氧发生大量积累。

图7 粗提物对辣椒疫霉菌丝中抗氧化酶活性及过氧化氢含量的影响
为进一步验证粗提物可导致辣椒疫霉活性氧积累,利用荧光探针(DCFH-DA)处理辣椒疫霉菌丝,通过荧光的强弱来反映活性氧含量。由图8可见,对照组的荧光强度非常弱(图8-A、8-B),说明在正常情况下辣椒疫霉菌丝中活性氧含量低;而经粗提物处理后的辣椒疫霉菌丝有非常强的荧光(图8-C、8-D),说明菌丝细胞中积累了大量的活性氧。以上结果表明,粗提物通过抑制抗氧化酶活性来干扰辣椒疫霉菌丝活性氧的代谢,使大量活性氧被积累并引发氧化应激,从而抑制辣椒疫霉的正常生命活动。

A、B:对照组的相同视野在光学显微镜、荧光显微镜下的照片the photos of the same field of view of the control group under an optical microscope and a fluorescence microscope, respectively;C、D:粗提物处理组的相同视野在光学显微镜、荧光显微镜下的照片The photos of the same field of view of the crude extract treatment group under an optical microscope and a fluorescence microscope, respectively
2.2.6 粗提物降低辣椒疫霉的致病力 多聚半乳糖醛酸酶(PG)和-葡萄糖苷酶(-GC)的活性高低可用于表征辣椒疫霉致病力的强弱[40-41]。用粗提物处理后,辣椒疫霉的PG和-GC活性变化如图9所示。在处理时间为12和24 h时,处理组的PG活性低于对照组,且处理时间为24 h时对PG活性的抑制作用最强,而在48、60和72 h时对PG活性无明显抑制作用(图9-A)。除72 h之外,粗提物处理组均能显著降低-GC活性,以36 h的抑制效果最佳(图9-B)。结果表明,粗提物能在一定时间内显著降低辣椒疫霉的PG和-GC活性,且对-GC的抑制作用高于PG。而超出一定时间后粗提物对PG和-GC活性无显著抑制作用,可能是因为粗提物的长时间作用激发了辣椒疫霉的自我保护机制。

图9 粗提物对辣椒疫霉多聚半乳糖醛酸酶活性和β-葡萄糖苷酶活性的影响
3 讨论
3.1 球毛壳菌粗提物抑制辣椒疫霉的稳定性
天然产物能否在田间用作商业杀菌剂主要取决于其能否在不同环境条件下发挥良好作用[42]。本研究结果表明,球毛壳菌的小麦秸秆发酵粗提物分别在4 ℃储存0—60 d、7 500 lx的光照强度下光照0—12 d和≤70 ℃的热处理条件下不会影响其对辣椒疫霉的抑制效果,而在酸性(pH 1—5)或碱性(9—13)环境中则会显著降低粗提物对辣椒疫霉的抑制效果。其原因可能是酸性、碱性及高温环境使具抑菌活性的物质发生变性或者降解,从而导致其抑菌效果下降。Zhao等[43]研究发现球毛壳菌CDW7的发酵液经100 ℃处理后会使其对油菜菌核病菌()的抑制活性降低;Pan等[28]研究表明球毛壳菌的乙酸乙酯粗提物70 ℃处理不会显著降低其抑菌活性,本研究结果与之相符。此外,由于实验环境条件与自然环境条件的差距较大,后续应研究该粗提物在自然环境中经多种因素共同作用后对辣椒疫霉的抑制效果,以此来评估粗提物抑制辣椒疫霉的稳定性则更具说服力。
3.2 球毛壳菌粗提物抑制辣椒疫霉的机制
化合物的抑菌机制可能与改变细胞壁和内膜通透性、抑制蛋白质和核酸的合成以及抑制酶活性有关[44]。本研究发现,粗提物处理会使辣椒疫霉菌丝发生扭曲皱缩现象,而王荣波等[45]用枯草芽孢杆菌()的发酵液处理辣椒疫霉菌丝,使菌丝呈现不同程度的膨大且顶端分枝变多。菌丝扭曲皱缩的原因可能是粗提物破坏了辣椒疫霉菌丝的细胞壁和细胞膜,导致细胞内物质外漏,进而使菌丝形态发生改变。基于此,笔者通过测定辣椒疫霉胞外的碱性磷酸酶活性、-半乳糖苷酶活性、大分子物质泄露量和丙二醛含量,证明粗提物能破坏辣椒疫霉细胞壁和细胞膜,增加细胞壁和细胞膜的通透性,进而导致胞内物质大量外泄。粗提物可破坏辣椒疫霉的细胞壁,可能是因为该粗提物中含有细胞壁水解酶。球毛壳菌产生的细胞壁水解酶主要为葡聚糖酶和几丁质酶[10]。Inglis等[46]认为球毛壳菌分泌的-葡聚糖酶可引起终极腐霉()的细胞壁降解;LIU等[47]发现球毛壳菌产生的几丁质酶能有效降解多种植物病原真菌的细胞壁;Wang等[48]研究发现,球毛壳菌产生的多糖通过诱导细胞膜去极化和降低细胞膜上Ca2+-Mg2+-ATP酶活性来破坏细胞膜。该粗提物是否与以上多糖具有类似的细胞膜破坏机制还未可知,但可以肯定的是,粗提物可通过增加丙二醛含量来损伤细胞膜。
本研究发现球毛壳菌粗提物可显著降低辣椒疫霉菌丝中可溶性蛋白和还原糖含量,其原因可能是粗提物破坏了细胞膜,导致蛋白质和还原糖泄露,或抑制了蛋白质和还原糖的合成,又或者是以上两个原因共同造成的,具体原因还有待进一步研究。嗜线虫致病杆菌()产生的xenocoumacin 1产物通过与精氨酸tRNA结合来抑制肽链的延伸,从而影响辣椒疫霉蛋白质的合成[22,49]。褶皱链霉菌()产生的疏螺体素(borrelidin)可通过抑制苏氨酸tRNA合成酶活性,以抑制辣椒疫霉蛋白质的合成[50-51]。
活性氧(ROS)是细胞新陈代谢的副产物,在正常条件下,活性氧的产生和消除处于动态平衡。ROS的过度产生或抗氧化酶被抑制可能会破坏ROS的动态平衡并导致氧化应激,氧化应激会导致蛋白质氧化、DNA损伤、酶抑制,甚至引发细胞程序性死亡,这被认为是大多数物质抑菌的主要机制[52-54]。抗氧化酶包括超氧化物歧化酶、过氧化氢酶以及过氧化物酶等,抗氧化酶活性的增加有助于抑制脂质过氧化并清除ROS[55-56]。本研究发现,粗提物可抑制抗氧化酶活性,特别是过氧化氢酶的活性,使ROS的典型代表过氧化氢大量积累,干扰了ROS的正常代谢,从而抑制辣椒疫霉的正常生命活动。多种微生物均能产生吩嗪-1-羧酸(phenazine-1-carboxylic acid),它是绿色农药申嗪霉素(shenqinmycin)的主要成分,可通过增加ROS(超氧离子和过氧化氢)含量抑制辣椒疫霉生长[1],本研究结果与之一致。
辣椒疫霉分泌的多聚半乳糖醛酸酶(PG)和-葡萄糖苷酶(-GC)是其感染辣椒等植物的主要毒力因子,可导致宿主植物细胞壁结构解体和组织软化,如果能抑制这两种酶的活性,则可能显著降低辣椒疫霉的致病能力,从而起到减轻病害发生发展的作用[40-41]。本研究发现,粗提物能在一定时间内显著降低辣椒疫霉的PG和-GC活性,且对-GC的抑制作用高于PG。刘青等[57]研究发现木霉菌发酵液能降低辣椒疫霉的致病力,对辣椒疫霉的PG和-GC酶活性有显著的抑制作用;Yin等[58]研究也表明植物提取物能降低辣椒疫霉的PG和-GC活性,且对-GC的抑制作用也高于PG,本研究结果与之一致。
本研究发现球毛壳菌代谢产物对辣椒疫霉的抑制机制主要是破坏细胞膜和细胞壁、减少蛋白质和还原糖含量以及干扰活性氧代谢使活性氧积累,但代谢产物是如何破坏细胞膜和细胞壁,如何减少蛋白质和还原糖含量,如何具体干扰活性氧代谢以及是否还存在其他的抑菌机制尚未可知,因此还需进一步深入研究粗提物对辣椒疫霉的抑制机制。此外,该粗提物对辣椒疫霉有良好的抑制效果,但具体是哪种或哪些物质在其中起抑菌作用还未知。因此,后续应借助天然产物分离手段对其发酵产物进行分离纯化,以明确抑菌物质的结构与类型。
4 结论
球毛壳菌小麦秸秆固态发酵粗提物中抑制辣椒疫霉的活性物质不受光照和储存时间的影响,但70 ℃以上的热处理和pH 1—5和9—13的酸碱处理会显著降低粗提物对辣椒疫霉的抑制效果。此外,粗提物处理会改变菌丝形态,破坏辣椒疫霉细胞壁和细胞膜,导致细胞内物质泄漏,降低辣椒疫霉菌丝中蛋白质和还原糖含量,抑制辣椒疫霉的抗氧化酶活性,进而干扰活性氧代谢使活性氧大量积累,还会降低辣椒疫霉致病因子多聚半乳糖醛酸酶和-葡萄糖苷酶的活性,从而削弱辣椒疫霉的致病力。
[1] 廖宏娟, 张志斌, 江玉梅, 朱笃. 微生物次级代谢产物抗辣椒疫霉的研究进展. 天然产物研究与开发, 2023, 35(4): 705-721.
LIAO H J, ZHANG Z B, JIANG Y M, ZHU D. Research progress of microbial secondary metabolites against. Natural Product Research and Development, 2023, 35(4): 705-721. (in Chinese)
[2] LAMOUR K H, STAM R, JUPE J, HUITEMA E. The oomycete broad-host-range pathogen. Molecular Plant Pathology, 2012, 13(4): 329-337.
[3] MATHERON M, PORCHAS M. Effectiveness of nine different fungicides for management of crown and root rot of chile pepper plants caused by. Plant Health Progress, 2015, 16: 218-222.
[4] LI Q, AI G, SHEN D, ZOU F, WANG J, BAI T, CHEN Y, LI S, ZHANG M, JING M, DOU D. Aeffector targets ACD11 binding partners that regulate ROS-mediated defense response in. Molecular Plant, 2019, 12(4): 565-581.
[5] WANG Y, SUN Y, ZHANG Y, ZHANG X, FENG J. Antifungal activity and biochemical response of cuminic acid againstLeonian. Molecules, 2016, 21(6): 756.
[6] FERNANDEZ-ORTUNO D, TORES J A, CHAMORRO M, PEREZ-GARCIA A, VICENTE A. Characterization of resistance to six chemical classes of site-specific fungicides registered for gray mold control on strawberry in Spain.Plant Disease, 2016, 100(11): 2234-2239.
[7] MATSON M E, SMALL I M, FRY W E, JUDELSON H S. Metalaxyl resistance in: assessing role of rpa190 gene and diversity within clonal lineages. Phytopathology, 2015, 105(12): 1594-1600.
[8] BOCQUET L, RIVIERE C, DERMONT C, SAMAILLIE J, HILBERT J L, HALAMA P, SIAH A, SAHPAZ S. Antifungal activity of hop extracts and compounds against the wheat pathogen. Industrial Crops and Products, 2018, 122: 290-297.
[9] PAWASKAR M, KERKAR S. Microbial biocontrol agents against chilli plant pathogens over synthetic pesticides: a review. Proceedings of the Indian National Science Academy, 2021, 87(4): 578-594.
[10] 廖宏娟, 张志斌, 江玉梅, 朱笃. 球毛壳菌对植物病原真菌和根结线虫的生物防治潜力. 天然产物研究与开发, 2022, 34(6): 1076-1089.
LIAO H J, ZHANG Z B, JIANG Y M, ZHU D. Biocontrol potential ofagainst plant pathogenic fungi and root-knot nematodes: a review. Natural Product Research and Development, 2022, 34(6): 1076-1089. (in Chinese)
[11] BURKHARDT A, DAY B. A genomics perspective on cucurbit- oomycete interactions. Plant Biotechnology, 2013, 30(3): 265-271.
[12] GRANKE L L, QUESADA-OCAMPO L, LAMOUR K, HAUSBECK M K. Advances in research onon vegetable crops in the United States. Plant Disease, 2012, 96(11): 1588-1600.
[13] KAMOUN S, FURZER O, JONES J D G, JUDELSON H S, ALI G S, DALIO R J D, ROY S G, SCHENA L, ZAMBOUNIS A, PANABIERES F,. The Top 10 oomycete pathogens in molecular plant pathology. Molecular Plant Pathology, 2015, 16(4): 413-434.
[14] 梁海林, 童志武, 朱笃. 球毛壳菌次级代谢产物及其生物活性研究进展. 天然产物研究与开发, 2018, 30(4): 609, 702-707.
LIANG H L, TONG Z W, ZHU D. Secondary metabolites fromand their bioactivities. Natural Product Research and Development, 2018, 30(4): 609, 702-707. (in Chinese)
[15] 徐国波, 张青艳, 周孟. 毛壳属真菌的次生代谢产物及其生物活性研究进展. 天然产物研究与开发, 2018, 30(3): 515-525.
XU G B, ZHANG Q Y, ZHOU M. Review on the secondary metabolites and its biological activities fromfungi. Natural Product Research and Development, 2018, 30(3): 515-525. (in Chinese)
[16] PARK J H, CHOI G J, JANG K S, LIM H K, KIM H T, CHO K Y, KIM J C. Antifungal activity against plant pathogenic fungi of chaetoviridins isolated from. FEMS Microbiology Letters, 2005, 252(2): 309-313.
[17] YAN W, CAO L L, ZHANG Y Y, ZHAO R, ZHAO S S, KHAN B, YE Y H. New metabolites from endophytic fungusCDW7. Molecules, 2018, 23(11): 2873.
[18] ZHANG Y, ZHU H Q, YE Y H, TANG C M. Antifungal activity of chaetoviridin A fromCEF-082 metabolites againstin cotton. Molecular Plant-Microbe Interactions, 2021, 34(7): 758-769.
[19] XIAO Y, LI H X, LI C, WANG J X, LI J, WANG M H, YE Y H. Antifungal screening of endophytic fungi fromfor discovery of potent anti-phytopathogenic fungicides. FEMS Microbiology Letters, 2013, 339(2): 130-136.
[20] MONDOL M A M, FARTHOUSE J, ISLAM M T, SCHUFFLER A, LAATSCH H. A new lactone fromstrain M65 that inhibits the motility of zoospores. Natural Product Communications, 2016, 11(12): 1865-1868.
[21] 张春珍, 石丹姝, 张文波, 席雪冬, 于志国. 伯氏致病杆菌SN269发酵液中madumycin Ⅱ的分离与纯化. 农药学学报, 2016, 18(6): 783-786.
ZHANG C Z, SHI D S, ZHANG W B, XI X D, YU Z G. Isolation and purification of madumycin Ⅱ from fermented broth ofSN269. Chinese Journal of Pesticide Science, 2016, 18(6): 783-786. (in Chinese)
[22] 韩云飞, 他永全, 王勇, 冯俊涛, 王永红. 致病杆菌属细菌代谢物抑菌活性研究进展. 农药学学报, 2022, 24(2): 217-231.
HAN Y F, TA Y Q, WANG Y, FENG J T, WANG Y H. Advances in antimicrobial substances from genus. Chinese Journal of Pesticide Science, 2022, 24(2): 217-231. (in Chinese)
[23] JUNG B K, HONG S J, PARK G S, KIM M C, SHIN J H. Isolation ofJBK9 with plant growth-promoting activity while producing pyrrolnitrin antagonistic to plant fungal diseases. Applied Biological Chemistry, 2018, 61(2): 173-180.
[24] PAWAR S, CHAUDHARI A, PRABHA R, SHUKLA R, SINGH D P. Microbial pyrrolnitrin: natural metabolite with immense practical utility. Biomolecules, 2019, 9(9): 443.
[25] LEE S H, CHO Y E, PARK S H, BALARAJU K, PARK J W, LEE S W, PARK K. An antibiotic fusaricidin: a cyclic depsipeptide fromE681 induces systemic resistance against phytophthora blight of red-pepper. Phytoparasitica, 2013, 41(1): 49-58.
[26] 郭赛赛, 张敬泽. 多粘类芽孢杆菌及其脂肽化合物研究进展. 农药学学报, 2019, 21(5/6): 787-798.
GUO S S, ZHANG J Z. Research progress ofand its lipopeptide compounds. Chinese Journal of Pesticide Science, 2019, 21(5/6): 787-798. (in Chinese)
[27] 廖宏娟, 江玉梅, 冶霞, 张志斌, 马童雨, 朱笃. 球毛壳菌固态发酵产抗植物病原真菌活性物质的工艺优化. 中国农业科学, 2023, 56(11): 2106-2117. doi: 10.3864/j.issn.0578-1752.2023.11. 006.
LIAO H J, JIANG Y M, YE X, ZHANG Z B, MA T Y, ZHU D. Optimization of solid state fermentation for production of active substances against plant pathogenic fungi from. Scientia Agricultura Sinica, 2023, 56(11): 2106-2117. doi: 10.3864/ j.issn.0578-1752.2023.11.006. (in Chinese)
[28] PAN F, LIU Z Q, CHEN Q, XU Y W, HOU K, WU W. Endophytic fungus strain 28 isolated frompossesses wide-spectrum antifungal activity. Brazilian Journal of Microbiology, 2016, 47(2): 480-488.
[29] 王轶楠, 赵特, 高飞, 段鹏飞, 刘向阳, 周琳. 山苍子精油对辣椒疫霉生长发育的影响及对辣椒疫病的防效. 植物保护学报, 2018, 45(5): 1112-1120.
WANG Y N, ZHAO T, GAO F, DUAN P F, LIU X Y, ZHOU L. Effects ofessential oils on the growth and development of oomycete pathogenand pepper blight. Journal of Plant Protection, 2018, 45(5): 1112-1120. (in Chinese)
[30] 田立鹏, 万强贵, 王婷, 李春爱, 蔡梦, 蒲陆梅. 油橄榄叶提取物对抑菌效果与机理研究. 核农学报, 2023, 37(2): 329-337.
TIAN L P, WAN Q G, WANG T, LI C A, CAI M, PU L M. Study on antibacterial effect and mechanism of olive leaf extract on. Journal of Nuclear Agricultural Sciences, 2023, 37(2): 329-337. (in Chinese)
[31] 蒋大程, 高珊, 高海伦, 邱念伟. 考马斯亮蓝法测定蛋白质含量中的细节问题. 实验科学与技术, 2018, 16(4): 143-147.
JIANG D C, GAO S, GAO H L, QIU N W. The details of protein content determination by coomassie brilliant blue staining. Experiment Science and Technology, 2018, 16(4): 143-147. (in Chinese)
[32] DIAO W R, HU Q P, ZHANG H, XU J G. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Mill). Food Control, 2014, 35(1): 109-116.
[33] PAN X, XU S, WU J, LUO J, DUAN Y, WANG J, ZHANG F, ZHOU M. Screening and characterization ofpv.strains with resistance to pheazine-1-carboxylic acid. Pesticide Biochemistry and Physiology, 2018, 145: 8-14.
[34] TANG X, OUYANG Q L, JING G X, SHAO X F, TAO N G. Antifungal mechanism of sodium dehydroacetate against. World Journal of Microbiology and Biotechnology, 2018, 34(2): 29.
[35] WANG Z C, XUE R H, CUI J W, WANG J P, FAN W H, ZHANG H R, ZHAN X B. Antibacterial activity of a polysaccharide produced fromCGMCC 6882. International Journal of Biological Macromolecules, 2019, 125: 376-382.
[36] KONG W W, HUANG C Y, CHEN Q, ZOU Y J, ZHANG J X. Nitric oxide alleviates heat stress induced oxidative damage invar.. Fungal Genetics and Biology, 2012, 49(1): 15-20.
[37] WANG B, LIU F, LI Q, XU S, ZHAO X, XUE P, FENG X. Antifungal activity of zedoary turmeric oil againstthrough damaging cell membrane. Pesticide Biochemistry and Physiology, 2019, 159: 59-67.
[38] YANG J J, WANG Q Z, LI L W, LI P R, YIN M, XU S, CHEN Y, FENG X, WANG B. Chemical composition and antifungal activity offruit essential oil against. Molecules, 2022, 27(23): 8636.
[39] 杨康, 陈健, 辛爱景, 蔡金霞, 石志琦, 杨立飞. 麝香草酚抑制灰霉菌的作用机理: PAO-H2O2系统. 应用生态学报, 2020, 31(7): 2441-2448.
YANG K, CHEN J, XIN A J, CAI J X, SHI Z Q, YANG L F. Mechanism of thymol inhibiting: PAO-H2O2system. Chinese Journal of Applied Ecology, 2020, 31(7): 2441-2448. (in Chinese)
[40] 李萍, 张茜茹, 吴亚, 高智谋. 辣椒疫霉多聚半乳糖醛酸酶活性对其致病力的影响. 安徽农业科学, 2015, 43(19): 111-113, 167.
LI P, ZHANG Q R, WU Y, GAO Z M. Effect of activities of polygalacturonase on pathogenicity in. Journal of Anhui Agricultural Sciences, 2015, 43(19): 111-113, 167. (in Chinese)
[41] XIA Y, YANG L R, XIA L M. High-level production of a fungal-glucosidase with application potentials in the cost-effective production ofcellulase. Process Biochemistry, 2018, 70: 55-60.
[42] GLARE T, CARADUS J, GELERNTER W, JACKSON T, KEYHANI N, KOHL J, MARRONE P, MORIN L, STEWART A. Have biopesticides come of age? Trends in Biotechnology, 2012, 30(5): 250-258.
[43] ZHAO S S, ZHANG Y Y, YAN W, CAO L L, XIAO Y, YE Y H.CDW7, a potential biological control strain and its antifungal metabolites. FEMS Microbiology Letters, 2017, 364(3): fnw287.
[44] BALAMAYOORAN G, BATRA S, FESSLER M B, HAPPEL K I, JEYASEELAN S. Mechanisms of neutrophil accumulation in the lungs against bacteria. American Journal of Respiratory Cell and Molecular Biology, 2010, 43(1): 5-16.
[45] 王荣波, 陈姝樽, 肖小露, 李本金, 刘裴清, 石茗月, 陈庆河, 翁启勇. 枯草芽胞杆菌BS193对辣椒疫霉的拮抗作用及其相关生防因子检测. 农业生物技术学报, 2022, 30(4): 772-782.
WANG R B, CHEN S Z, XIAO X L, LI B J, LIU P Q, SHI M Y, CHEN Q H, WENG Q Y. Antagonistic activity and related biocontrol factors detection ofBS193 on. Journal of Agricultural Biotechnology, 2022, 30(4): 772-782. (in Chinese)
[46] INGLIS G D, KAWCHUK L M. Comparative degradation of oomycete, ascomycete, and basidiomycete cell walls by mycoparasitic and biocontrol fungi. Canadian Journal of Microbiology, 2002, 48(1): 60-70.
[47] LIU Z H, YANG Q, HU S, ZHANG J D, MA J. Cloning and characterization of a novel chitinase gene (chi46) fromand identification of its biological activity. Applied Microbiology and Biotechnology, 2008, 80(2): 241-252.
[48] WANG Z C, ZHU J F, LI W T, LI R F, WANG X Q, QIAO H Z, SUN Q, ZHANG H R. Antibacterial mechanism of the polysaccharide produced byCGMCC 6882 against. International Journal of Biological Macromolecules, 2020, 159: 231-235.
[49] ZHOU T T, YANG X F, QIU D W, ZENG H M. Inhibitory effects of xenocoumacin 1 on the different stages ofand its control effect on phytophthora blight of pepper. Biological Control, 2017, 62: 151-160.
[50] CHEN Y Y, CHEN P C, TSAY T T. The biocontrol efficacy and antibiotic activity ofon the oomycete. BioControl, 2016, 98: 34-42.
[51] GAO Y M, WANG X J, ZHANG J, LI M, LIU C X, AN J, JIANG L, XIANG W S. Borrelidin, a potent antifungal agent: insight into the antifungal mechanism against. Journal of Agricultural and Food Chemistry, 2012, 60: 9874-9881.
[52] LI Y, ZHANG W, NIU J F, CHEN Y S. Mechanism of photogenerated reactive oxygen species and correlation with the antibacterial properties of engineered metal-oxide nanoparticles. ACS Nano, 2012, 6(6): 5164-5173.
[53] HUANG T, HOLDEN J A, HEATH D E, O'BRIEN-SIMPSON N M, O’CONNOR A J. Engineering highly effective antimicrobial selenium nanoparticles through control of particle size. Nanoscale, 2019, 11(31): 14937-14951.
[54] STANCILL J S, BRONIOWSKA K A, OLESON B J, NAATZ A, CORBETT J A. Pancreatic-cells detoxify H2O2through the peroxiredoxin/thioredoxin antioxidant system. Journal of Biological Chemistry, 2019, 294(13): 4843-4853.
[55] ESTRADA B, AROCA R, BAREA J M, RUIZ-LOZANO J M. Native arbuscular mycorrhizal fungi isolated from a saline habitat improved maize antioxidant systems and plant tolerance to salinity. Plant Science, 2013, 201/202: 42-51.
[56] AHMAD P, ABDEL LATEF A A, HASHEM A, ABD ALLAH E F, GUCEL S, TRAN L S P. Nitric oxide mitigates salt stress by regulating levels of osmolytes and antioxidant enzymes in chickpea. Frontiers in Plant Science, 2016, 7: 347.
[57] 刘青, 李升, 梁才康, 张红辉, 吴静, 王嘉福, 冉雪琴. 贵州地区木霉菌分离鉴定及对辣椒疫霉的拮抗作用. 微生物学通报, 2019, 46(4): 741-751.
LIU Q, LI S, LIANG C K, ZHANG H H, WU J, WANG J F, RAN X Q. Isolation and identification ofspp. against. Microbiology China, 2019, 46(4): 741-751. (in Chinese)
[58] YIN F M, LIU Q F, ZHANG B J, ZHANG X, HE J G, XIE J, HU Z, SUN R F. Microemulsion preparation ofextracts and preliminary antifungal mechanism exploration. Industrial Crops and Products, 2021, 172: 114000.
Stability and mechanism of wheat straw fermentation products ofagainst
LIAO HongJuan1, TAN JiaSi1, ZHANG ZhiBin1, YU JingRong1, ZHANG XinYue1, JIANG YuMei1, ZHU Du1,2
1College of Life Sciences, Jiangxi Normal University/Key Laboratory of Protection and Utilization of Subtropic Plant Resources of Jiangxi Province, Nanchang 330022;2College of Life Sciences, Jiangxi Science and Technology Normal University/Key Laboratory of Bioprocess Engineering of Jiangxi Province, Nanchang 330013
【Objective】Crop blight caused byhas caused huge economic losses to crop industries such as pepper. The aim of this paper is to explore the inhibition stability and mechanism againstby metabolites of, and to provide references for the research and development of microbial fungistatic agents for the inhibition of.【Method】To investigate the thermal, acid-base, light and time stability of the crude extract against, the crude extracts were treated at different temperatures (40-121 ℃), pH (1-13), light times (0-12 d) and storage times (0-60 d), and the inhibition rate of crude extracts againstafter different treatments was determined by mycelial growth inhibition method. The effect of the crude extract on the mycelia morphology ofwas observed by optical microscopy. The effects of the crude extract on cell wall, cell membrane, active oxygen metabolism, protein content, reducing sugar content and pathogenicity ofafter being treated withfor 12-72 h were investigated by various physiological and biochemical experiments.【Result】Within the treatment range set in this experiment, the inhibition rate of the crude extract (1 mg·mL-1) againstdid not decrease significantly after treatment with different light times and storage times, and the inhibition rate remained at about 93%. The inhibition rate of crude extract againstdid not decrease significantly in the heat treatment range of 40-70 ℃, while the heat treatment above 70 ℃ significantly reduced the inhibition rate, but the inhibition rate was not less than 70%. The inhibition rate of crude extract againstwas significantly reduced in the acid-base treatment range of pH 1-5 and pH 9-13, but the inhibition rate was also not less than 70%. The treatment of crude extract affected the morphology ofmycelia, caused severe distortion and shrinkage of mycelia, and also affected the metabolism of active oxygen species, resulting in large accumulation of active oxygen species in mycelia. The alkaline phosphatase activity,-glucosidase activity, nucleic acid and protein contents in culture medium ofwere significantly increased after being treated with crude extract for 12-72 h, and the contents of malondialdehyde and hydrogen peroxide inmycelia were significantly increased. Catalase activity and the contents of soluble protein and reducing sugar in the mycelia ofwere significantly decreased within 12 to 72 h after the crude extract treatment, but the activities of superoxide dismutase, peroxidase, polygalacturonase and-glucosidase were significantly decreased only for a certain time.【Conclusion】In the treatment range set in this experiment, the inhibition effect of the crude extract ofwheat straw fermentation is not affected by the light and storage time, but the heat treatment of more than 70 ℃ and the pH treatment of 1-5 and 9-13 significantly reduce the inhibition effect of the crude extract against. In addition, the crude extract inhibitsby changing the morphology of mycelia, damaging cell walls and membranes, causing intracellular material leakage, reducing the contents of protein and reducing sugar in mycelia, inhibiting the activity of antioxidant enzymes, interfering the metabolism of reactive oxygen species and causing a large accumulation of reactive oxygen species.
;; inhibition rate; inhibition mechanism; inhibitory stability

10.3864/j.issn.0578-1752.2024.03.006
2023-09-24;
2023-10-25
国家自然科学基金(31760161)、江西省自然科学基金(20202BABL203048)
廖宏娟,E-mail:1774149530@qq.com。通信作者江玉梅,E-mail:leaf91626@163.com。通信作者朱笃,E-mail:zhudu12@163.com
(责任编辑 岳梅)
