地诺孕素治疗子宫腺肌病有效性与安全性Meta分析
2024-03-04王金丹桂涛万贵平
王金丹 桂涛 万贵平






[摘要] 目的 系統评价地诺孕素用于子宫腺肌病(adenomyosis,AM)保守治疗的有效性与安全性。方法 计算机检索中英文数据库自建库至2023年8月相关的随机对照试验。采用偏倚风险评估工具评价文献质量,RevMan 5.4软件进行分析。结果 纳入9篇随机对照试验,共654例AM患者,338例患者接受地诺孕素治疗,用药疗程3~6个月。Meta分析结果显示地诺孕素治疗腺肌病的总有效率(OR=6.70,95%CI:1.84~24.42,P=0.004)、血清糖类抗原125(carbohydrate antigen 125,CA125)降幅(MD=–6.89,95%CI:–12.84~–0.93,P=0.02)、子宫体积(MD=–26.49,95%CI:–37.86~–15.12,P<0.00001)、生活质量调查表评分(MD=6.12,95%CI:4.76~7.47,P<0.00001),均优于未使用地诺孕素者;疼痛改善情况(MD=–0.14,95%CI:–2.19~1.92,P=0.90)、子宫内膜厚度(MD=–0.54,95%CI:–3.66~2.59,P=0.74),差异无统计学意义;总体不良反应发生率(OR=0.51,95%CI:0.12~2.18,P=0.37)、阴道不规则出血发生率(OR=1.98,95%CI:0.25~15.59,P=0.52),差异无统计学意义。结论 地诺孕素可提高AM患者治疗的总有效率,一定程度上缩小子宫体积,缓解主观症状,改善患者的生活质量。
[关键词] 地诺孕素;子宫腺肌病;Meta分析
[中图分类号] R711 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.03.015
Meta analysis of the efficacy and safety of dienogest in the treatment of adenomyosis
WANG Jindan1, GUI Tao2, WAN Guiping1
1.Department of Gynaecology and Obstetrics, Affiliated Hospital of Integrated Traditional Chinese and Western Medicine of Nanjing University of Chinese Medicine, Nanjing 210028, Jiangsu, China; 2.Department of Gynaecology and Obstetrics, Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210029, Jiangsu, China
[Abstract] Objective To evaluate the efficacy and safety of dienogest in the conservative treatment of adenomyosis (AM). Methods The relevant randomized controlled trials were searched by computer from domestic and foreign electronic bibliographic databases to August 2023. Risk of bias tool was used to evaluate the literature quality, and RevMan 5.4 software was used for analysis. Results A total of 654 patients with AM were included in 9 randomized controlled trials. 338 patients received dienogest for 3 to 6 months. Meta-analysis results showed that the total effective rate of dienogest in the treatment of adenomyosis (OR=6.70, 95%CI: 1.84–24.42, P=0.004) and serum carbohydrate antigen 125 (CA125) reduction (MD=–6.89, 95%CI: –12.84–0.93, P=0.02), uterine volume (MD=–26.49, 95%CI: –37.86–15.12, P<0.00001), quality of life questionnaire score (MD=6.12, 95%CI: 4.76–7.47, P<0.00001), the difference was statistically significant. Pain improvement (MD=–0.14, 95%CI: –2.19–1.92, P=0.90), endometrial thickness (MD=–0.54, 95%CI: –3.66–2.59, P=0.74), the difference was not statistically significant. The overall incidence of adverse reactions (OR=0.51, 95%CI: 0.12–2.18, P=0.37) and the incidence of irregular vaginal bleeding (OR=1.98, 95%CI: 0.25–15.59, P=0.52), the difference was not statistically significant. Conclusion Dienogest improves overall response rates, reduces uterine volume in certain degree, relieves subjective symptoms, and improves quality of life in patients with adenomyosis.
[Key words] Dienogest; Adenomyosis; Meta analysis
子宫腺肌病(adenomyosis,AM)是一种具有黏附、侵袭和转移等恶性生物学行为的良性妇科疾病,在育龄期女性群体中的发病率高达20%~30%。临床表现多见异常子宫出血、痛经和不孕,严重降低妇女生活质量[1]。目前暂无统一的保守治疗管理标准,多种性激素类药物可供临床选择,但均有弊端,如常用的促性腺激素释放激素激动剂(gonadotrophin releasing hormone analogue,GnRH-a)停药后存在不同程度的复发现象,仍有大约82%药物治疗失败者或难治者最终进行手术治疗[2]。随着发病年轻化,患者保留生育功能的需求渐增,而统计数据显示局部病灶切除术后的复发率高达32.5%[3]。
地诺孕素(dienogest,DNG)是一种高度特异性结合孕激素受体的新型药物,可抑制排卵发生,抵抗子宫内膜增殖,曾被称为“最强孕激素”[4]。研究发现67%的AM患者在绝经前接受DNG治疗可极大地缓解相关症状,避免手术干预[5]。尤其对于接受短期治疗(3个月)患者的疼痛症状改善最为显著,長期治疗也有效且耐受性良好,DNG还可用作保守手术或GnRH-a治疗后的维持疗法;然而由于随访数据的缺失,导致关于DNG长期疗效的临床证据尚不充足。AM也是一种与免疫系统相关的疾病,自然杀伤(natural killer,NK)细胞占据子宫内膜免疫细胞群的优势地位,其表面激活受体是胚胎植入的必要条件,而在弥漫型腺肌病在位内膜中,具有细胞毒性的CD56阳性NK细胞比例增加,可能导致不良妊娠结局的发生[6-8]。DNG可增加AM在位内膜腺体中成熟NK细胞的数量和活性,通过改变NK细胞亚群分布趋势,有助于停药后患者的妊娠过程[9]。本研究通过Meta分析的方法对DNG用于保守治疗AM的有效性及安全性进行系统评价,旨在为AM保守治疗提供具有可行性的循证医学依据。本研究遵循Prisma报告声明,并已在PROSPERO平台进行注册(注册号:CRD42023453093)。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 ①研究类型:随机对照试验(randomized controlled trial,RCT),语言为中文、英文;②研究对象:参照国内外常用标准,明确诊断AM并使用药物保守治疗的患者;③干预措施:试验组接受地诺孕素治疗,对照组未接受地诺孕素治疗;④结局指标:主要结局指标包括临床有效率、疼痛视觉模拟评分(visual analogue scale,VAS),次要结局指标包括月经量、子宫体积、子宫内膜厚度、血清糖类抗原125(carbohydrate antigen 125,CA125)、雌二醇(estradiol,E2),安全性指标包括不良反应(adverse drug reactions,ADR),文章包含一种主要结局指标即纳入。
1.1.2 排除标准 ①非随机对照试验、队列研究、综述或个案报道等;②无法获取试验的完整数据、重复发表、数据重复的文献或无相关结局指标的文献;③纳入患者疾病诊断不明确,合并其他妇科疾病或其他系统严重疾病。
1.2 信息来源与检索策略
计算机检索中国知识资源总库、万方数据知识服务平台、维普中文科技期刊全文数据库、PubMed、Web of science、Embase、Cochrane Library中关于DNG治疗AM的随机对照试验,同时检索中国临床试验注册中心与Clinical Trials查找已注册的临床试验以获得潜在文献资料。检索时限为建库至2023年8月。检索方法采用主题词结合自由词,其中中文检索词为“地诺孕素”和“子宫腺肌病”“子宫腺肌症”等,英文检索词为“Dienogest”“Adenomyosis”和“Adenomyoses”等,检索式以Pubmed为例:((“Adenomyosis”[Mesh]) OR (adenomyosis[Title/Abstract] OR adenomyoses[Title/Abstract] OR adenomyoma [Title/Abstract])) AND ((“dienogest” [Supplementary Concept]) OR (dienogest[Title/Abstract] OR estradiol valerate-dienogest[Title/Abstract]))。
1.3 研究选择与资料提取
使用Endnote 20软件对获得所有文献进行去重,随后参照纳入与排除标准进行人工筛选。两名研究人员独立完成后比较筛选结果,如遇分歧请第3名研究人员协助。合格文献的资料条目包括作者、年份、国别、样本量、干预措施、随访情况和结局指标。
1.4 偏倚风险评价
使用Cochrane 5.1.0风险偏倚评估工具对纳入随机对照试验(randomized controlled trial,RCT)进行质量评价,包括随机分配方法、分配方案隐藏、盲法评价、结局数据完整性、有无选择性报告研究结果和其他偏倚,逐条作出高偏倚风险、偏倚风险不确定、低偏倚风险的评价。
1.5 效应指标
结局指标中二分类变量采用比值比(odds ratio,OR)作为效应指标,连续性变量采用均数差(mean deviation,MD)作为效应指标,二者均计算95%可信区间(confidence interval,CI),若缺失合并效应量时可进行数据转换。
1.6 数据分析
采用Review Manager 5.4软件检验纳入研究的统计学异质性及程度,并根据异质性检验结果判断研究采用固定效应模型(P>0.10,I2<50%)或随机效应模型(P<0.10,I2≥50%),必要时设置亚组进一步分析。敏感度分析用于评价合并结果的稳定性和可靠性。注意获得研究完整的数据以控制发表偏倚。
2 结果
2.1 文献筛选
根据拟定策略检索后获得中、英文文献共计359篇,经过严格筛选最终纳入9篇RCT。文献筛选流程见图1。
2.2 纳入研究的基本特征与质量评价
纳入9篇RCT包括中文文献7篇[10-16],英文文献2篇[17-18],均提供了人群基线特征,组间具有可比性。2篇[10, 15]将DNG与孕三烯酮(gestrinone)对比,2篇[11, 16]与左炔诺孕酮宫内节育系统(levonorgestrel intrauterine system,LNG-IUS)对比,2篇[12-13]与GnRH-a对比,其余3篇分别与安慰剂(placebo)[17]、地屈孕酮(dydrogesterone)[14]及复方口服避孕药(combined oral contraceptives,COC,含30μg乙炔雌二醇和75μg孕二烯酮)[18]对比。共计纳入654例AM患者,338例接受DNG治疗,用药疗程3~6个月,见表1。
7篇[10-11, 14-18]采用随机数字表法分配,2篇[12-13]未提及产生随机序列的方法。2篇[17-18]采用分配隐藏方案,其余7篇均未提及。1篇[17]提及研究结果评估盲法,其余8篇均未提及。9篇试验均报道了预先设定的结局指标并未发现选择性报道,均未提及其他偏倚。见图2。
2.3 Meta分析结果
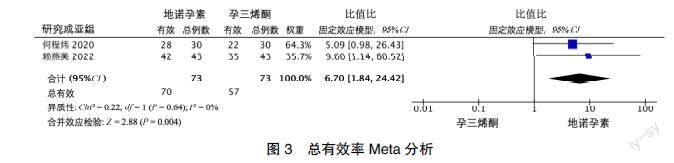
2.3.1 总有效率 5项[10, 12, 14-16]试验报道DNG治疗AM的临床疗效,3项[12, 14, 16]分别使用GnRH-a、LNG-IUS和地屈孕酮作为对照,DNG组总有效率优于对照组,差异有统计学意义(90.00%∶66.70%,P=0.029;96.67%∶70%,P=0.006;95.00%∶70.00%,P=0.037)。另有2项[10, 15]使用孕三烯酮作为对照,评估治疗3个月后的总有效率,组间同质性良好(P=0.64,I2=0%),固定效应模型分析结果显示DNG总有效率优于孕三烯酮,具有统计学意义(OR=6.70,95%CI:1.84~24.42,P=0.004), 见图3。
2.3.2 痛经改善情况 6项[10-11, 13-14, 17-18]试验使用VAS评估患者痛经严重程度,每组间差异有统计学意义(P<0.05),报道中接受DNG治疗的患者235例,接受非DNG治疗的患者213例,2项[10, 14]比较DNG治疗3个月后VAS评分变化,3项[11, 13, 18]比較DNG治疗6个月后VAS评分变化,Osuga等[17]报道使用DNG治疗4个月后VAS较安慰剂组下降(–58.4 ∶–20.6),差异有统计学意义(P<0.001)。各研究间异质性显著(P<0.00001,I2=100%),随机效应模型分析结果显示DNG治疗后VAS评分低于非DNG组,差异有统计学意义(MD=–6.70,95%CI:–10.47~–2.93,P=0.0005)。根据疗程长短分为治疗3个月和6个月两个亚组,每个亚组内统计学异质性高(P=0.01,I2=84%;P<0.00001,I2=99%);随机效应模型分析显示,使用DNG治疗3个月VAS评分低于非DNG组,差异有统计学意义(MD=–1.27,95%CI:–2.13~–0.42,P=0.003);使用DNG治疗6个月VAS评分相较于非DNG组,差异无统计学意义(MD=0.58,95%CI:–2.28~3.44,P=0.69);亚组间合并结果提示两组药物对VAS分数的影响无显著差异(MD=–0.14,95%CI:–2.19~1.92,P=0.90),见图4。
2.3.3 血清CA125水平 3项[10, 15-16]试验报道DNG治疗后AM患者血清CA125水平(IU/ml)变化,唐玉芳[16]在试验中发现DNG组治疗前后的差值显著大于LNG-IUS组(33.52∶27.63,P<0.01)。另2项[10, 15]选择孕三烯酮作为对照,组间异质性明显(P<0.00001,I2=96%),随机效应模型分析结果显示DNG组治疗后血清CA125下降水平较孕三烯酮具有统计学意义(MD=–6.89,95%CI:–12.84~–0.93,P=0.02),见图5。
2.3.4 子宫体积 4项[11, 13, 17-18]试验报道DNG治疗对AM患者子宫体积(cm3)的影响,Osuga等[17]报道DNG治疗4个月后子宫体积缩小范围略大于安慰剂组,差异无统计学意义(20.0∶9.6,P=0.103),故不纳入分析。另3项[11, 13, 18]报道DNG治疗6个月后子宫体积的变化,组间统计学异质性高(P<0.00001,I2=96%),随机效应模型分析结果显示DNG对子宫体积改变无效,差异无统计学意义(MD=–7.33,95%CI:–43.73~29.07,P=0.69);敏感度分析发现区瑾华等[11]的研究是异质性的显著影响因素,剔除该研究后综合其余两项研究结果,采用固定效应模型(P=0.36,I2=0%)分析,结果显示DNG治疗后子宫体积缩小,差异有统计学意义(MD=–26.49,95%CI:–37.86~–15.12,P<0.00001),见图6。
2.3.5 子宫内膜厚度 3项[10, 11, 14]试验报道DNG治疗对AM患者子宫厚度变化的影响,组间具有统计学异质性(P<0.00001,I2=99%),随机效应模型分析结果显示DNG治疗与患者子宫内膜厚度无统计学相关性(MD=–0.54,95%CI:–3.66~2.59,P=0.74),见图7。
2.3.6 生活质量调查表评分 3项[12, 14, 17]试验报道AM患者生活质量评分(MOS 36-item short-form health survey,SF-36),宋屈[12]未报道患者接受药物治疗前的SF-36评分,无法计算治疗前后差值,故不纳入分析。另2项[14, 17]组间统计学异质性稍高(P=0.002,I2=59%),随机效应模型分析结果显示DNG组治疗后患者SF-36评分升高幅度大于非DNG组,尤其对心理健康、社会功能、总体健康与生命力改善较为明显,合并7项评分效应量比较差异有统计学意义(MD=6.12,95%CI:4.76~7.47,P<0.00001),见图8。
2.3.7 血清E2水平 2项[10, 15]试验报道了E2水平,组间统计学异质性过大(P<0.00001,I2=100%),放弃Meta分析。
2.3.8 不良反应 ①总体不良反应:5项[11, 13, 15-16, 18]试验报道AM患者接受药物治疗后的不良反应,包括阴道不规则出血、乳房不适、头晕头痛、潮热盗汗、胃肠道反应、情绪波动等,见表2。Hassanin等[18]和寇洁雯[13]在试验结果不良反应报告中未明确指出发生病例数,故不纳入Meta分析。其余 3项[11, 15-16]试验统计学异质性略高(P=0.12,I2=52%),随机效应模型分析结果显示,两组不良反应发生率差异无统计学意义(OR=0.51,95%CI:0.12~2.18,P=0.37),见图9。②阴道不规则出血发生情况:上述5项试验均报道了阴道不规则出血的发生情况,组间具有统计学异质性(P=0.0004,I2=80%),随机效应模型合并后结果显示,两组阴道不规则出血发生率比较差异无统计学意义(OR=1.98,95%CI:0.25~15.59,P=0.52),见图10。
2.3.9 发表偏倚分析 纳入试验总数或单个指标纳入数量无法支撑发表偏倚分析。
3 讨论
本研究对9项DNG治疗AM的独立试验结果予以合并、定量分析,剖析研究差异,综合评价结果表明相较于其他药物治疗:在有效性方面,DNG可增加临床总有效率,降低血清CA125水平,缩小子宫体积,提高生活质量评分;在安全性方面,与对照组相同,DNG治疗后不良反应发生及阴道不规则出血风险上升。
AM是类似于子宫内膜异位症(endometriosis,EM)的一种雌激素依赖性疾病,DNG营造低雌激素–高孕激素微环境导致子宫内膜组织处于蜕膜化状态;通过發挥抗增殖、抗炎和抗血管生成,使异位植入的内膜和腺体组织萎缩,维持疾病治疗,防止疾病进展。DNG可通过促进细胞凋亡缩减EM病灶的体积[19-20];而Takeuchi等[20]研究发现DNG对AM病灶细胞不具有促凋亡的作用,目前尚无研究揭示DNG治疗后患者子宫体积变化的机制。磁共振成像(magnetic resonance imaging,MRI)作为AM的二线诊断方法,可针对病灶位置进行分型,在指导临床分层治疗及药物疗效评价中十分重要[21]。MRI显示Ⅱ型(病灶浸润在子宫外层)是引起患者子宫体积增大的主要原因[22-23]。本文纳入试验中,仅有Osuga等[17]在纳入标准部分指出将MRI联合经阴道超声用于确诊AM,但也未指出疾病具体分型,这也可能导致研究人员无法证明DNG治疗是否对子宫体积产生影响。有团队比较DNG、GnRHa和COC 3种药物对AM患者子宫体积的影响,结果提示GnRHa(96.2%)在缩减子宫体积方面的有效率明显高于DNG或COC(分别为54.5%和46.7%)[24]。由于本研究纳入的试验多为小样本研究,对子宫体积进行分析时存在潜在的偏倚风险,故该结论仍需更多高质量RCT进行评价验证。此外本研究还存在以下限制:①纳入试验的异质性程度较高,包括疗程、对照治疗药物种类、结局指标检测等;②纳入试验随访情况不乐观,无法展开统计分析评价DNG干预后的远期疗效。
综上,地诺孕素可提高AM患者治疗的总有效率,一定程度上缩小子宫体积、缓解主观症状、改善患者的生活质量,但在长期用药疗效及安全性方面仍需大量研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BOURDON M S P, MARCELLIN L, et al. Adenomyosis: An update regarding its diagnosis and clinical features[J]. J Gynecol Obstet Hum Reprod, 2021, 50(10): 102228.
[2] STRATOPOULOU C A, DONNEZ D J, DOLMANS M M. Conservative management of uterine adenomyosis: Medical vs. surgical approach[J]. J Clin Med, 2021, 10(21): 4878.
[3] YOUNES G, TOGAS T. Conservative surgery for adenomyosis and results: A systematic review[J]. Minim Invasive Gynecol, 2018, 25(2): 265–276.
[4] FOSTER RH, MI W. Dienogest[J]. Drugs, 1998, 56(5): 825–833.
[5] NERIISHI ;K, TETSUYA H, SHINYA F, et al. Long-term dienogest administration in patients with symptomatic adenomyosis[J]. Obstet Gynaecol Res, 2018, 44(8): 1439–1444.
[6] BOURDON M, SANTULLI P, JELJELI M, et al. Immunological changes associated with adenomyosis: A systematic review[J]. Hum Reprod Update, 2021, 27(1): 108–129.
[7] TREMELLEN KP, PETER R. The distribution of immune cells and macrophages in the endometrium of women with recurrent reproductive failure. Ⅱ: Adenomyosis and macrophages[J]. J Reprod Immunol, 2012, 93(1): 58–63.
[8] FUKUI A, FUJII S, YAMAGUCHI E, et al. Natural killer cell subpopulations and cytotoxicity for infertile patients undergoing in vitro fertilization[J]. Am J Reprod Immunol, 1999, 41(6): 413–422.
[9] PRATHOOMTHONG S, YADA T, LERTVIKOOL S, et al. The effects of dienogest on macrophage and natural killer cells in adenomyosis: A randomized controlled study[J]. Int J Fertil Steril, 2018, 11(4): 279–286.
[10] 何程炜, 石彩歌, 戴红, 等. 地诺孕素治疗子宫腺肌症患者的疗效及对血清肿瘤标志物CA125的影响[J]. 现代诊断与治疗, 2020, 31(3): 364–366.
[11] 区瑾华, 麦小珊, 胡道琴, 等. 地诺孕素、左炔诺孕酮宫内节育系统治疗子宫腺肌病的临床对比研究[J]. 中外医疗, 2021, 40(29): 117–120.
[12] 宋屈. 地诺孕素针对子宫腺肌症的疗效评估[J]. 医药卫生, 2022(8): 38–40.
[13] 寇洁雯. 地诺孕素用于治疗子宫腺肌病的临床疗效分析[D]. 银川: 宁夏医科大学, 2022.
[14] 董秀华. 地诺孕素治疗子宫腺肌症的临床效果[J]. 临床合理用药杂志, 2022, 15(32): 117–120.
[15] 赖燕英. 地诺孕素治疗子宫腺肌病患者的效果及对性激素、血清CA125水平的影响[J]. 中国医学创新, 2022, 19(34): 143–146.
[16] 唐玉芳. 地诺孕素片对子宫腺肌病患者的疗效及血清CA125、神经生长因子及前列腺素F-2α受体水平的影响[J]. 养生保健指南, 2023(8): 236–238.
[17] OSUGA Y, HARUKA F O, ATSUSHI H. Evaluation of the efficacy and safety of dienogest in the treatment of painful symptoms in patients with adenomyosis: A randomized, double-blind, multicenter, placebo-controlled study[J]. Fertil Steril, 2017, 108(4): 673–678.
[18] HASSANIN A I, AHMED A Y, ASMAA M Y, et al. Comparison of dienogest versus combined oral contraceptive pills in the treatment of women with adenomyosis: A randomized clinical trial[J]. Int J Gynaecol Obstet, 2021, 154(2): 263–269.
[19] 沈洁洁. 地诺孕素治疗复发型卵巢子宫内膜异位症对患者异位囊肿体积与疼痛的影响[J/OL]. 现代医学与健康研究电子杂志, 2022, 6(22): 74–76.
[20] TAKEUCHI A, KAORI K, MARIKO M, et al. Dienogest reduces proliferation, NGF expression and nerve fiber density in human adenomyosis[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 207: 157–161.
[21] CHAPRON C, SILVIA V, PIETRO S, et al. Diagnosing adenomyosis: An integrated clinical and imaging approach[J]. Hum Reprod Update, 2020, 26(3): 392–411.
[22] 张信美. 子宫腺肌病临床表现及其分型[J]. 中国实用婦科与产科杂志, 2019, 35(5): 498–501.
[23] CELLI V, MIRIAM D, ROBERTA N, et al. MRI and adenomyosis: What can radiologists evaluate[J]. Int J Environ Res Public Health, 2022, 19(10): 5840.
[24] MATSUSHIMA T, SHIGEO A, TAKEHIKO F, et al. Efficacy of hormonal therapies for decreasing uterine volume in patients with adenomyosis[J]. Gynecol Minim Invasive Ther, 2018, 7(3): 119–123.
(收稿日期:2023–08–28)
(修回日期:2024–01–09)
