LncRNA CDC6通过抑制c-Myc表达调节肺癌细胞增殖、凋亡和上皮间质转化
2024-03-02张燕张红蕊孟丹丹弋振营李宁徐志巧
张燕 张红蕊 孟丹丹 弋振营 李宁 徐志巧
肺癌是全球癌症相关死亡的主要原因之一,其中临床检测到的肺癌患者中81%的人群生存期少于5年[1, 2]。由于疾病早期阶段通常无症状,大多数病例是在晚期被诊断出来的[3]。目前,手术和化疗药物是治疗肺癌的主要手段,但许多患者由于治疗效果不佳和诊断晚期而在短时间内复发和死亡[4]。LncRNA主要在细胞核中具有活性,参与蛋白质功能的转录、翻译和调节。此外,许多LncRNA被发现在癌症中异常表现,并在促进肿瘤发生中起关键作用[5, 6]。LncRNA CDC6被报道在乳腺癌中表达上调,沉默LncRNA CDC6抑制乳腺癌的增殖和转移[7]。然而,LncRNA CDC6是否在肺癌发生与发展中发挥作用尚不清楚。Myc原癌基因作为癌症治疗的潜在靶点近年来被深入研究[8]。c-Myc异常表达是癌变过程中较早出现的分子改变,与肿瘤的启动及癌性增生密切相关[9, 10]。已有研究表明,在胃癌、结肠癌、卵巢癌和子宫内膜癌等多种肿瘤中c-Myc均过度表达[8, 10]。此外,c-Myc在肺癌中显著高表达,被认为是肺癌发生的一个关键的癌基因[11, 12]。在本研究中,我们检测了肺癌中CDC6和c-Myc的表达,并分析其与患者临床指标的相关性。此外,通过CDC6和c-Myc的过表达载体或siRNA转染肺癌细胞,观察其对肺癌细胞增殖、凋亡等生物学行为的影响。探究LncRNA CDC6和c-Myc在肺癌发生过程中的作用,并探究其具体的作用机制。
资料与方法
一、实验主要材料
人正常肺上皮细胞BEAS-2B,人肺腺癌细胞SPC-A-1和人非小细胞肺癌细胞系A549、H1650购自中国科学院ATCC细胞库;RPMI 1640 培养基以及DMEM培养液购自美国Gibco公司;MTT细胞检测试剂盒购自上海碧云天生物有限公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自北京索莱宝科技有限公司;pcDNA-CDC6、CDC6-siRNA和pcDNA-c-Myc购自Takara公司;LipofectamineTM2000试剂盒、TRIzol试剂均购自Invitrogen;PrimeScript RT-PCR试剂盒购自Takara公司;SYBR Green试剂盒购自Takara公司;BCA蛋白含量测定试剂盒购自美国Thermo Scientific 公司;Cyclin D1、Survivin、N cadherin、E cadherin、Bcl-2、Bax、c-Myc抗体购自美国Abcam 公司。
实时荧光定量PCR仪购自德国Eppendorf公司;Thermo VarioskanTMLUX多功能酶标仪购自美国的Thermo Fisher Scientific公司;倒置普通光学显微镜购自日本 OLYMPUS公司;免疫印记系统购自美国BioRad公司;凝胶成像分析系统购自Bio-Imaging Systems公司。
二、方法
1. 临床标本收集
选取2018年1月至2020年1月在开封市中心医院肿瘤诊疗中心收住的40例行肺癌根治术的手术患者,其中男性27例,女性13例,年龄31-71岁,平均年龄59岁;取肺癌及癌旁组织标本,且癌旁组织距离肿瘤组织边缘在5 cm以上。样本收集后放置于冻存管,置于-80℃超低温冰箱中保存。本研究已经获得开封市中心医院伦理委员会批准(HKF-H-17136),所有患者及其家属同意并已签署知情同意书。
2. 细胞培养与转染
BEAS-2B、SPC-A-1、A549、H1650细胞用RPMI-1640培养基(含 10% 胎牛血清,1% 青链霉素)在37℃,5% CO2恒温培养箱中培养,每隔2~3天换一次培养液。待细胞融合到80%用胰酶进行消化,之后进行传代培养。
选取对数生长期的A549细胞,以1×105个/孔接种到96孔板中,当细胞生长至70%左右后进行转染。实验一:将细胞分为NC-siRNA组、CDC6-siRNA组、Vector组和pcDNA-CDC6组,按照LipofectamineTM2000试剂盒说明书分别用NC-siRNA、CDC6-siRNA、空载体(Vector)、pcDNA-CDC6转染细胞48 h。接下来将细胞置于37℃孵育24 h,以备后续实验。实验二:将细胞分为NC-siRNA组、CDC6-siRNA组和CDC6-siRNA+pcDNA-c-Myc组,按照LipofectamineTM2000试剂盒说明书分别用NC-siRNA、CDC6-siRNA转染细胞,或用CDC6-siRNA和pcDNA-c-Myc共转染细胞48 h。接下来将细胞置于37℃孵育24 h,以备后续实验。
3. RT-qPCR分析
使用Trizol提取组织或细胞的总RNA,使用分光光度计测定提取的RNA浓度及纯度,若A260 nm/A280 nm处于1.8~2.0范围,可进行后续实验。随后使用PrimeScript RT-PCR试剂盒将RNA逆转录为cDNA。以cDNA为模板,使用SYBR Green进行PCR扩增。反应条件为95℃预变性3 min,之后在95℃变性30 s,58℃ 退火30 s,72℃延伸30 s,进行35个循环;接下来,72℃保温10 min。GAPDH作为内参,采用2-ΔΔCt计算基因的相对表达水平。引物序列如下:LncRNA CDC6 F:5′‐CTC TGA AAT GAA CAC TAC CCA C‐3′,R: 5′-CCA TCA GCC TTC GGA CA-3′;c-Myc F:5′-AAT GAA AAG GCC CCC AAG GTA GTT ATC C-3′,R:5′-GTC GTT TCC GCA ACA AGT CCT CTT C-3′;GAPDH F: 5′-GTC TCC TCT GAC TTC AAC AGC G-3′,R: 5′-ACC ACC CTG TTG CTG TAG CCA A-3′。
4. Western Blotting分析
用RIPA裂解液提取组织和细胞中的总蛋白,BCA试剂盒测定蛋白浓度。将蛋白样品在SDS-PAGE胶中分离后转移至PVDF膜。接下来,用5%脱脂牛奶室温封闭1 h,加入一抗4 ℃孵育过夜。膜洗涤后,加入二抗室温孵育1 h,TBST洗涤。最后,采用ECL试剂盒使条带可视化,使用Image J软件进行灰度值分析。
5. MTT法检测细胞增殖
将浓度为2×104个/mL的细胞以每孔200 μL接种于96孔板,在37℃、5% CO2的培养箱中培养。分别于铺管后24、48、72 h,每孔加入5 mg/mL MTT溶液20 μL,继续培养4 h,离心,吸弃孔内培养基上清液,若有悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加入100 μL DMSO。低速摇晃10 min,使晶体充分溶解。用分光光度计在490 nm处测定各孔的吸光度。
6. 流式细胞术检测细胞凋亡
用1×Binding Buffer缓冲液制备1×106个/mL的悬液。在Falcon试管中吸取100 μL的细胞悬液,加入凋亡试剂盒中Annexin V和PI使之充分混合,在室温避光处孵育15 min。随后在每个试管中分别加入400 μL 1×Binding Buffer缓冲液。混匀后在1 h内使用流式细胞仪进行检测。
三、统计学分析

结 果
一、CDC6和c-Myc在肺癌组织和细胞中的表达
与癌旁组织相比,CDC6在肺癌组织中的表达显著升高(P<0.01)(见图1A)。与人正常肺上皮细胞BEAS-2B相比,肺癌细胞系SPC-A-1、A549、H1650中LncRNA CDC6的表达均显著升高(P<0.05),其中在A549细胞中表达最高(见图1B)。此外,CDC6和c-Myc mRNA在鳞癌中的表达均高于腺癌;在TNM Ⅲ-Ⅳ 期的表达均高于Ⅰ-Ⅱ 期;肺癌分化程度越高,CDC6和c-Myc mRNA的表达水平越高,有淋巴结转移者CDC6和c-Myc mRNA的表达较无淋巴结转移者升高,差异有统计学意义(P<0.05)。CDC6和c-Myc mRNA的表达与性别、年龄和吸烟史没有明显的关系(P>0.05)(见表1)。

表1 肺癌患者CDC6和c-Myc的表达水平与临床特征的关系[n(%)]

图1 CDC6在肺癌组织和细胞中的表达
二、沉默或过表达CDC6对肺癌细胞增殖和EMT的影响
与NC-siRNA组相比,CDC6-siRNA组的CDC6水平显著降低(P<0.05);与Vector组相比,pcDNA-CDC6组的CDC6水平显著升高(P<0.05)(见图2A)。沉默CDC6抑制肺癌细胞增殖,而过表达CDC6显著促进细胞增殖(P<0.05)(见图2B)。CDC6-siRNA组的Cyclin D1、Survivin和N cadherin较NC-siRNA组均显著降低,而E cadherin蛋白的水平显著升高;pcDNA-CDC6组的Cyclin D1、Survivin和N cadherin蛋白的水平较Vector组均显著升高,而E cadherin蛋白水平显著降低(P<0.05)(见图2C,D)。

图2 沉默和过表达CDC6对A549细胞增殖和EMT的影响
三、沉默或过表达CDC6对肺癌细胞凋亡的影响
与NC-siRNA组相比,CDC6-siRNA组的细胞凋亡率显著升高,与Vector组比较,pcDNA-CDC6组的细胞凋亡率显著降低(P<0.05)(见图3A,B)。此外,与NC-siRNA组比较,CDC6-siRNA组的促凋亡蛋白Bax水平显著升高,抗凋亡蛋白Bcl-2水平降低(P<0.05);与Vector组比较,pcDNA-CDC6组的Bax蛋白水平降低, Bcl-2蛋白水平升高(P<0.05)(见图3C,D)。
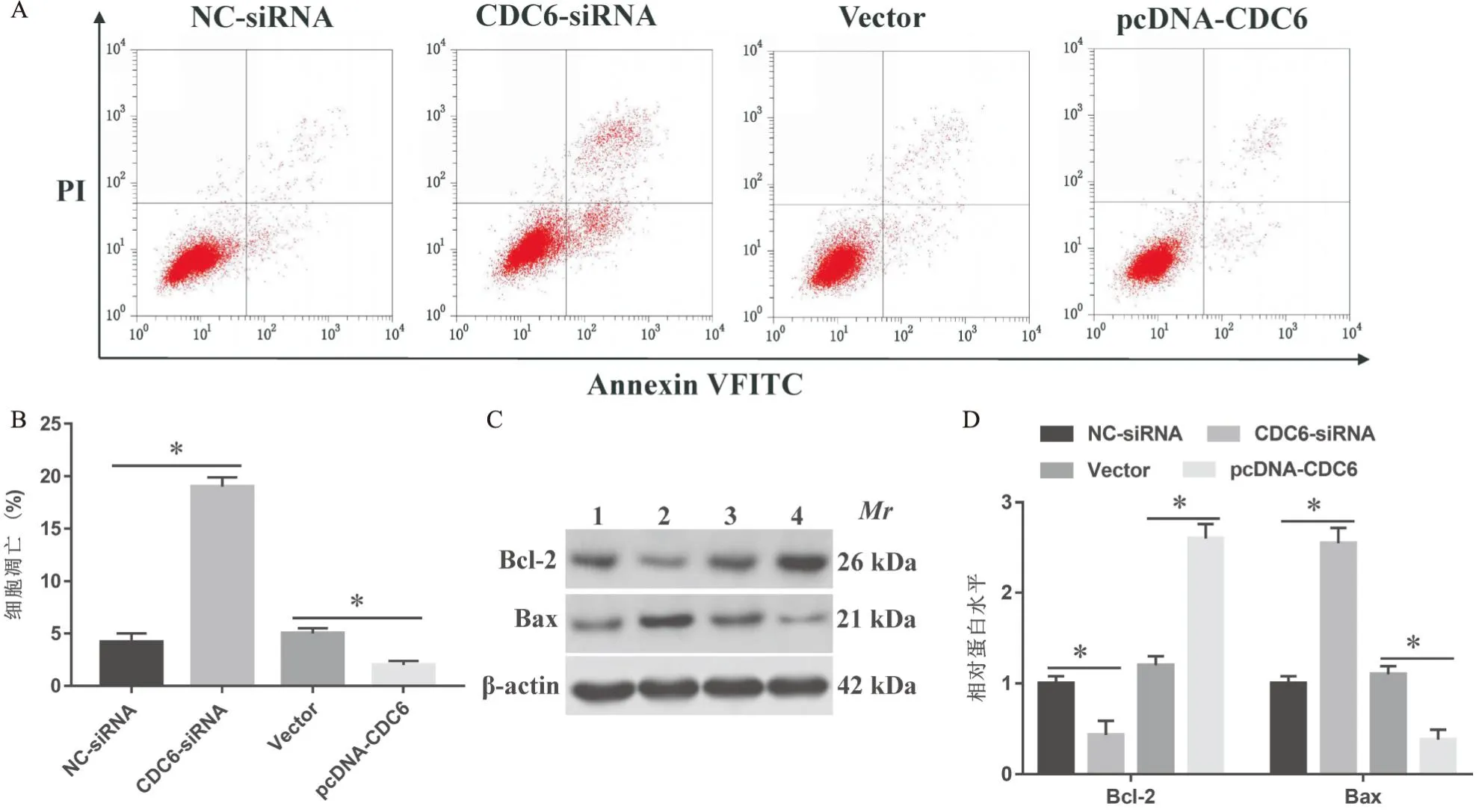
图3 沉默和过表达LncRNA CDC6对肺癌细胞A549凋亡的影响
四、CDC6通过调控c-Myc影响肺癌细胞增殖和EMT
与NC-siRNA组比较,CDC6-siRNA组肺癌细胞中c-Myc mRNA表达降低(P<0.05);与Vector组比较,pcDNA-CDC6组肺癌细胞中c-Myc mRNA表达水平显著升高(P<0.05)(见图4A)。此外,与CDC6-siRNA组相比,过表达c-Myc显著增加了c-Myc mRNA的表达水平(P<0.05)(见图4B)。与CDC6-siRNA组相比,CDC6-siRNA和pcDNA-c-Myc共转染组细胞的增殖能力显著增强(P<0.05)(见图4C)。与CDC6-siRNA组相比,CDC6-siRNA和pcDNA-c-Myc共转染的肺癌细胞中增殖相关蛋白Cyclin D1、Survivin以及N cadherin蛋白的水平明显升高,E cadherin蛋白水平明显降低(P<0.05)(见图4D,E)。 以上的实验结果表明c-Myc的过表达抵消了CDC6沉默对细胞增殖和EMT过程的影响。

图4 LncRNA CDC6沉默通过调控c-Myc影响A549细胞增殖和EMT
五、CDC6通过调控c-Myc影响肺癌的凋亡
与CDC6-siRNA组比较,CDC6-siRNA和pcDNA-c-Myc共转染的肺癌细胞凋亡率降低,促凋亡蛋白Bax水平降低,抗凋亡蛋白Bcl-2水平升高(P<0.05)(见图5A-D)。

图5 CDC6沉默通过调控c-Myc影响A549细胞凋亡
讨 论
已有越来越多的研究证实LncRNA在多种肿瘤类型中异常表达,在肿瘤诊断、监测、预后或治疗方面具有应用前景[6]。到目前为止,在肺癌的研究中发现了大量的LncRNA,为探索肺癌发病的分子途径提供了新的视角[13-15]。LncRNA CDC6是一种新发现的LncRNA,CDC6负责复制起始阶段MCM蛋白的加载,是DNA复制的重要调节因子[16]。有研究表明LncRNA CDC6在乳腺癌组织中高表达,并通过LncRNA CDC6/miR-251/CDC6轴调控乳腺癌的增殖和转移[17]。在本研究中,我们发现LncRNA CDC6在肺癌组织和细胞中显著上调,并且在肺癌患者中CDC6表达与肺癌的病理分型、TNM分期、分化程度以及淋巴结转移具有显著的相关性。因此,我们推测LncRNA CDC6的过表达可能参与了肺癌的恶性行为。为了验证我们的假设,我们首先敲除LncRNA CDC6并检测其对肺癌细胞增殖、EMT和细胞凋亡的影响。结果显示敲除LncRNA CDC6导致肺癌细胞系A549增殖能力下降,增殖相关蛋白Cyclin D1和Survivin水平降低,猜测这可能是由于细胞周期G1期阻滞所致。EMT的一个重要分子特征是E cadherin 蛋白的下调。在我们的研究中发现,敲除LncRNA CDC6后的肺癌细胞EMT相关蛋白E cadherin的表达显著上调,而N cadherin蛋白的表达下调。与此同时,发现敲除LncRNA CDC6促进肺癌细胞系A549的凋亡。为了进一步评估LncRNA CDC6的功能,我们采用CDC6的过表达载体转染肺癌细胞,功能实验显示过表达LncRNA CDC6时E cadherin 蛋白下调,N cadherin蛋白上调,同时促进了A549细胞的增殖及增殖相关因子表达,抑制凋亡及促凋亡相关蛋白表达。因此,我们确定LncRNA CDC6可能是促进肺癌增殖及EMT过程的关键调节因子。
c-Myc是一种人类致癌基因,与多种癌症特征有关[8]。早期研究发现,c-Myc作为一种转录因子,参与代谢、细胞生长、细胞周期调控、细胞凋亡等多种生物学过程[18, 19]。此外,c-Myc表达失调导致双链断裂(DSBs)、DDR的产生,从而促进基因组不稳定性[20, 21]。在本研究中我们发现c-Myc的表达与肺癌组织的病理分型、TNM分期、分化程度以及淋巴结转移密切相关,因此我们进一步研究了CDC6与c-Myc对肺癌调控的关系。有研究发现c-Myc直接刺激DNA复制的不同机制,不依赖于其转录靶点[20]。CDC6过表达可能增加复制效率和c-Myc基因表达。最近的研究表明CDC6与c-Myc复制起始点结合,并且结合增强了c-Myc复制起始点的活性[22]。在我们的研究中发现过表达CDC6时c-Myc的表达上调,这一现象可能与以上的研究机制有关。此外,有研究表明CDC6与c-Myc相互作用,通过干扰c-Myc/Max复合物的形成抑制E-box依赖性转录;它通过抑制编码E cadherin的INK4/ARF和CDH1位点来发挥其致癌活性[22]。但在肺癌模型中,CDC6是否通过调控c-Myc诱发EMT以及是否影响肿瘤的增殖与凋亡尚不清楚。因此我们推测CDC6是通过调控c-Myc影响肺癌的进展,为了验证这个假设,我们将CDC6-siRNA和pcDNA-c-Myc共转染到肺癌细胞A549中,检测EMT相关蛋白表达,以及细胞增殖、凋亡的能力,结果c-Myc过表达抵消了CDC6沉默对A549细胞增殖、凋亡,以及E cadherin、N cadherin表达的影响,这些结果提示CDC6是通过调控c-Myc在肺癌EMT、增殖和凋亡等过程中发挥重要作用。
综上所述,本研究发现LncRNA CDC6在肺癌组织和细胞中高表达,并且LncRNA CDC6通过c-Myc来调控肺癌的进展。这些结果提示LncRNA CDC6可能是肺癌发生与进展中有价值的诊断和预后新靶点。
