区域选择性O-烯丙基取代反应合成2-吡啶酮衍生物
2024-03-02赵盟林袁明伟袁明龙
李 璐,赵盟林,李 娜,袁明伟,袁明龙,蒋 琳
(云南民族大学 生物基材料绿色制备技术国家地方联合工程研究中心,化学与环境学院,云南 昆明 650504)
3-羟基-2-吡啶酮(1,R1=H)是一种具有部分芳香性的多官能团合成子,有机合成中常作为共轭二烯与多种亲双烯体通过DA 反应构建复杂桥环分子骨架[1-3](图1,反应式1).此外,有文献报道了3-羟基-2-吡啶酮的插烯Michael 加成[4](图1,反应式2)或是Mannich 反应[5](图1,反应式3).这些具有2-吡啶酮片段的反应产物是精细化工、药物合成中重要的中间体或活性分子[6-7].目前,文献报道的3-羟基-2-吡啶酮的反应集中在二烯结构单元或C4 位,而涉及C3 位上羟基的成键反应却鲜见报道.
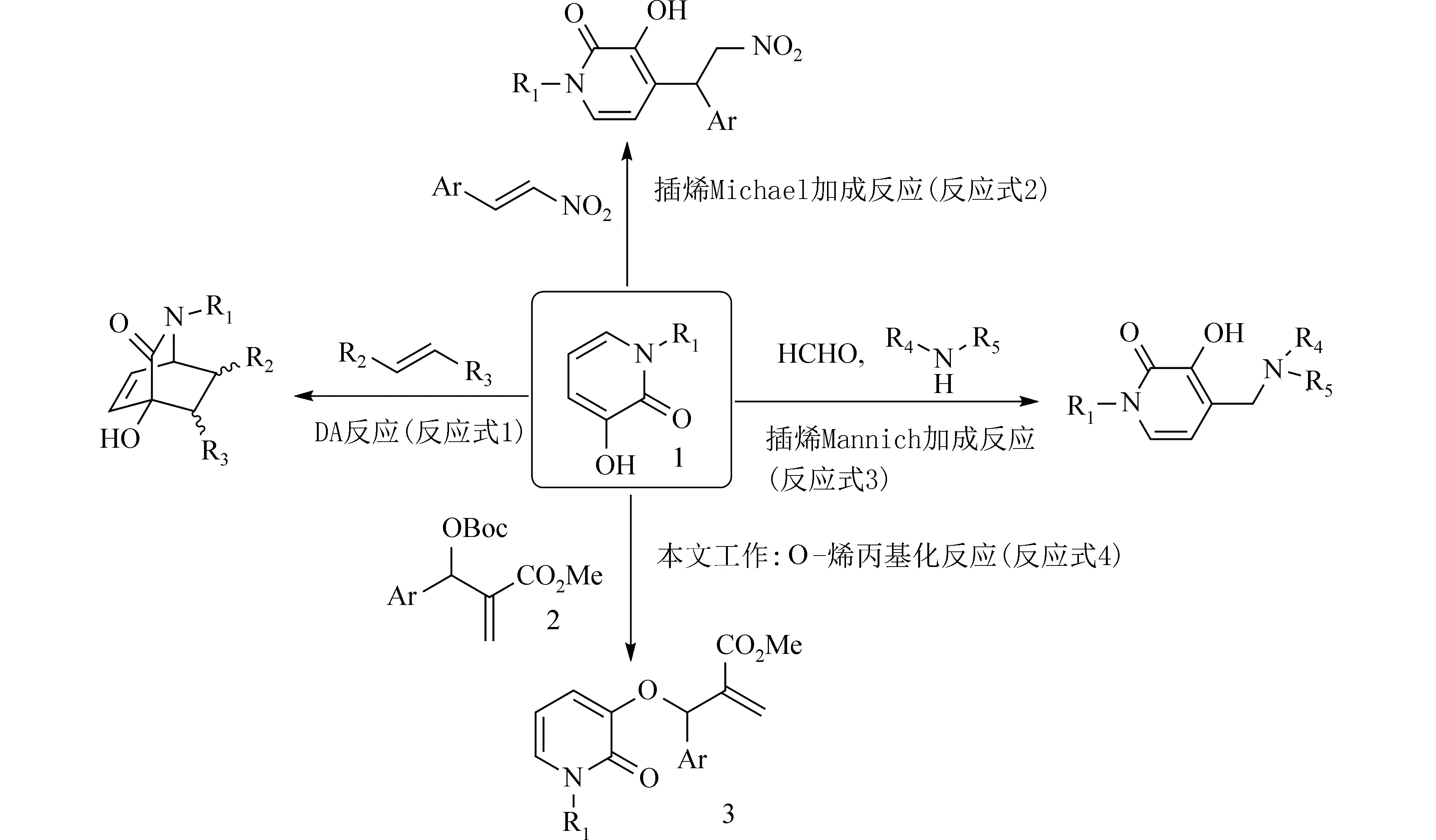
图1 3-羟基-2-吡啶酮的化学转化Fig.1 Chemical transformation of 3-hydroxy-2-pyridones
近年来,MBH 碳酸酯作为多功能合成子的化学转化一直是有机合成的研究热点之一[8].为进一步探索3-羟基-2-吡啶酮的更多化学转化,我们以N-取代的3-羟基-2-吡啶酮1(1,R1≠ H)和醛衍生的MBH 碳酸酯2为底物,在亲核性有机碱催化下,经过区域选择性的O-烯丙基取代反应,合成了一系列含有2-吡啶酮片段的多官能团化产物3,合成路线如图1 中反应式4 所示.
1 实验部分
1.1 仪器与试剂WRX-4 显微熔点仪(上海光学仪器六厂),Nicolet iS10 红外光谱仪(美国Thermo Fisher 公司),BRUKER AV Ⅲ-400 核磁共振仪 (德国BRUKER 公司),LTQ-Orbitrap XL 高分辨质谱仪(美国Thermo Fisher Scientific 公司).
合成N-取代的3-羟基-2-吡啶酮1所需的2,3-二羟基吡啶,叔丁基二甲基氯硅烷,对硝基苯磺酰氯等试剂;合成MBH 碳酸酯2所需芳香醛,丙烯酸甲酯,二碳酸二叔丁酯等试剂;三乙烯二胺(DABCO)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)、N,N-二甲氨基吡啶(DMAP)等催化剂.以上试剂均为市售分析纯,购买自上海泰坦、阿拉丁等生化科技股份有限公司.N-取代的3-羟基-2-吡啶酮和MBH 碳酸酯参照文献[9-10]报道的方法合成.
1.2 O-烯丙基取代产物3 的合成将N-取代的3-羟基-2-吡啶酮1(0.1 mmol)和MBH 碳酸酯2(0.2 mmol)用二氯乙烷 (DCE,2 mL)溶解,加入DABCO (3.4 mg,0.03 mmol),25 ℃反应24 h,柱层析分离提纯 [展开剂:V(石油醚)∶V(乙酸乙酯)=10∶1]得目标产物3.
2-{[(1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基)氧基](苯基)甲基}丙烯酸甲酯(3aa) 白色固体,产率91%,熔点166~168 ℃;1H NMR (400 MHz,CDCl3)δ: 8.30 (d,J=8.0 Hz,2H),8.18 (d,J=8.0 Hz,2H),7.52 (d,J=8.0 Hz,1H),7.37(m,3H),7.15 (d,J=8.0 Hz,1H),7.07 (m,2H),6.90(s,1H),6.55 (s,1H),6.19~6.15 (m,1H),5.30 (s,1H),3.69 (s,3H);13C NMR (100 MHz,CDCl3)δ: 165.1,156.5,150.9,141.5,139.0,138.7,135.5,134.4,132.3,130.2,129.9,129.2,128.8,128.3,123.9,103.6,59.8,52.3;IR(KBr)ν/cm-1: 3 319,1 658,1 625,1 533,1 404,1 350,1 238,1 187,1 109,858,742,616;HRMS (ESI,m/z): C22H18N2O8S+Na [M+Na]+,计算值493.068 2,实测值493.069 0.
2-{[(2-氧代-1-甲苯磺酰基-1,2-二氢吡啶-3-基)氧基](苯基)甲基}丙烯酸甲酯(3ba) 白色固体,产率52%,熔点169~170 ℃;1H NMR (400 MHz,CDCl3)δ:7.81 (d,J=8.0 Hz,2H),7.39 (d,J=8.0 Hz,1H),7.30 (m,3H),7.21 (d,J=8.0 Hz,2H),7.05 (m,2H),6.92~6.89 (m,2H),6.47 (s,1H),6.06~6.01 (m,1H),5.17 (s,1H),3.62 (s,3H),2.35 (s,3H);13C NMR (100 MHz,CDCl3)δ: 165.2,155.1,145.2,139.0,138.2,134.3,131.8,131.2,129.1,128.3,127.9,127.6,127.5,127.5,127.3,102.4,58.4,51.2,20.5;IR(KBr)ν/cm-1: 3 434,1 676,1 612,1 377,1 173,1 088,765,716,556.HRMS (ESI,m/z): C23H21NO6S+Na [M+Na]+,计算值462.098 7,实测值462.097 9.
(E)-2-{[(1-甲基-2-氧代-1,2-二氢吡啶-3-基)氧基]甲基}-3-苯基丙烯酸酯(3ca) 无色液体,产率47%;1H NMR (400 MHz,CDCl3)δ:7.47 (d,J=8.0 Hz,2H),7.28~7.27 (m,3H),6.90 (d,J=8.0 Hz,1H),6.66 (d,J=8.0 Hz,1H),6.44 (s,1H),6.20 (s,2H),5.96~5.91 (m,1H),3.72 (s,3H),3.54 (s,3H);13C NMR (100 MHz,CDCl3)δ: 156.5,150.9,139.0,138.7,135.5,134.4,132.3,130.2,123.9,103.6,59.8,52.3,39.7; IR(KBr)ν/cm-1: 3 433,2 910,1 653,1 603,1 439,1 241,1 066,751,702,570.HRMS (ESI,m/z): C17H17NO4+Na [M+Na]+,计算值322.105 5,实测值322.105 8.
2-{(4-硝基苯基)[(1-(4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ab) 白色固体,产率51%,熔点127~129 ℃;1H NMR (400 MHz,CDCl3)δ: 8.31 (d,J=8.0 Hz,2H),8.19 (d,J=8.0 Hz,2H),7.46 (d,J=8.0 Hz,1H),7.28 (d,J=8.0 Hz,2H),7.08 (d,J=8.0 Hz,1H),6.97 (d,J=8.0 Hz,2H),6.84 (s,1H),6.51 (s,1H),6.15~6.14 (m,1H),5.28 (s,1H),3.64 (s,3H);13C NMR (100 MHz,CDCl3)δ: 165.6,155.5,149.9,146.8,142.5,138.0,138.7,134.6,133.9,131.3,130.2,129.6,128.9,127.8,122.9,102.6,58.8,52.4;IR(KBr)ν/cm-1: 3 422,2 923,1 723,1 667,1 608,1 533,1 350,1 088,858,760,540.HRMS (ESI,m/z): C22H17N3O10S+H [M+H]+,计算值516.071 3,实测值516.071 5.
2-{(4-氯苯基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ac) 白色固体,产率87%,熔点143~145 ℃;1H NMR (400 MHz,CDCl3)δ: 8.31 (d,J=8.0 Hz,2H),8.20 (d,J=8.0 Hz,2H),7.52 (d,J=8.0 Hz,1H),7.34(d,J=8.0 Hz,2H),7.11 (d,J=8.0 Hz,1H),7.03 (d,J=8.0 Hz,2H),6.89 (s,1H),6.56 (s,1H),6.20~6.17(m,1H),5.31 (s,1H),3.70 (s,3H);13C NMR (100 MHz,CDCl3)δ: 167.1,156.5,151.0,142.5,139.3,138.9,135.8,135.4,134.3,131.2,129.8,128.2,128.7,128.9,124.9,104.6,59.6,51.8;IR(KBr)ν/cm-1: 3 427,2 956,1 719,1 659,1 603,1 529,1 373,1 090,1 015,887,792,744,540.HRMS (ESI,m/z):C22H17ClN2O8S+Na [M+Na]+,计算值527.029 2,实测值527.029 6.
2-{[[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基](对甲苯基)甲基}丙烯酸甲酯(3ad) 白色固体,产率67%,熔点146~148 ℃;1H NMR (400 MHz,CDCl3)δ: 8.25 (d,J=8.0 Hz,2H),8.16 (d,J=8.0 Hz,2H),7.52 (d,J=4.0 Hz,1H),7.16~7.12 (m,3H),6.95 (d,J=8.0 Hz,2H),6.85 (s,1H),6.51 (s,1H),6.17~6.13 (m,1H),5.26 (s,1H),3.68 (s,3H),2.35 (s,3H);13C NMR (100 MHz,CDCl3)δ: 166.2,157.6,151.9,142.5,139.5,138.7,136.5,134.9,133.3,131.2,129.8,129.4,128.7,123.7,104.6,59.6,52.3,21.9; IR(KBr)ν/cm-1: 3 433,1 727,1 653,1 601,1 536,1 379,1 088,755,613,536.HRMS (ESI,m/z): C23H20N2O8S+H [M+H]+,计算值485.101 9,实测值485.102 6.
2-{(3-溴苯基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ae) 白色固体,产率88%,熔点160~162 ℃;1H NMR (400 MHz,CDCl3)δ: 8.29 (d,J=8.0 Hz,2H),8.20 (d,J=8.0 Hz,2H),7.54 (d,J=8.0 Hz,1H),7.46(d,J=8.0 Hz,1H),7.23~7.21 (m,1H),7.17~7.13(m,2H),7.01 (d,J=8.0 Hz,1H),6.85 (s,1H),6.59 (s,1H),6.23~6.19 (m,1H),5.34 (s,1H),3.70 (s,3H);13C NMR (100 MHz,CDCl3)δ: 166.1,155.8,151.2,140.9,139.3,138.7,134.5,134.9,131.9,130.8,129.8,129.1,128.9,124.1,102.6,59.8,52.4;IR(KBr)ν/cm-1: 3 418,1 714,1 665,1 608,1 531,1 377,1 350,1 087,795,758,540;HRMS (ESI,m/z):C22H17BrN2O8S+Na [M+Na]+,计算值570.978 7,实测值570.979 5.
2-{[[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基](间甲苯基)甲基}丙烯酸甲酯(3af) 白色固体,产率61%,熔点174~176 ℃;1H NMR (400 MHz,CDCl3)δ: 8.27 (d,J=8.0 Hz,2H),8.15 (d,J=8.0 Hz,2H),7.52 (d,J=8.0 Hz,1H),7.25~7.21 (m,1H),7.15~7.12 (m,2H),6.89~6.83(m,3H),6.53 (s,1H),6.18~6.14 (m,1H),5.27 (s,1H),3.68 (s,3H),2.32 (s,3H);13C NMR (100 MHz,CDCl3)δ: 164.8,155.5,150.5,141.7,139.2,139.3,136.5,135.4,131.7,131.2,130.1,129.6,128.8,128.7,123.6,104.6,59.6,51.7,22.1;IR(KBr)ν/cm-1: 3 421,1 716,1 665,1 607,1 529,1 441,1 376,1 086,797,746,540. HRMS (ESI,m/z): C23H20N2O8S+Na[M+Na]+,计算值507.083 8,实测值507.083 0.
2-{(2-氯苯基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ag) 白色固体,产率81%,熔点176~178 ℃;1H NMR (400 MHz,CDCl3)δ: 8.24 (d,J=8.0 Hz,2H),8.18 (d,J=8.0 Hz,2H),7.54 (d,J=8.0 Hz,1H),7.36(m,3H),7.15 (d,J=8.0 Hz,1H),7.07 (m,2H),6.90(s,1H),6.55 (s,1H),6.20~6.16 (m,1H),5.29 (s,1H),3.68 (s,3H);13C NMR (100 MHz,CDCl3)δ: 167.3,157.4,151.9,142.5,138.9,135.9,135.4,133.3,131.2,129.6,129.2,128.8,128.3,124.9,104.6,56.8,51.2;IR(KBr)ν/cm-1: 3 390,1 663,1 608,1 532,1 067,861,749,544.HRMS (ESI,m/z): C22H17ClN2O8S+Na[M+Na]+,计算值527.029 2,实测值527.029 9.
2-{(3,4-二甲氧基苯基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ah) 白色固体,产率60%,熔点71~72 ℃;1H NMR (400 MHz,CDCl3)δ: 8.21 (d,J=8.0 Hz,2H),8.15 (d,J=8.0 Hz,2H),7.47 (d,J=8.0 Hz,1H),7.37 (m,3H),7.14 (d,J=8.0 Hz,1H),7.07 (m,2H),6.90 (s,1H),6.55 (s,1H),6.19~6.15(m,1H),5.30 (s,1H),3.98 (s,6H),3.69 (s,3H);13C NMR (100 MHz,CDCl3)δ: 163.3,152.5,150.1,140.5,136.6,136.5,132.5,132.4,130.6,130.1,129.2,128.8,128.3,123.6,103.6,58.8,55.8,51.1;IR(KBr)ν/cm-1: 3 399,1 656,1 611,1 532,1 352,1 142,857,742,565.HRMS (ESI,m/z): C24H22N2O10S+Na[M+Na]+,计算值553.089 3,实测值553.089 2.
2-{(3,4-二氯苯基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3ai) 白色固体,产率75%,熔点159~162 ℃;1H NMR (400 MHz,CDCl3)δ: 8.35 (d,J=8.0 Hz,2H),8.24 (d,J=8.0 Hz,2H),7.57 (d,J=8.0 Hz,1H),7.44 (d,J=8.0 Hz,1H),7.15~7.11(m,2H),6.93 (d,J=8.0 Hz,1H),6.86 (s,1H),6.60 (s,1H),6.24~6.20(m,1H),5.36 (s,1H),3.71 (s,3H);13C NMR (100 MHz,CDCl3)δ: 168.2,155.5,151.4,142.8,139.8,138.9,135.7,135.4,134.3,131.2,129.8,129.4,128.9,128.7,123.9,103.6,59.8,52.7;IR(KBr)ν/cm-1: 3 438,1 768,1 632,1 537,1 380,1 081,856,742,656,555.HRMS (ESI,m/z): C22H16Cl2N2O8S+H [M+H]+,计算值539.008 3,实测值539.008 5.
2-{(1-萘基)[1-((4-硝基苯基)磺酰基)-2-氧代-1,2-二氢吡啶-3-基]氧基}丙烯酸甲酯(3aj) 白色固体,产率66%,熔点175~177 ℃;1H NMR (400 MHz,CDCl3)δ: 8.35 (d,J=8.0 Hz,2H),8.25 (d,J=8.0 Hz,2H),7.88 (d,J=8.0 Hz,2H),7.67~7.63 (m,2H),7.53~7.41 (m,4H),7.24 (d,J=8.0 Hz,1H),7.00 (d,J=8.0 Hz,1H),6.56 (s,1H),6.08~6.04 (m,1H),5.18 (s,1H),3.66 (s,3H);13C NMR (100 MHz,CDCl3)δ: 165.2,156.5,150.9,141.6,138.9,138.6,134.5,134.2,132.4,131.7,130.9,130.2,129.0,127.9,127.5,126.6,126.2,124.9,124.0,122.8,103.9,56.5,52.5;IR(KBr)ν/cm-1: 3 423,1 718,1 665,1 606,1 531,1 400,1 349,1 180,1 086,989,820,747,540.HRMS (ESI,m/z): C26H20N2O8S+H[M+H]+,计算值521.101 9,实测值521.101 8.
2 结果与讨论
2.1 反应条件优化O-烯丙基取代反应的条件优化通式见图2,结果见表1.如表1 所示,首先,选取1a(0.1 mmol)和2a(0.15 mmol)为模板底物的投料比,以x=30 %的DABCO 为催化剂,50 ℃下考察反应溶剂的影响,发现DCE 为溶剂时产率相对较高 (序列1~4).接下来以DCE 为溶剂,考察了DBU、DMAP、咪唑3 种常见的亲核性有机碱的催化效果,发现均不及DABCO (序列5~7).以DABCO 为催化剂,当反应温度降低至25 ℃,虽然反应时间延长,但产率不受影响 (序列8).进一步发现,当2a的用量从1.5 倍量增加至2.0 倍量时,室温下反应的产率有较大提升(序列9),进一步降低催化剂用量或调整底物浓度对反应产率均没有提升 (序列10~12).

表1 反应条件的优化aTab.1 Optimization studies

图2 O-烯丙基取代反应条件优化的反应通式Fig.2 General equation of optimizing conditions of O-allylic reaction
此外,还开展了不对称催化合成3aa的研究,考察了氢化奎尼丁(蒽醌-1,4-二基)二醚([DHQD]2AQN)、氢化奎宁-2,5-二苯基-4,6-嘧啶二甲醚([DHQD]2PYR)、氢化奎尼丁1,4-(2,3-二氮杂萘)二醚([DHQD]2PHAL)、奎宁、氢化奎宁对该反应的催化情况,结果见表2.研究发现,在筛选的二相金鸡纳碱催化剂中,[DHQD]2AQN 的产率和对映选择性相对较高 (序列1~3),而以奎宁或氢化奎宁为催化剂时,反应几乎不能发生 (序列4,5).选取[DHQD]2AQN 为催化剂,对溶剂、温度作进一步筛选,发现以DCE 为溶剂,降低反应温度至40 ℃,产率有小幅提升(序列9),而继续降至室温反应时,尽管反应明显变慢,但产率几乎没有变化,同时,对映选择性仍然较低 (序列10).
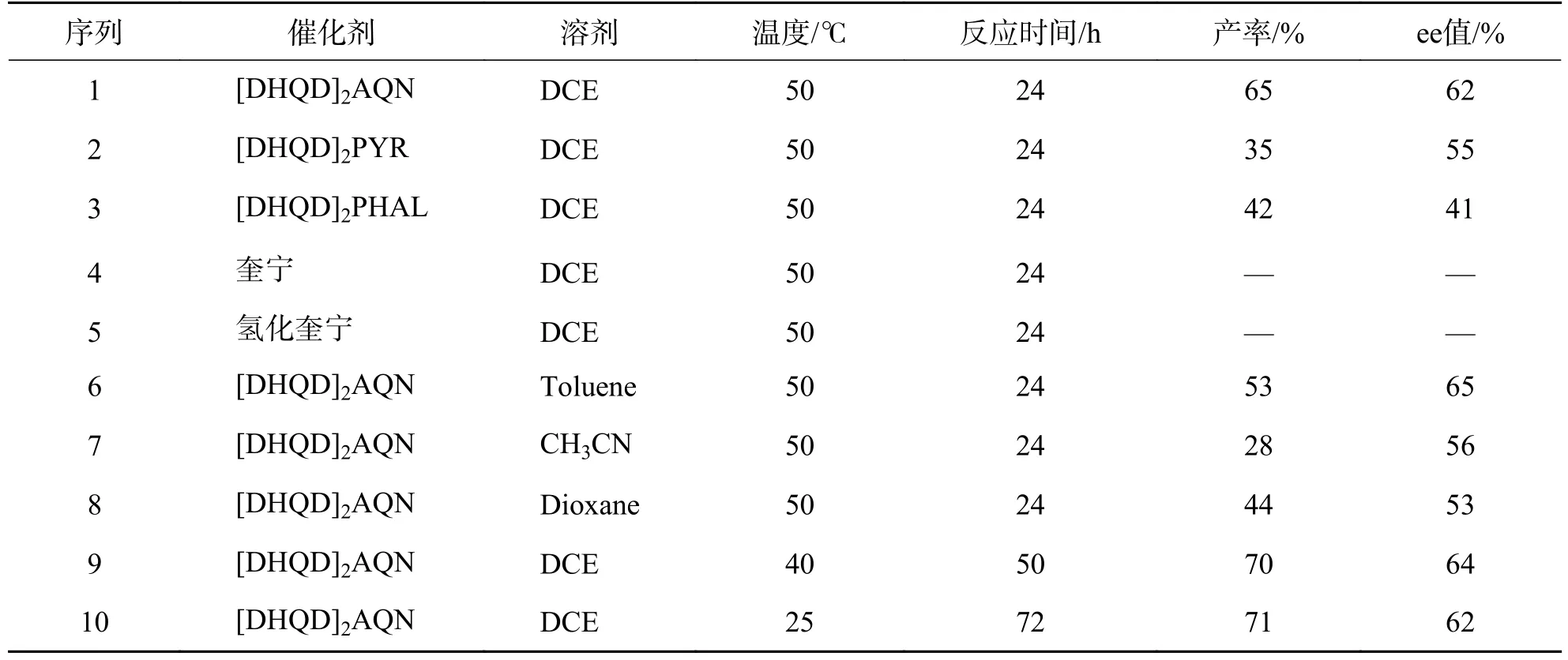
表2 不对称催化的研究aTab.2 Study on asymmetric catalysis
综上所述,建立的反应的最适条件为:1a(0.1 mmol)和2a(0.2 mmol)为原料,x=30 %的DABCO 作催化剂,DCE (2 mL)作溶剂,反应温度为25 ℃.
2.2 底物扩展在优化条件下对底物的适用范围进行探索,反应通式见图3,结果见表3.首先考察了底物1中氮原子上取代基对反应的影响,发现吸电子基Ns 取代的1a的产率明显高于Ts 取代的1b(序列1 和2).当甲基取代的1c参与反应时,得到MBH 碳酸酯双键上加成的产物3ca,推测区域选择性的改变可能与氮上取代基的电性效应和空间位阻影响1的亲核性有关 (序列3).接下来,以1a为底物考察了不同取代基的MBH 碳酸酯的底物范围,在最适条件下获得51%~88%的产率(序列4~12).MBH 碳酸酯苯环上取代基的位置对产率没有明显影响.就取代基的电性效应而言,对比带供电子基团 (如Me、OMe)的底物,吸电子基团(如Cl、Br)取代时能够获得更高的产率.然而NO2取代时的产率并不高,可能与NO2的强吸电子作用导致MBH 碳酸酯活性过高,反应条件下副反应严重有关.

表3 底物扩展Tab.3 Substrate scope
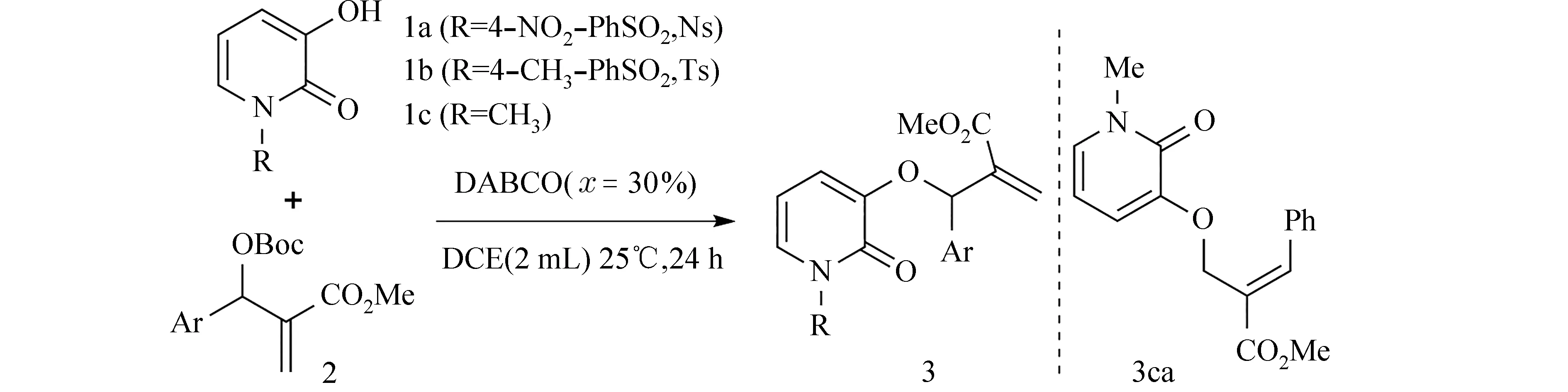
图3 底物扩展的反应通式Fig.3 General equation of substrate scope
2.3 反应机理参照文献报道[11],我们对N-取代的3-羟基-2-吡啶酮1a或1c与MBH 碳酸酯2a的区域选择性O-烯丙基取代反应机理进行了推测.如图4 所示,DABCO 对2a亲核加成生成中间体Ⅰ,并原位释放出强碱性的t-BuO-,后者夺去1中的酸性氢生成氧负离子Ⅱ,当1a参与反应时,中间体Ⅱ与Ⅰ发生SN2’反应,生成γ位取代产物3aa(路径a),而当1c参与反应时,中间体Ⅱ与Ⅰ发生正常的SN2 反应,生成α位取代产物3ca(路径b),并释出催化剂,完成催化循环.
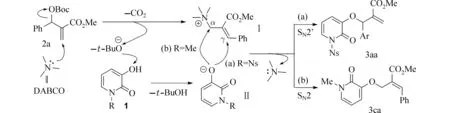
图4 推测的反应机理Fig.4 Proposed reaction mechanism
3 结论
以N-取代的3-羟基-2-吡啶酮衍生物和醛衍生的MBH 碳酸酯为底物,通过DABCO 催化的区域选择性的O-烯丙基取代反应,以51%~91%的产率合成了一系列含有2-吡啶酮片段的多官能团产物.报道的合成方法进一步丰富了3-羟基-2-吡啶酮的化学转化路径,为2-吡啶酮衍生物的活性筛选提供了新的分子结构.
