临界可切除肝癌行肝动脉灌注化疗联合肝动脉栓塞术转化治疗的疗效
2024-03-02郑本波刘航黄文聂佳
郑本波,刘航,黄文,聂佳
(四川省德阳市人民医院 1.普通外科 2.血管介入科 3.病理科,四川 德阳 638000)
方法:收集2019年4月—2022年2月采用FOLFOX方案的HAIC联合TAE转化治疗的22例临界可切除(CNLC分期Ⅱb期)原发性肝癌患者的临床资料,根据改良实体瘤疗效评价(mRECIST)标准评估肿瘤客观缓解率(ORR)、疾病控制率(DCR),分析转化手术切除率和术后标本的病理缓解率以及转化治疗后手术与未手术患者的预后情况。
结果:22例患者均完成HAIC联合TAE治疗,主要不良反应包括上腹痛、低热、短期的肝功能损害等,但没有发生不可逆的严重并发症。转化治疗后,肿瘤ORR、DCR分别为63.6%、86.3%,但有3例(13.6%)患者出现肿瘤进展。转化治疗结束后14例患者行肝癌手术切除,转化手术切除率为63.6%,手术顺利,均能达到R0切除,无术后死亡病例。术后病理检查有10例(71.4%)为主要病理缓解(MPR),但无1例能达到完全病理缓解(CPR)。14例手术患者的无复发生存期平均为14.7个月;手术患者的总生存期明显优于未手术患者(22.7个月vs.13.2个月,P=0.018)。
结论:HAIC联合TAE转化治疗对于临界可切除肝癌具有良好的耐受性,是安全可行的,能取得较高ORR、DCR和转化手术切除率。虽然大多数术前转化治疗后能达到MPR,但CPR较低,手术切除仍是肝癌转化治疗后患者获得长期生存的关键。
外科手术切除仍是大多数原发性肝癌患者获得长期生存的首选治疗方案。但是对于很多临界可切除肝癌(主要指部分CNLC分期Ⅱb和Ⅲa期)患者而言,因为术前存在至少一项复发的高危因素(肿瘤数目较多,血管侵犯、包膜不完整边界不清等),即使能获得手术切除,术后复发率仍高且预后较差[1],如何延长临界可切除肝癌患者术后长期生存,提高生存质量一直是肝癌研究的重点。虽然肝癌的术前转化治疗已经取得了很大的进展,但对于转化治疗的方案尚在探索中。术前经皮肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)在转化治疗中的作用已获得广泛认可[2],四川省德阳市人民医院从2019年开始对临界可切除肝癌患者采取FOLFOX方案的HAIC联合肝动脉栓塞术(transarterial embolization,TAE)进行术前转化治疗,转化治疗结束后再行手术切除,本研究通过检查手术切除标本获得转化治疗后的真实病理缓解率,并且随访所有患者的长期生存状况,现报告如下。
1 资料与方法
1.1 一般资料
收集我院2019年4月—2022年2月收治的22例接受HAIC联合TAE转化治疗的CNLC分期Ⅱb期临界可切除的原发性肝癌(指肿瘤数目≥4个,无影像学上的血管侵犯和肝外转移,开始治疗前预计肿瘤可以手术切除但又无法达到R0切除)患者的临床资料。纳入标准:⑴ 符合我国《原发性肝癌诊疗指南(2022年版)》[3]临床诊断标准;肝功能Child-Pugh分级A~B级,吲哚菁绿15 min潴留率<15%,对于肝功能正常患者预计剩余肝脏体积(future liver remnant,FLR)/标准肝体积(standard liver volume,SLV)>30%、肝硬化患者FLR/SLV>40%;⑵ 转化治疗前4周内未接受靶向、免疫等其他系统的全身药物等治疗;⑶ 对本研究内容知情同意且签署同意书。排除标准:⑴ 转移性肝癌或已有肝外其他器官转移;⑵ 合并严重的门静脉高压症和凝血功能障碍;⑶ 死亡原因为非肝癌的身体其他疾病;⑷ 临床随访资料不完整或缺失。本研究获得医院伦理委员会批准(编号:19PJYY3133)。
1.2 治疗方法
HAIC联合TAE操作如下:经股动脉或桡动脉插管,DSA造影成功后穿刺肝肿瘤组织取得组织病理证实诊断,微导管插入肝总/肝固有动脉,经肝动脉导管灌注奥沙利铂85 mg/m2+5%葡萄糖500 mL溶液20 mL,留置肝动脉导管回病房后继续在2 h内灌注剩余的480 mL,输完后在2 h内灌注亚叶酸钙400 mg/m2+生理盐水500 mL,然后在48 h内输入5-氟尿嘧啶2 400 mg/m2+生理盐水2 000 mL。第3天再次经留置导管行DSA造影检查肝脏,微导管超选择插入肝脏肿瘤供血动脉,注入碘化油5 mL和直径为300~500 μm的空白微球1.0 g栓塞肿瘤供血动脉,再次造影检查肿瘤供血动脉减少或消失,且无造影剂外溢。
治疗每3~4周重复1次;一般不少于2个周期,总次数不超过4次。HAIC治疗的次数通常由临床医师根据患者的肿瘤控制情况和全身状况来决定。治疗后需要每月复查血生化、肿瘤标志物及上腹部增强CT或MRI检查评估临床疗效。HAIC治疗停止的标准包括:降期后经多学科协作诊疗(MDT)讨论评估可行外科手术切除,治疗期间复查影像学检查出现肿瘤进展(progressive disease,PD)迹象需要更改为靶向/免疫等全身转化治疗,患者对治疗有无法耐受的不良反应,患者死亡或拒绝转化治疗。
1.3 HAIC转化治疗后外科手术切除标准
根据改良实体瘤疗效评价(mRECIST)标准,肿瘤疗效评估为完全缓解(complete response,CR)/部分缓解(partial response,PR)维持3~4周以上,疗效评估为疾病稳定(stable disease,SD)的患者在维持6~8周以上视为肿瘤生物学行为可控,仍可手术切除。手术切除时机:在评估为可切除后应在4周内实施手术切除。术后除常规抗病毒治疗外,根据患者一般情况和术后病理肿瘤分化程度、肿瘤数目、切缘和有无微血管侵犯(microvascular invasion,MVI)决定是否再行2~3次HAIC+TAE治疗。
1.4 随访及观察指标
本研究主要研究终点为术前转化手术切除率、术后病理检查证实的病理缓解率、手术患者的无复发生存(recurrence-free survival,RFS)、所有转化治疗患者的2年总生存(overall survival,OS)情况;次要研究终点为转化治疗的安全性和不良事件发生率,肿瘤的客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)、手术切除指征和时机等。观察指标:⑴ 术前转化治疗的安全性和并发症发生率、根据mRECIST标准评估ORR、DCR,ORR=CR+PR,DCR=CR+PR+SD;⑵ 转化手术切除率;⑶ 手术和术后病理指标:包括手术间隔时间、手术方式、术中出血量,R0切除率和术后标本的病理缓解率,术后并发症;⑷ 患者随访和预后情况:所有转化治疗患者均进行随访,随访时间从第1次HIAC治疗开始,开始每3~4周随访1次,治疗结束后在2年内对所有患者每3个月复查和随访1次。随访主要通过门诊复查和电话随访等方式,末次随访时间为2023年2月。手术切除至首次发现肿瘤复发时间为手术后RFS时间,第1次HIAC治疗开始至患者死亡时间为OS。
1.5 统计学处理
采用SPSS 22.0统计软件进行数据分析。数据以均数±标准差(±s)或例数(百分比)[n(%)]表示,OS采用Kaplan-Meier法进行分析,用Logrank检验比较两组生存曲线的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
22例CNLC分期IIb期肝癌患者中,男19例,女3例;平均年龄(58.5±9.6)岁;乙型肝炎病毒感染15例,丙型肝炎病毒感染2例,另5例肝炎检查阴性。所有患者共接受59例次HAIC序贯TAE治疗,平均2.7次/例(表1)。
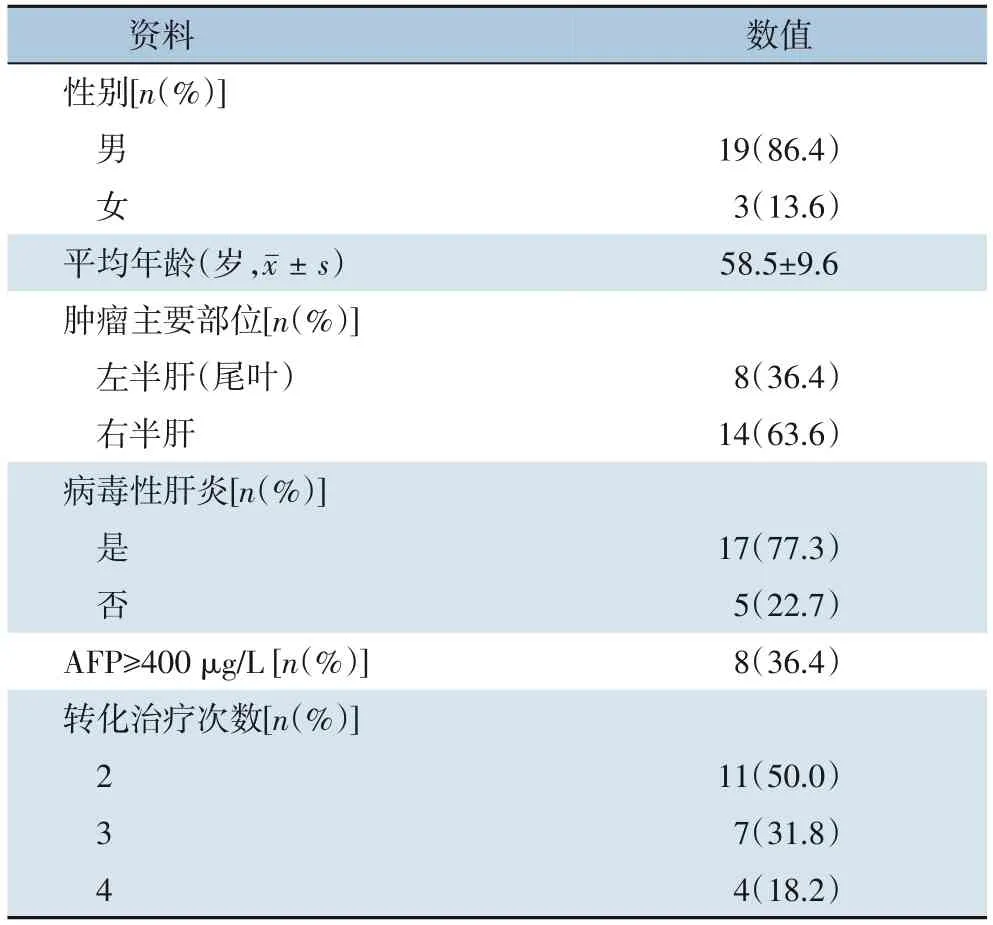
表1 22例术前转化患者临床资料Table 1 Preoperative clinical data of 22 patients
2.2 HIAC+TAE后不良反应和近期疗效评价
22例患者均成功行HAIC+TAE治疗,治疗后均有不同程度的恶心呕吐(8例,36.4%)、右上腹痛(15例,68.2%)、低热(9例,40.9%)等症状,胆红素、转氨酶等轻度增高(19例,86.4%)等,上述症状经止痛、护肝等对症后一般在1周左右后很快好转,未发生异位栓塞、出血/血肿、门静脉主干血栓形成等严重并发症,也没有患者出现不可逆的肝功能损害、肝脓肿形成等。
近期临床疗效观察:转化治疗后3~4个月内根据mRECIST标准评估CR、PR、SD、PD分别为2例(9.1%)、12例(54.5%)、5例(22.7%)、3例(13.6%),ORR、DCR分别为63.6%、86.3%(图1);3例患者在治疗3个月后复查影像学检查出现PD迹象,需要增加仑伐替尼等靶向/免疫等全身治疗。
2.3 手术治疗情况
本组22例肝癌患者在转化治疗结束后有14例行腹腔镜或开放肝癌切除术,转化手术切除率为63.6%(14/22)。手术距离第1次HAIC治疗间隔时间为3~4个月。其中左半肝切除(含扩大左半肝)5例,右半肝切除4例,肝部分切除+术中射频消融5例。手术顺利,术中出血量在400~1 500 mL左右,14例手术患者术后有3例发生术后出血;4例肝功能衰竭和严重胸腹水等并发症,其中2例术后出血患者需要再次手术止血,另1例术后出血患者经介入血管栓塞和输血止血后好转,胸腹水患者经护肝输入白蛋白、穿刺引流后好转,无术后死亡病例。
术后病理检查有11例肝细胞癌,3例肝内胆管癌。切缘均达到R0切除,镜下检查没有发现能达到肿瘤细胞完全坏死的完全病理缓解(complete pathologic response,CPR)的病例,但有10例(71.4%)患者标本为多数肿瘤细胞呈坏死状态,仍有局灶性肿瘤细胞,考虑主要病理缓解(major pathologic response,MPR)(图2)。另外4例患者术后标本仅见少量坏死肿瘤细胞。
本组22例患者中8例在转化治疗结束后未手术切除,其中有5例是因为患者年龄、身体状况、有合并症等其他因素不愿意手术切除。另外3例是因为HIAC转化治疗后患者出现肿瘤的局部进展,预计即使手术切除也会预后差故未手术治疗,需要增加靶向药物等其他治疗。
2.4 随访和远期预后情况
本组22例患者均进行了随访。截至2023年2月,14例手术患者的RFS时间平均为14.7个月;1、2年OS率分别为92.8%、71.4%。而8例未手术患者1、2年OS率分别为62.5%、37.5%,手术组和未手术组的OS时间分别平均为22.7个月和13.2个月。接受手术切除患者OS明显优于非手术患者(P=0.018)(图3)。

图3 手术组与未手术组患者生存曲线图Figure 3 Survival curves for patients of surgical group and non-surgical group
3 讨 论
对很多临界可切除CNLC分期Ⅱb期(肿瘤直径不论,肿瘤数目≥4个)和Ⅲa期(不论肿瘤情况有影像学可见血管癌栓而无肝外转移)的肝癌患者而言,《原发性肝癌诊疗指南(2022年版)》[3]推荐仍是肝动脉插管化疗栓塞术(transcatheter arterial chemoembolization,TACE)、外科手术切除或系统抗肿瘤治疗等。其中仅有少部分CNLC分期Ⅱb和Ⅲa期肝癌患者如果肿瘤局限在同侧半肝/肝叶内,或可以同时行术中消融处理切除范围外的肝内其他病灶,也可以手术切除[4-5]。但是因为这些患者大多属于肿瘤学上不可切除范畴,即使手术切除后也并不一定能获得更好的长期生存效果[6],患者是否最终会从手术切除中获益,这需更为谨慎地进行术前MDT评估。
目前原发性肝癌外科手术治疗仍然面临两大主要难点:一是手术切除比例偏低,我国肝癌初诊患者手术切除比例不到20%~30%[7];另一个难点是术后复发率高,即使有部分患者能够获得外科手术切除治疗,但是术后5年内复发率可高达80%[8]。所以,如何使更多的肝癌患者获得手术切除以及降低术后早期复发风险、延长患者长期生存仍需要积极探索。目前已有报道对于临界不可切除的肝癌患者而言,如果能够获得转化切除的机会,术后3年无瘤生存率和OS率可达到43.9%和60.2%,已基本能达到很多早中期肝癌患者一期手术切除后的长期生存水平[9-11]。因此对于这部分中晚期肝癌患者应争取经局部/全身治疗实现转化降期后再外科手术切除,增加手术切除率并提高患者长期生存时间。
转化治疗是将不可切除的或潜在可切除的肝癌转化为外科可切除肝癌,也包括将预计切除后疗效较差的患者转化为切除后疗效更好的患者[7](即肿瘤学意义上的转化)。术前采用多模式、高强度的转化治疗促使肿瘤缩小或降期后再切除是肝癌患者获得根治性切除和术后长期生存的重要措施[12]。理想的转化治疗方案应该具有较高的ORR和转化切除率、对患者的肝脏和全身其他器官功能影响最小、不良反应少,并争取在较短时间内达到转化切除的标准。目前尚无法证实哪一种转化治疗方案能带来最佳疗效。HAIC通过肝动脉分支局部持续给药,可将化疗药物直接输注到肝癌的供血动脉,能够使肿瘤持续接触高浓度化疗药物,最大程度杀伤肿瘤细胞;同时减少化疗药物在外周血中的分布,从而减少化疗药物的全身不良反应[13]。相较于传统的TACE,基于FOLFOX方案的HAIC在大肝癌的治疗中具有更高的ORR和长期生存。根据实体瘤临床疗效评价标准(RECIST)1.1,HAIC联合抗血管生成药物组与TACE联合组相比较,ORR(72.09%vs.44.0%)和DCR(88.37%vs.60.0%)较高。另外,HAIC联合组手术转化率(30.23%vs.14.0%)较高[14-15]。而单独使用靶向药物、免疫药物的ORR获益有限,最高仅达到20%左右[16]。
HAIC已作为伴门静脉癌栓肝癌的标准治疗纳入日本的肝癌诊疗指南[4]。但是与索拉非尼等中晚期肝癌标准靶向治疗治疗方案相比,美国国家综合癌症网络(NCCN)肝胆肿瘤和亚太肝脏研究协会的肝癌指南中晚期肝细胞癌治疗方案并不包括推荐使用HAIC[17]。提高肝癌患者长期生存时间是所有治疗指南的终极目标,这就需要通过研究去比较不同的治疗方法之间的优劣。本研究结果表明,经过术前HAIC联合TAE转化治疗,ORR和DCR分别为63.6%、86.3%,转化手术切除率为63.6%,术后病理检查有71.4%患者能达到MPR,证实这部分肝癌患者可以从HAIC转化治疗后达到降期效果,如果再结合外科手术切除,也可达到长期生存的目的。
目前已证实新辅助/转化治疗后的病理缓解是预测肿瘤患者长期生存的独立预后因素,CPR者具有较好的预后[18]。但是因为病理缓解需要手术切除后才能获得,目前对于肝癌转化治疗后的病理缓解率研究较少,《原发性肝癌诊疗指南(2022版)》也没有对明显病理缓解的阈值作出明确规定。术前HAIC联合TAE转化治疗究竟能达到多大程度上的病理缓解率?本组术后病理检查虽然没有发现有达到CPR患者,这可能与开始术前转化距离手术时间较短有关(手术距离第1次HAIC治疗间隔时间为3~4个月),但有10例(71.4%)患者为MPR。证实了通过术前局部转化治疗不仅能够杀灭主要肿瘤细胞和不易发现的微小转移灶,同时还可减少因术中肿瘤挤压导致的肿瘤细胞脱落转移形成术后早期复发转移[19]。
强效的术前转化治疗能让肿瘤缩小甚至获得CR,部分患者能达到长期生存,对于这样的患者是否还需要继续接受进一步手术切除?目前大多数观点认为手术切除仍是肝癌转化治疗后患者获得长期生存的关键,转化后肝切除术是唯一与OS率相关的独立预后因素[20-21]。手术切除不仅可消灭潜在残余的肿瘤细胞,而且术后病理学检查还可为辅助治疗提供指导意见。影像学CR并不等于病理学CR[22],本研究也证实了虽然术前mRECIST标准评估为肿瘤CR,但术后病理发现肿瘤细胞并未完全坏死,仍有少量活性肿瘤细胞(考虑为MPR),且接受手术切除患者OS显著优于非手术患者。转化成功后应及早行手术切除,避免可能会出现继发性耐药和PD失去手术切除机会。
综上所述,HAIC联合TAE在肝癌转化治疗的是安全可行的,临床疗效显著,转化治疗后手术切除仍然是获得长期生存的关键。但本研究还有一些不足之处:纳入病例较少,随访时间相对较短,缺乏与未接受术前转化治疗而直接手术患者的对照研究,还需要更大的样本量和更长时间来进行随机对照研究。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:郑本波,刘航负责研究设计、实施手术,收集和分析临床数据,文章撰写和审阅,黄文参与血管介入转化治疗,聂佳参与术后病理检查评估和数据收集。
