哺乳动物精卵识别及阻止多精入卵机制的研究进展
2024-03-01石庐挺江博文刘国世
石庐挺,江博文,刘国世,张 鲁
(中国农业大学动物科学技术学院,北京 100193)
哺乳动物的受精是由单个精子和卵子融合构建成合子的过程,是有性生殖动物个体发育的起点。对受精机制的研究推动了体外受精技术的发展,为数以百万计的不孕不育患者提供了治疗手段,也给以奶牛为首的家畜育种带来革命性的变化。多精入卵导致的受精失败或胚胎染色体倍性异常限制了体外胚胎生产效率的进一步提高,需要深入研究精卵识别的机制,为开发相应的新型体外受精技术提供支持。
目前,对哺乳动物的受精过程有了较为清晰的认识。首先,运行到输卵管壶腹部的获能精子与卵丘卵母细胞复合体发生接触,精子释放顶体酶,使卵丘细胞层松散并暴露出透明带。随后,精子和卵子透明带进行特异性识别并使透明带局部水解,精子穿过透明带进入卵周间隙,与卵细胞质膜识别、结合与融合,精子的细胞核和部分细胞质进入卵母细胞形成雄原核,此时卵子完成第二次减数分裂并释放出第二极体,形成雌原核,雌雄原核相互靠拢并融合,形成受精卵,进而开启新个体的发育进程[1]。正常条件下,只有一个精子和一个卵母细胞进行特异性识别并融合,而多个精子进入卵子会造成多精入卵现象,导致胚胎发育异常,进而引起妊娠失败。为了保证正常的受精,卵子在与第一个精子融合后激活,卵胞质中钙离子浓度以一定的频率升高,随后皮质颗粒发生胞吐[1]。皮质颗粒释放内容物进入卵周间隙,从而使得卵子透明带和质膜上负责与精子识别的分子发生改变,进而阻止其他精子与卵子的识别和融合,形成多精入卵的阻断机制[2]。文章针对哺乳动物精卵识别和阻止多精入卵的机制进行综述,以期为提高哺乳动物体外受精效率提供新的策略。
1 哺乳动物精卵识别机制
1.1 精子与卵子透明带蛋白识别的机制
1.1.1 卵子透明带蛋白
哺乳动物的精子离开附睾时不能立即获得使卵子受精的能力,Chang[3]和Austin[4]研究发现,精子必须在雌性生殖道中运行一段时间才能获得使卵子受精的能力(称为获能)。获能的精子发生顶体反应,暴露质膜上的蛋白并释放各种酶类,为后续穿过透明带和细胞膜融合做好准备[5]。哺乳动物精子和卵子的第一次特异性识别发生在卵子的透明带(zona pellucida,ZP)上。目前发现,透明带是由3~4个糖蛋白亚基组成,即ZP1~ZP4[6]。不同物种的透明带组成不同,小鼠的透明带主要由mZP1、mZP2、mZP3以及结合透明带整体结构的辅助蛋白构成,糖蛋白mZP2和mZP3(异二聚体)形成的重复纤维通过mZP1糖蛋白的二聚体连接在一起[7]。人的透明带由hZP1、hZP2、hZP3和hZP4四种糖蛋白构成,其中hZP2和hZP3为单体,hZP1为通过分子间二硫键连接的相同多肽的二聚体,而hZP4是通过非共价相互作用结合在一起的单体或二聚体[8- 9]。猪、牛和狗的透明带含有ZP2、ZP3和ZP4,但缺乏ZP1[6],与小鼠和人卵母细胞透明带蛋白构成不同。通过Uniport数据库查询各蛋白的序列,目前鉴定出的各种动物ZP1~ZP4蛋白如表1~4所示,不同物种间ZP蛋白序列的相似度随着种属亲缘关系远近而有所不同。其中,大鼠和小鼠ZP1蛋白序列相似度可高达87.28%,ZP2蛋白序列相似度为86.91%。猕猴和人类ZP2蛋白序列相似度可高达94.23%,ZP3蛋白序列相似度为93.63%。而牛和猪ZP4蛋白序列相似度为76.74%。不同物种透明带蛋白的差异与精卵识别的特异性紧密相关,对相关蛋白结构的比较和解析将有助于理解ZP蛋白作用的机制。
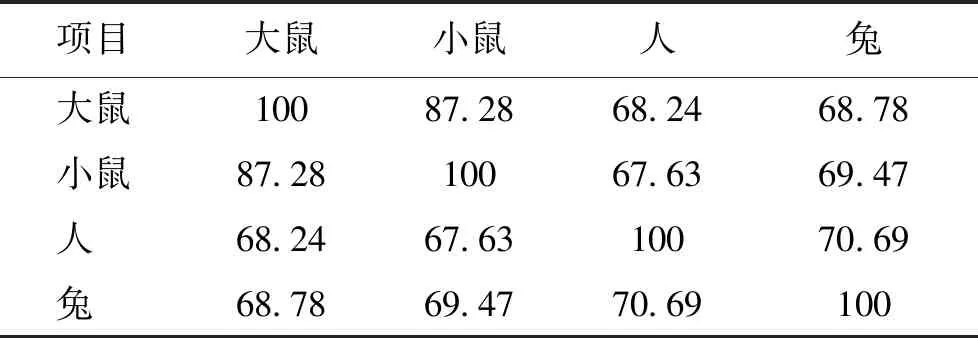
表1 不同物种ZP1蛋白序列一致性比较
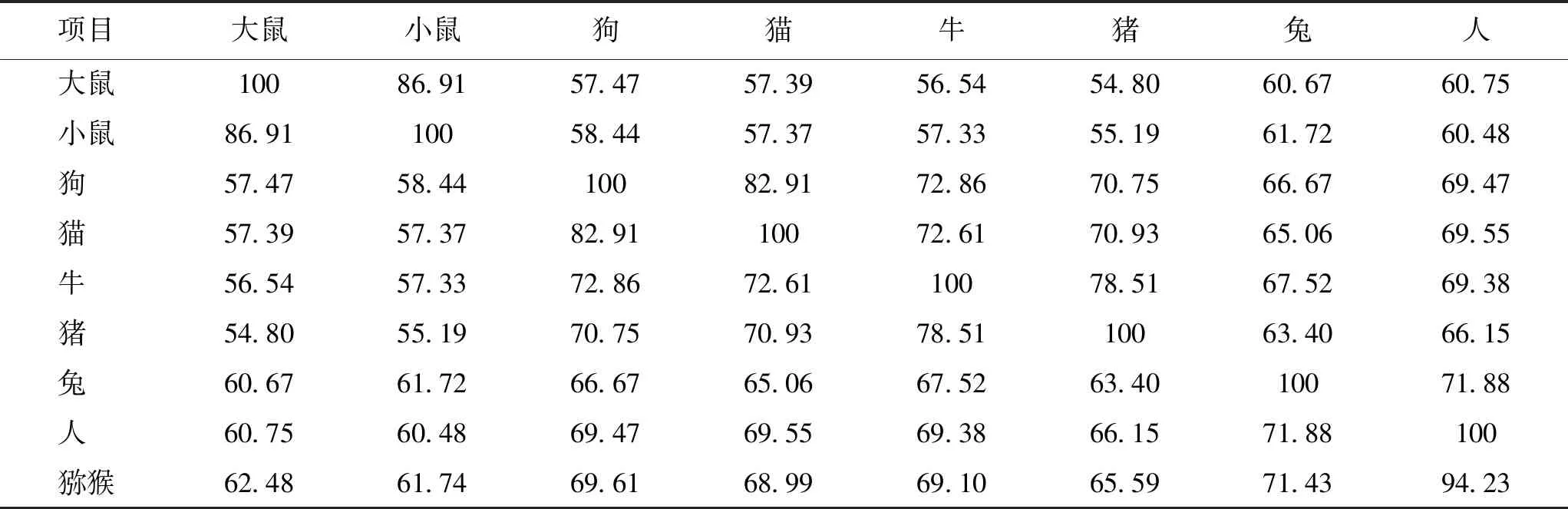
表2 不同物种ZP2蛋白序列一致性比较

表3 不同物种ZP3蛋白序列一致性比较

表4 不同物种ZP4蛋白序列一致性比较
1.1.2 透明带蛋白功能
针对透明带功能的研究表明,编码透明带糖蛋白基因的突变会影响其结构,从而导致雌性生育力低下或受精失败。小鼠模型中,Zp1-/-的纯合突变雌鼠产生的卵母细胞透明带缺失,其与野生型雄鼠交配后受精失败,无法获得后代[10]。在人类中,缺乏ZP1的卵母细胞会因缺失透明带导致雌性家族性不孕症[11]。此外,对ZP2和ZP3功能的研究发现,Zp2mut/mut或Zp3mut/mut的纯合突变雌鼠产生的卵母细胞只能形成非常薄的透明带或根本不形成透明带,导致雌鼠不育,而Zp2+/mut和Zp3+/mut双杂合突变雌鼠产生的卵母细胞在体内或体外受精后均会发生多精入卵现象[12]。对于人类,有研究发现1名原发性不孕症患者的ZP2和ZP3基因存在杂合突变,获得的卵母细胞透明带很薄或缺失[12]。同时,利用转基因技术让小鼠卵子表达人的透明带蛋白,发现只有含人的ZP2蛋白的小鼠卵才能与人的精子结合,目前认为ZP2可通过精子对应的受体识别,介导卵子透明带与精子的结合[13-14]。研究发现,ZP4对ZP3/ZP4复合体负责的猪精卵识别起关键作用,ZP3/ZP4也负责牛的精卵识别[15-17]。不同物种、不同类别的ZP蛋白在精卵识别中起关键作用,这种差异可能是形成物种间生殖隔离的重要机制,但该方面较深入的对比研究还较少。
1.1.3 精卵透明带识别机制研究进展
精子与透明带的识别是一种受体-配体介导的事件,涉及卵子透明带糖蛋白与精子表面蛋白的相互作用。最早鉴定的精子中能与透明带结合的受体是β1,4-半乳糖基转移酶(B4galt1/GalTase)。B4galt1是一种跨膜蛋白,在精子发生过程中整合到质膜上,与小鼠、猪和公牛的精子-透明带结合有关[7]。基因敲除试验结果表明,B4galt1-/-的雄性小鼠产生的精子与ZP3结合引发顶体反应的能力降低,但仍能与透明带结合并使卵子受精[18-19]。顶体蛋白酶(acrosin,ACR)是另一种能与透明带结合的精子蛋白,目前发现其存在于人和猪精子顶体表面,是精子穿过透明带必不可少的蛋白[7]。使用CRISPR/Cas9系统生产Acr敲除的仓鼠,Acr-/-的雄性仓鼠精子不能穿过透明带,表现出完全不育[20]。也有研究发现,去整合素金属蛋白酶(ADAMs)家族中有一些睾丸特异性表达的蛋白,其中ADAM1A是小鼠体内ADAM1的一种亚型,在生精细胞中与ADAM2形成复合物,这种复合物能调节ADAM3在精子表面的表达水平。ADAM3是一种睾丸特异性蛋白质,Adam1a-/-和Adam2-/-公鼠的精子表面ADAM3水平降低,精子与卵子透明带的黏附力下降,导致受精失败[21-24]。此外,研究发现ZP3结合蛋白ZP3R(syn.sp56/AM67)在小鼠精子上表达,在精子获能期间,ZP3R从顶体基质转移到精子质膜[25]。重组ZP3R预处理的卵母细胞与精子结合减弱,但Zp3r-/-的雄性小鼠仍具有生育能力[26-27]。在人类精子中,一种羰基还原酶(DCXR)具有与透明带结合的能力。DCXR是附睾分泌的一种GPI锚定蛋白,位于顶体上方的精子质膜内,在仓鼠、小鼠、牛和猪精子中表达[7]。在人类和仓鼠中DCXR抗体处理的精子与透明带的结合能力降低,但小鼠则没有此现象[28-30]。也有研究发现,人精子CRISP1(hCRISP1)能与ZP3发生特异性相互作用,参与精子与卵子透明带的结合。而用hCRISP1多克隆抗体预处理,用获能的人类精子与表达人透明带蛋白的小鼠卵子共孵育,结果表明,hCRISP1抗体处理降低了卵子透明带结合的精子数量[31]。而在猪和牛等大动物模型中已发现多种精子候选蛋白,比如上述中的B4galt1、ACR、ZP3R、DCXR等,可能与卵子透明带结合[7]。也有几种蛋白,目前只在猪和牛的精子中表达,起到与透明带识别的作用,对Spermadhesins蛋白( AWN、 AQN1和AQN3)的研究较多,在精子的膜上表达,与透明带蛋白的Galβ(1-3)-GalNAc和Ga1β(1-4)-GlcNAc结构进行识别[32- 33]。AWN和AQN与另一种精浆蛋白DQH/BSP1/pB1形成复合物,并与精子表面结合[34]。但目前,这些蛋白与透明带进行识别的详细过程还未有深入的研究,缺乏基因过表达或敲除的动物模型。由于精子识别和穿透卵子透明带的过程不是单一的识别行为,涉及多步骤多蛋白的相互作用,需要系统的研究。
1.2 精子与卵子质膜蛋白识别的机制
精子穿过透明带后进入卵周间隙,与卵子质膜识别并融合,构成了第二道精卵特异性识别系统。在过去几十年的研究中,发现几种蛋白质在精子-卵子质膜相互识别中起关键作用。一种富含半胱氨酸的分泌蛋白(cysteine-rich secretory protein,CRISP1)最初定位于大鼠精子头部的背侧区域,顶体反应后迁移到赤道段,参与透明带结合和卵膜融合;另一种同源蛋白CRISP2(TPX1)也参与精子-卵子融合,在受精的各个步骤中与CRISP1具有协同作用[35-36]。在精卵结合过程中,精子的CRISP1和CRISP2结合到卵子的融合结构上,CRISP1和CRISP2的抗体可以有效抑制受精过程,但CRISP1敲除公鼠仍可育,说明其不是受精所必需的[37- 38]。同时,有研究发现CRISP1在猪附睾中表达,而CRISP2存在于睾丸组织,但尚不清楚CRISP蛋白在猪精子中的定位[39]。而另一项研究证实精子IZUMO1蛋白是精卵膜识别所必需的[40]。IZUMO是免疫球蛋白超家族(IgSF)的成员,通过对小鼠精子的研究发现,其起初在顶体的内外膜上表达,顶体反应后沿着精子表面重新分布,主要定位在精卵结合的赤道部分,在添加单克隆抗体OBF13后显示出对受精的强烈抑制作用[40-41]。利用敲除小鼠模型研究发现,Izumo1-/-雄性小鼠不育,但其精子形态正常且能够发生顶体反应,Izumo1-/-小鼠精子可以结合并穿过透明带,但不能与卵细胞膜融合[40]。随后,多项研究证实了IZUMO在猪、牛、羊和人等精子上的表达[42-45],但IZUMO在精卵识别中的具体作用和物种差异性等方面仍需深入的研究。
近几年研究人员致力于寻找能与精子IZUMO识别的卵母细胞蛋白。其中,CD9是一种在卵子上表达的四重跨膜结构域蛋白,Cd9基因敲除的雌性小鼠的繁殖能力极显著下降,体外受精时精卵融合缺陷[46-47]。直至2014年,研究人员利用IZUMO制作的探针,在卵子上鉴定出一种叶酸受体类的糖基磷脂酰肌醇(GPI)锚定蛋白JUNO(也称为IZUMO1R)[48]。敲除小鼠JUNO后,Juno-/-小鼠的卵子不能与发生顶体反应的精子结合或融合,从而造成雌性小鼠不孕[48]。后续的研究发现,IZUMO1和JUNO在哺乳动物中具有保守性,并已证明参与人类精卵识别和多精入卵的调控过程[44, 49-52]。查询Uniport数据库发现(见表5~7),人类和鼠的IZUMO1和Juno序列一致性均较低,而CD9的序列在不同物种间的差异则较小,这些蛋白的序列与其功能存在关联性,提示精卵膜识别机制在不同物种间的特异性。

表5 不同物种IZUMO1蛋白序列一致性比较

表6 不同物种JUNO蛋白序列一致性比较
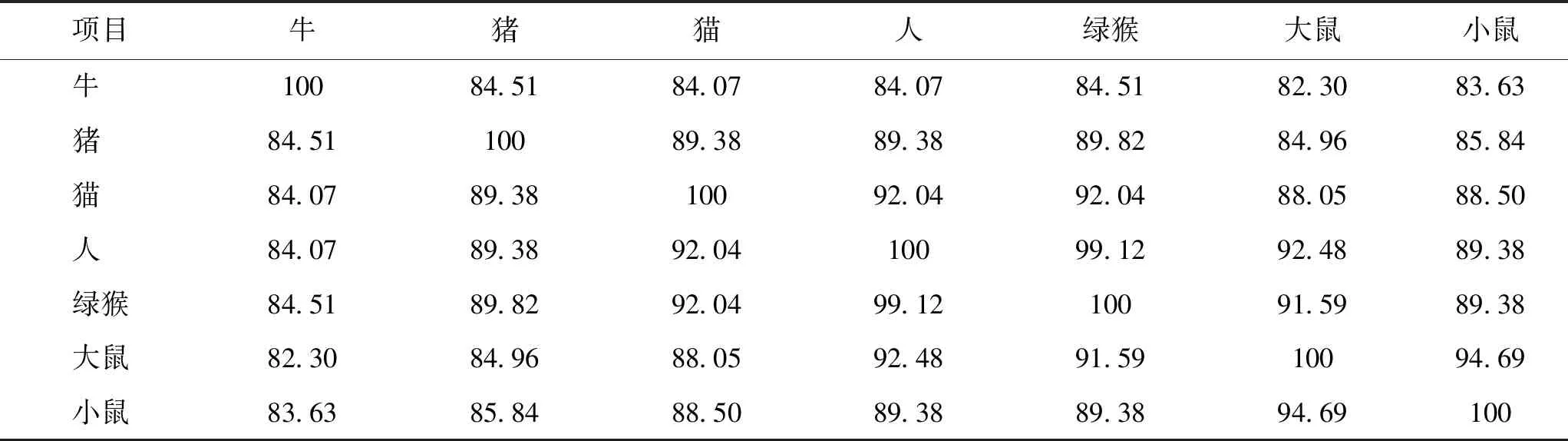
表7 不同物种CD9蛋白序列一致性比较
2 哺乳动物阻止多精入卵的分子机制
有性生殖动物在繁殖过程中需要一个精子和一个卵子的遗传物质结合,形成新的合子,从而开启新个体的发育和生长过程。哺乳动物是单精受精动物,一个精子与卵子结合是保证胚胎正常发育的前提,而一个以上的精子同时进入卵子并与之融合则形成多精入卵,多精入卵会导致多倍体合子的产生,早期胚胎发育发生异常[53]。因此,哺乳动物卵母细胞为了保证正常的受精,在与第一个精子融合后激活,卵子细胞质中钙离子浓度以一定的频率升高,进而引发皮质颗粒发生胞吐[1]。皮质颗粒释放内容物进入卵周间隙,从而使得卵子透明带和质膜上负责与精子识别的分子构象发生改变,进而阻止其他精子与卵母细胞融合,形成多精入卵的阻断机制[2]。
2.1 皮质反应的研究进展
哺乳动物阻止多精入卵的关键是皮质反应。皮质颗粒在发育早期由高尔基体衍生,在卵母细胞成熟过程中,依赖肌动蛋白逐渐向外周转移[54]。在排卵期卵中,皮质颗粒密集排列在卵母细胞皮质下方[55]。目前认为精子诱导的卵子内钙离子变化是皮质颗粒迁移的关键调控信号。当精子穿透卵母细胞后,释放磷脂酶C(PLCzeta)分子,其水解磷脂酰肌醇-4,5-二磷酸(PIP2)产生三磷酸肌醇(IP3)和二酰基甘油(DG)两个第二信使,其中IP3激活内质网上的受体,使得Ca2+大量释放,并以一定的频率反复发生形成钙振荡[1]。钙振荡通过Ca2+依赖蛋白的作用,促进细胞骨架相关蛋白如肌动蛋白、丝状肌动蛋白、肉豆蔻酰化富丙氨酸C激酶底物(MARCKS)的重组,进而引发皮质颗粒胞吐,将其内含物如水解酶、蛋白酶、糖苷酶和交联酶等释放至卵黄周隙,这一过程称为皮质反应[37,56-58]。研究表明,Plcz1缺失的小鼠精子不能引起卵子钙振荡,导致释放的皮质颗粒数目减少,ZP2裂解延迟,透明带阻断受到影响[59-60]。同时,缺乏Plcz1的精子结合的卵子质膜阻断的能力降低[60]。皮质反应所释放的酶类使得卵子透明带蛋白发生修饰,阻止其他精子进入,称为透明带反应[37, 55]。同时,皮质反应所释放的另一些酶作用于卵子质膜上的蛋白,进而在卵子质膜上形成阻止多精入卵的分子屏障,称为卵黄膜反应[37, 55]。卵子内皮质颗粒研究还较为缺乏,需要借助敲除小鼠和大动物模型结合人类辅助生殖临床数据,解析皮质颗粒发生机制、迁移模式,以及钙振荡调控皮质颗粒的迁移、融合和释放等的分子调控机制等。
2.2 透明带反应的研究进展
哺乳动物在受精时,精子需要与卵子ZP蛋白进行识别,皮质颗粒胞吐释放的酶ZP蛋白的分子构象发生改变。而目前发现,一种由卵母细胞Astl基因编码的特异性膜金属蛋白酶Ovastacin负责水解ZP蛋白[54]。敲除小鼠模型中,缺失Ovastacin的雌性小鼠卵子的ZP2在受精后依旧保持完整,精子甚至与二细胞期胚胎结合,说明了皮质颗粒蛋白Ovastacin对于阻止多精入卵的重要性[54]。此外,皮质颗粒胞吐释放的酶类使ZP硬化,后续的精子不能与卵子ZP识别和结合。未成熟卵子和受精卵的透明带比准备受精的MⅡ卵硬3~4倍[61-62]。受精后只有一小部分的ZP2分子被水解,当大约16%的ZP2被水解时,可以观察到哺乳动物的透明带完全硬化[63]。研究发现,肝脏分离的fetuin-B蛋白能够抑制皮质颗粒释放Ovastacin,防止透明带提前硬化,保证正常受精的进行[64]。此外,研究发现,谷氨酰胺转胺酶2(transglutaminase 2,Tgm2)在卵子皮层下大量积累,受精后Tgm2蛋白结合并交联ZP3,从而改变透明带的硬化程度,以防止多精入卵和多倍体胚胎形成[65]。也有一种观点认为,ZP3蛋白上的O-聚糖充当精子头部表面受体的配体,受精后皮质颗粒释放糖苷酶,去除O-聚糖并导致游离精子无法被识别后进入[66],但目前缺乏基因敲除动物证据支持。最近有研究报道了锌离子的释放在透明带硬化以防止多精入卵的过程中发挥重要作用[67]。精卵融合后的钙振荡诱导锌离子被释放到细胞外环境,导致受精卵总锌浓度的降低,锌离子会降低局部精子的向前运动能力,从而进一步减少到达卵子的精子数量[68]。在小鼠透明带硬化过程中加入锌离子,可导致多精入卵[68]。锌离子还可通过稳定糖蛋白链和细胞外基质的纤维成分来改变透明带的结构,进而使得透明带硬化,减少了能够结合并到达受精卵的精子数量[69]。
2.3 卵黄膜反应的机制
哺乳动物卵子受精过程中,精子需要与卵子质膜进行识别、黏附和融合等多个步骤,尚不清楚卵质膜阻止多精入卵是在哪个阶段起作用。目前已知小鼠和人的卵子质膜上与精子IZUMO1相互识别的蛋白是JUNO,其在阻止多精入卵中发挥着重要作用[48-50]。在精卵膜融合后,卵子质膜上JUNO从膜上释放下来,精子结合位点被清除, JUNO在卵周隙中结合精子,进而阻止游离精子与卵子质膜发生识别[48]。此外还发现,小鼠卵子卵胞浆内单精子注射(ICSI)或进行孤雌激活时,由于缺少配子识别过程, JUNO不会从卵子表面移除,仍然可以和更多的精子结合[48]。研究也发现,接受辅助生殖治疗的女性,JUNO基因(IZUMO1R)突变导致人卵子多精入卵严重,早期胚胎发育失败[70]。但尚不清楚卵子和精子融合后,何种蛋白能分解JUNO,使其脱离卵黄膜,以及皮质颗粒内容物是否参与此过程。可以推测,皮质反应发生后,皮质颗粒释放的某些分子作用于锚定在卵质膜的JUNO,阻止额外精子与卵子的识别和融合。
3 小结与展望
哺乳动物卵子受精过程受到多重分子机制的精准调控,保证一个精子和一个卵子的遗传物质结合,从而恢复正常的染色体数量,是胚胎正常发育的基础。精子与卵子识别和融合后引发卵子的钙振荡和皮质颗粒释放,从而引发透明带反应和卵黄膜反应,起到阻止额外精子进入的作用。目前,大部分关于精卵识别机制的试验是以小鼠为模型,结合人类临床病例,鉴定出精子的IZUMO,卵子的透明带ZP和质膜JUNO蛋白在精卵特异性识别中起关键作用,而且在受精后皮质颗粒释放的Ovastacin等酶类可以作用于这些蛋白,阻止额外精子的识别和进入。但尚不清楚精子中与ZP特异识别的蛋白,也未发现哪些蛋白能使JUNO脱离,需要在未来的研究中重视非实验动物的相关研究。
生殖障碍已发展为世界性的公共健康问题,在我国约有1/6的夫妇面临着不孕症的困扰,越来越多的不孕夫妇需要借助辅助生殖治疗来获得临床妊娠,最终达到生育健康婴儿的目的[71]。此外,随着猪在人类医学领域和人类疾病模型研究中的应用,猪体外胚胎工程技术的需求增大,但由于多精入卵率高,使得猪体外胚胎的发育率低。因此,解析哺乳动物受精及阻止多精入卵的分子机制,对治疗人类不孕不育和动物的体外胚胎生产至关重要。本文对哺乳动物精卵识别及阻止多精入卵的分子机制研究进展的分析,可以为改进人类和家畜的体外受精技术,以及开发非激素类避孕药物提供新思路。
