冠突散囊菌Ec-12上清抑制小鼠的伤寒沙门菌机制的初步分析
2024-03-01李兆龙孔祥瑞林锋强王秀萍彭小莉陈常颂
李兆龙,孔祥瑞,林锋强,王秀萍,赵 冉,彭小莉,陈常颂*
(1.福建省农业科学院畜牧兽医研究所,福州 350013;2.福建省农业科学院茶叶研究所,福州 350013;3.厦门市动物疫病预防控制中心,厦门 361013;4.厦门海关技术中心,厦门 361013)
冠突散囊菌(Eurotiumcristatum, EC)是散囊菌目发菌科散囊菌属的成员,常见于较低温和较湿环境中,其中在陈年饼状茶叶及安化黑茶多见[1]。整个散囊菌由子囊果和菌丝组成,生长适应性强,营养要求低,可在普通的马铃薯葡萄糖琼脂培养基(PDA)和孟加拉红培养基中生长[2]。因冠突散囊菌在茯砖茶发酵过程中出现金黄子囊果,因此俗称“金花”。
早期刘仲华教授团队通过筛选及验证,发现它能代谢茶叶中的氟,达到降氟功效,提升茶叶的安全性[3]。之后陆续有研究报道,冠突散囊菌发酵茶叶后释放的木质纤维,茶多糖,茶色素,蛋白质,氨基酸,茶多酚,咖啡碱,茶皂素及矿物质等成分具有显著降脂减肥和降糖功效,进一步拓展了它的药用价值[4-5]。近几年,冠突散囊菌的生理特征、药理作用、临床应用和提取工艺等方面的研究陆续开展[6]。近期的研究揭示冠散囊菌次级代谢产物对人乳腺癌细胞株 (MCF-7)、人神经胶质瘤细胞株 (SF-268) 和人肺癌细胞株 (NCI-H460) 有较强的抑制活性[7]。冠突散囊菌发酵分泌的多糖对人类红白血病K562细胞有一定的抑制作用[8]。冠突散囊菌与其它菌混合发酵的次级代谢产物对一些人的肿瘤细胞生长也有较强抑制作用[9]。此外,冠突散囊菌上清具有提高机体的免疫和抗氧化功能,抑制某些有害菌增殖等多种医药学价值[10]。
鼠伤寒沙门菌(SalmonellaTyphimurium)是沙门菌属,鼠伤寒沙门菌B群的成员,其生物学特征与伤寒杆菌相似。作为一种常见的食源性致病菌,常引起人的肠道感染的重要人畜共患病原菌。鼠伤寒沙门菌主要通过污染的食物或水传播,经胃入肠后,在肠道内增殖,黏附于肠黏膜上皮细胞,进而侵入固有层,引起肠炎、败血症和全身系统性疾病。
冠突散囊菌作为茶叶中常见的菌,它在提高茶叶的安全性,提升茶的色、香、味品质方面起着重要的作用,也开展了较多的研究[11-12],但对于冠突散囊菌自身的益生特性,较少开展完整的研究。本研究从安化黑茶中分离筛选到一株菌株Ec-12,通过形态学和生长特征及 ITS rRNA 基因序列分析进行鉴定,并对其上清抑制鼠伤寒沙门活性和生长稳定性,以及保护小鼠抵御鼠伤寒沙门感染的初步机制研究,以期为菌株Ec-12抑制鼠伤寒沙门机理研究和应用开发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株 金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、鼠伤寒沙门菌和福氏志贺菌(ShigellaCastellani)为厦门海关技术中心分离并鉴定。
1.1.2 培养基 马铃薯葡萄糖琼脂(PDA)培养基(g·L-1)组成成分:马铃薯 200.0 g,葡萄糖 20.0 g,琼脂 15.0 g (不加琼脂为 PDB 培养基),麦芽汁培养基成分组成(g·L-1):麦芽膏粉130.00 g,琼脂 15.0 g,氯霉素0.1 g,pH为5.8~6.2。
1.1.3 主要试剂和仪器 主要试剂有琼脂、酵母提取物、葡萄糖和蛋白胨等,购自上海一研生物科技有限公司(上海);安化黑茶购自福建省泉州市安溪县茶城(泉州);PCR引物合成及测序,福州博尚生物工程有限公司(福州)。细菌基因组DNA提取试剂盒购北京百泰克生物技术有限公司(DP7121,北京),TaqPCR Mix购自中科瑞泰(北京)生物科技有限公司 和 DNA Marker购自上海嵘崴达实业有限公司(上海)。恒温培养箱,上海左乐仪器有限公司(LRH-350F,上海);恒温振荡培养箱,江苏太仓市华美生化仪器厂(THZ96A,太仓);PCR 仪,BIO-RAD美国伯乐(T100,美国);电泳仪,广州威佳科技有限公司(CBMN-7,广州);扫描电镜,蔡司场发射扫描电镜(GeminiSEM 360,德国)。
1.1.4 实验动物 7日龄BALB/c小鼠30只,购自福建吴氏实验室动物中心。
1.2 方法
1.2.1 冠突散囊菌的分离与筛选 2022 年 6 月从安化黑茶采集含冠突散囊菌孢子,于福建省农业科学院畜牧兽医研究所实验室进行菌株分离及后续试验。在无菌操作室,使用灭菌镊子,镊取灭菌的10 μL TIP头,TIP尖头沾取少量灭菌水,然后用TIP尖头刮取安化黑茶中间的冠突散囊菌孢子,连TIP头一起放至1.5 mL马铃薯葡萄糖肉汤(PDB)培养基的离心管,封口膜密闭,置恒温振荡培养箱28 ℃、190 r·min-1振荡培养2 h,分别稀释成10-2、10-3和10-4的悬浮液,吸取80 μL不同浓度稀释液涂布于马铃薯葡萄糖琼脂(PDA)培养基平板,温度28 ℃,湿度45%,恒温培养箱培养3 d,挑取不同单菌落划线纯化。
1.2.2 冠突散囊菌EC-12 的鉴定
1.2.2.1 形态特征观察:挑取马铃薯葡萄糖琼脂(PDA)培养基平板上菌株,并将它重新划线接种于PDA平板,28 ℃ 培养 3 d,对菌落形态进行观察。
1.2.2.2 分子生物学鉴定:使用PBS清洗去除培养基,将初步处理的Ec-12菌液,应用细菌基因组DNA 提取试剂盒提取菌株Ec-12的基因组 DNA,以提取的基因组 DNA 为模板,利用真菌扩增的通用引物ITS3F 5′-TCCGTAGGTGAACCTGCGG-3′)、ITS3R(5′-TCCTCCGCTTATTGATATGC-3′)的ITS rRNA 基因进行 PCR 扩增。PCR 反应体系:2×TaqPCR Mix 12.5 μL,ITS3-F(10 μmol·L-1)1.0 μL,ITS3-R (10 μmol·L-1) 1.0 μL,DNA 模板 1.5 μL,ddH2O 9.5 μL。PCR 反应条件:98 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃ 10 min。PCR 扩增产物送福州博尚生物科技有限公司进行纯化测序。根据测序结果,在GenBank数据库下载相关菌株的ITS rRNA基因序列,利用MEGA 7.0软件采用邻接法构建系统发育树。
1.2.3 生长特性分析 取之前分离验证的冠突散囊菌Ec-12株,接种于PDA平板上活化2~3 次,待菌长出黄色囊壳后,用接种环挑取少量黄色囊壳至5 mL灭菌双蒸水,振摇均匀,使用细菌计数法(取一定体积的样品细菌悬液置于细菌计数板的计数池内,用显微镜观察计数)使得孢子悬浮液浓度为108CFU·mL-1。取2%孢子悬浮液,接种至PDB培养基中,28 ℃、190 r·min-1摇床培养7 d。每隔12 h取出培养瓶,将培养液用滤纸过滤,然后105~110 ℃烘至恒定质量。以时间为横坐标,菌体干质量为纵坐标,绘制菌的生长曲线。
1.2.4 冠突散囊菌Ec-12株培养基和增殖时间筛选 挑取1个1 cm大小的冠突散囊菌囊壳,分别置接种至100 mL的PDB、麦牙汁发酵培养基中,28 ℃、190 r·min-1条件下培养 5 d。根据前述的生长特性测定菌丝体的质量。将菌株Ec-12株置于PDB培养基中培养,分别 在 2、3、4、5、6 和 7 d 收集发酵上清液,12 000 r·min-1离心 20 min 后进行过滤,获得不同时间段的无菌发酵液,参考初始培养基筛选中的方法分析不同无菌发酵液对鼠伤寒沙门菌抑制作用。
1.2.5 冠突散囊菌Ec-12株上清的抑菌谱测定 采用琼脂扩散法测定Ec-12株上清抑菌活性。先配制LB营养琼脂培养基200 mL,121 ℃灭菌20 min,灭菌稍冷却后倾注20 mL培养基置于10 cm预先灭菌平板,置无菌操作台凝固并吹干冷凝水,然后放置冰箱4 ℃过夜。隔日分别取0.5 mL新增殖的金黄色葡萄球菌、福氏志贺菌和鼠伤寒沙门菌107CFU·mL-1(预试验结果证实,107CFU·mL-1的对象菌效果较为明显),加入LB营养琼脂平板,再用灭菌玻璃推棒,在平板表面均匀涂布,菌液以平板上无液体流淌为宜。然后用灭菌打孔器在制备好的平板上垂直打出6个孔,6个孔分布要均匀,距边15 mm,用灭菌牙签将琼脂块挑出。然后采用火焰封底为每个孔在酒精灯火焰下烤10 s,进行封底。接着在在每个孔注入20 μL冠突散囊菌Ec-12株发酵液上清,置37 ℃培养6 h,观察并用游标卡尺测量抑菌圈直径的变化。
1.2.6 冠突散囊菌Ec-12株上清的抑制鼠伤寒沙门菌稳定性测定
1.2.6.1 酸碱稳定性:取15 mL冠突散囊菌Ec-12株上清,用l mol·L-1HCl和l mol·L-1NaOH分别调节pH为1.3、3.3、5.3、6.3、7.3、9.3,反应12 h后以鼠伤寒沙门菌作为指示菌,冠突散囊菌Ec-12株上清为对照,参照上节琼脂扩散法测定Ec-12株抑菌活性,重复3次,根据抑菌圈直径变化评估冠突散囊菌Ec-12株上清抑菌的酸碱稳定性。
1.2.6.2 热稳定性:取15 mL冠突散囊菌Ec-12株上清于35、50、65、80、95、110 ℃分别处理1 h后,以鼠伤寒沙门菌作为指示菌,发酵原液为对照,照上节琼脂扩散法测定Ec-12株抑菌活性,重复3次。根据抑菌圈直径变化考察其抑菌的热稳定性。
1.2.6.3 紫外稳定性:取15 mL冠突散囊菌Ec-12株上清,放置25 W紫外灯下,距离35 cm,分别照射2、4、6、8、10、12 h,以鼠伤寒沙门菌作为指示菌,照上节琼脂扩散法测定Ec-12株抑菌活性,重复3次。根据抑菌圈直径变化考察其抑菌的紫外光稳定性。
1.2.7 冠突散囊菌Ec-12株上清的抑制鼠伤寒沙门菌扫描电镜观察 Ec-12株在28 ℃ 下增殖120 h,2 000 r·min-1离心取上清,按1%的添加剂量,加入新增殖的鼠伤寒沙门菌(浓度107CFU·mL-1)37 ℃ 180 r·min-1震荡培养6 h,然后从对照组和Ec-12上清处理组分别取0.5 mL 鼠伤寒沙门菌菌液,离心并用PBS洗3次,将菌体再分别加入0.5 mL戊二醛固定,然后将样品固定在石墨带上,并在每个样品上涂上大约 24.5 nm 的薄金涂层,随后在扫描电子显微镜获得高分辨率图像。
1.2.8 冠突散囊菌Ec-12株上清的抑制鼠伤寒沙门菌试验 取7日龄BALB/c小鼠30只,分为空白组、试验组和对照组3组,每组各10只,公母各半。空白组灌服等量PDB培养基的上清。对照组灌服0.5 mL新增殖的鼠伤寒沙门菌(浓度107CFU·mL-1)。试验组灌服0.5 mL新增殖的鼠伤寒沙门菌(浓度107CFU·mL-1)4 h后,紧接着灌服3次冠突散囊菌Ec-12株上清,每次1 mL,中间间隔8 h。对照组则灌服3次的PDB培养基的上清。每次也是1 mL,中间间隔8 h。观察并记录小鼠腹泻及死淘率。取两组小鼠的结肠,4%多聚甲醛内固定24 h,然后按HE、PAS和Tunel染色试验操作规程进行梯度脱水。脱水结束后,对结肠组织进行石蜡包埋,按5 μm厚度切片,接着进行脱蜡然后分别用苏木素、伊红染色、PAS和Tunel染色,脱水透化封片,再置显微镜下观察并记录。
1.2.9 数据分析 数据分析采用 Excel 2017、SPSS19.01和GraphPad Prism 9.0.0(121) 软件进行。PAS和Tunel染色差异性分析使用Image J软件进行。
2 结 果
2.1 冠突散囊菌菌株Ec-12的鉴定
2.1.1 冠突散囊菌菌株Ec-12的形态及生理生化特征 菌株Ec-12在PDA培养基上生长良好,菌丝呈放射状生长(图1A),24 h后菌丝颜色呈深黄色(图1B),菌落直径近0.5 cm。72 h菌丝颜色呈褐色,之前周边的淡黄色开始出现黑褐化(图1C),再持续培养菌落颜色全部变成褐色。菌株Ec-12在PDB液体培养基上生长时起24 h,可见小个的絮状菌丝,随着震荡培养时间的延长,菌丝的团状越大,成散花状分布于PDB(图1D)。将菌液接种至加工好的商品红茶,28 ℃培养120 h,可见茶叶中长出金色的冠突散囊菌孢子囊,20倍的显微镜下,可见散花状的金色冠突散囊菌孢子囊(图1E)。
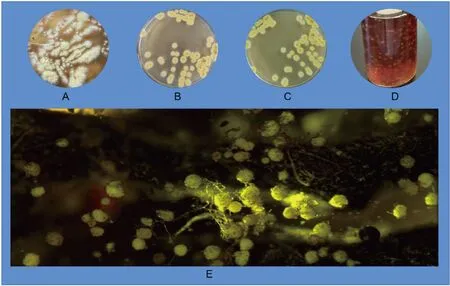
A. 生长24 h;B. 生长48 h; C. 生长72 h;D. 菌株Ec-12在PDB培养基中生长;E. 菌株 Ec-12接种至散茶中生长120 h(10×20倍的光学显微镜)A. Grow for 24 h; B. Grow for 48 h; C. Grow for 72 h; D. strain Ec-12 was grown in PDB medium; E. Ec-12 was inoculated and grown in loose tea for 120 h
2.1.2 冠突散囊菌Ec-12株的 ITS rRNA 基因序列分析 提取冠突散囊菌Ec-12株基因组 DNA,以其为模板,利用真菌的通用引物对其ITS rRNA 基因序列进行扩增和测序,获得长度为 1 300 bp 的序列,并提交至GenBank 数据库,登录号为 OM567391。在 NCBI数据库中经 BLAST比对后,发现菌株 Ec-12的ITS rRNA 基因序列与Aspergillussp、Aspergilluscristastus和Eurotiumsp菌等多个菌株的ITS rRNA 基因序列相似度在 97%以上。选择部分曲霉菌ITS rRNA基因序列,利用 MEGA 7.0 软件中的邻接法构建系统发育树。结果表明,菌株Ec-12与Aspergillussp及Eurotiumsp有一定差别,且处于一个新的分支(图2)。结合形态和生理生化特征,将菌株Ec-12鉴定为新Eurotiumsp。

分支处数值表示 bootstrap 值;括号后的数值为 GenBank 登录号;标尺代表进化距离 Values at branch represent bootstrap; values in parentheses are GenBank accession number; ruler represents evolutionary
2.1.3 冠突散囊菌Ec-12株生长特性分析 冠突散囊菌Ec-12株在初始12 h生长较为缓慢,菌丝体的干物质量较低,在24 h后,冠突散囊菌Ec-12株开始适应生长环境,吸收培养基中的碳源等营养物质,促使无性孢子迅速萌发生长,使得前菌丝体干物质的量成倍增加,在恒温震荡培养近84 h,菌丝体的干物质的量达到了峰值0.058 g·mL-1(见图3)。然后随着培养时间的延长,新产生菌丝体的干物质量则开始下降,到196 h时,新菌丝体干质量则只有0.002 g·mL-1。
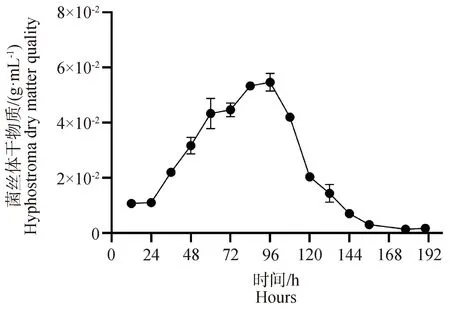
图3 冠突散囊菌Ec-12株不同生长时间菌丝体的干物质量的变化Fig.3 Changes in dry mass of mycelium at different growth times of EC-12 strain
2.2 菌株Ec-12上清的抑菌试验
之前研究报道,冠突散囊菌可提高人体免疫功能、抗氧化和抑菌等多种的医药学价值,为验证菌株Ec-12对食物中常规有害菌的抑制作用。本研究通过琼扩试验开展冠突散囊菌抑菌作用验证,结果证实冠突散囊菌Ec-12株可以抑制金黄色葡萄球菌、福氏志贺菌和鼠伤寒沙门菌。其中尤以抑制鼠伤寒沙门菌作用最为明显(图4A~C),抑菌圈达到(10.4±1.5) mm,相较金黄色葡萄球菌[(8.3±1.2) mm]和福氏志贺菌的抑菌圈[(7.9±2.1) mm]差异显著(P<0.05)(表1)。提取菌株Ec-12上清加入新培养的鼠伤寒沙门菌液,培养6 h后,取1 mL菌液进行扫描电镜观察,结果发现处理组箭头标注处出现明显菌体变形,且覆盖颗粒状物质。而对照组的鼠伤寒沙门菌液菌体结构完整,菌体外层光滑,菌体形态完整。提示提取菌株Ec-12上清对致病的鼠伤寒沙门菌抑制作用明显。

表1 冠突散囊菌Ec-12株对 3种不同食品源的致病菌的拮抗作用
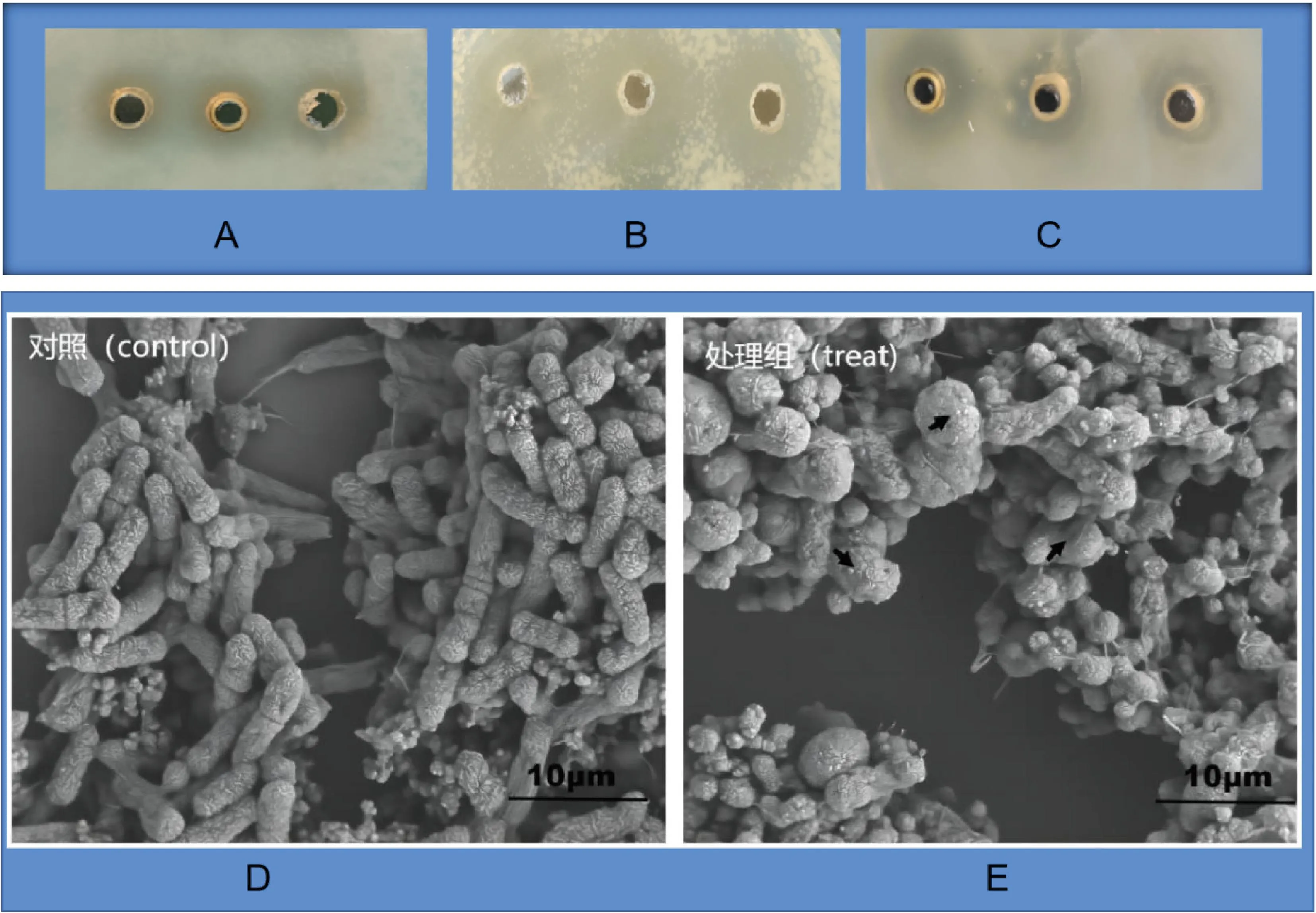
A. 金黄色葡萄球菌;B. 鼠伤寒沙门菌;C. 福氏志贺菌;D.对照组(鼠伤寒沙门菌);E.处理组(冠突散囊菌Ec-12株上清处理后鼠伤寒沙门菌), 处理组箭头标注处明显菌体变形,且覆盖颗粒状物质A. Staphylococcus aureus; B. Salmonella Typhimurium; C. Shigella flexneri; D. Control group (Salmonella Typhimurium); E. Treatment group (Salmonella Typhimurium treated with supernatant of crown-cyst Ec-12 strain), there is obvious bacterial deformation at the arrow mark of the treatment group, and covered with granular materials

图5 菌株Ec-12抑制鼠伤寒沙门菌引起小鼠的腹泻率变化Fig.5 Changes in diarrhea rate in mice caused from Salmonella Typhimurium inhibition by Ec-12 strain

图6 菌株Ec-12抑制鼠伤寒沙门菌引起小鼠的致死率变化Fig.6 Changes in diarrhea rate in mice caused from Salmonella Typhimurium inhibition by Ec-12 strain
2.3 菌株Ec-12上清的抑菌稳定性
2.3.1 酸碱稳定性 冠突散囊菌株Ec-12的上清经不同pH酸碱处理,均表现出较强的抑制活性,在酸性较低时,冠突散囊菌株Ec-12的上清表现出的抑制活性更强,抑菌圈直径达(10.4±1.1) mm,比对照组(未加酸处理时的上清)还大,这可能是因为酸性对鼠伤寒沙门菌的抑制作用的叠加引起。在pH为9.3时,抑菌圈直径达(9.3±1.3) mm,明显大于对照组,这个结果可能是过高碱性的pH对鼠伤寒沙门菌的增殖起到抑制作用。当pH在5.3~7.3的范围内时,抑菌圈直径为10.0 mm与未处理组并没有明显的变化。说明冠突散囊菌株Ec-12的上清在不同的pH值条件下都表现了较强的抑菌作用,抑菌物质具有一定的耐酸碱能力。
2.3.2 热稳定性 冠突散囊菌株Ec-12的上清经过不同温度的热处理,均表现较强的抑菌作用。在室温时抑菌圈是(10.1±2.2) mm,随着处理冠突散囊菌株Ec-12的上清温度的升高,其抑菌作用稍有减弱,50 ℃时(10.1±1.4) mm,65 ℃时(9.9±3.1) mm,80 ℃(10.1±1.5) mm,95 ℃(9.8±2.5) mm,其中经110 ℃热处理的发冠突散囊菌株Ec-12的上清对鼠伤寒沙门菌的抑菌圈直径为对照组的96.03%(降低幅度为3.97%)。因此,说明热处理对冠突散囊菌株Ec-12的上清的抑菌作用影响不大,抑菌物质具有一定的热稳定性。
2.3.3 紫外光稳定性 冠突散囊菌株Ec-12的上清经过不同时间紫外光照射后,随着照射时间的延长其抑菌作用减弱,抑菌圈直径从9.9 mm逐渐下降到9.6 mm,其中经12 h紫外光照射处理的冠突散囊菌株Ec-12的上清对鼠伤寒沙门菌的抑菌圈直径为对照组的96.9%,下降了3.1%。该结果表明紫外光照射对冠突散囊菌株Ec-12的上清存在一定影响,但并不是影响其抑菌鼠伤寒沙门菌增殖活性的主要因素,该结果在一定层面证实冠突散囊菌株Ec-12的上清在紫外光照射的条件下能够相对稳定地保持抑菌活性。
2.4 菌株Ec-12上清减少小鼠腹泻率和致死率
为了进一步验证冠突散囊菌Ec-12对鼠伤寒沙门菌的抑制作用,本研究选取7日龄BALB/c小鼠30只,分为空白组、试验组和对照组三组,每组各10只,公母各半。结果发现,空白组小鼠未见腹泻及死亡,采食及饮水正常。试验组小鼠只在开始12 h,2只出现轻微的腹泻症状,随着冠突散囊菌Ec-12上清的持续灌服,小鼠不再出现腹泻,精神状态正常。而对照组出现腹泻严重,持续至试验结束(图 5)。从小鼠死淘率结果可看出,试验组只出现1只死亡,而对照组出现6只死亡,死淘率高(图 6)。此外,结合HE结果,对照组的小鼠结肠的绒毛出现严重的脱落和断裂,隐窝破坏明显;而试验组则结肠的绒毛只出现轻微的影响,隐窝未见明显影响(图7B),说明冠突散囊菌Ec-12株上清对鼠伤寒沙门菌引起腹泻及发病有一定的作用。
2.5 菌株Ec-12上清缓解了鼠伤寒沙门菌对小鼠肠道黏膜损伤
为了进一步验证冠突散囊菌Ec-12上清对小鼠伤寒沙门菌的抑制作用,本研究通过结肠HE染色结果发现,对照组的小鼠结肠的绒毛出现严重的脱落和断裂,隐窝的破坏明显(图7B)。而试验组则结肠的绒毛只出现轻微的影响,隐窝未见明显影响(图7C)。PAS染色结果表明冠突散囊菌Ec-12株上清明显增加结肠黏蛋白含量(图 7E~G),与对照组相比,差异显著(P<0.05)(图7A③)。和空白组相比,呈下降的趋势,但差异不明显(P>0.05)。结肠的Tunel染色结果表明,与对照组相比,冠突散囊菌Ec-12株上清明显减少结肠细胞的凋亡率,差异显著(P<0.05)。和空白组相比,呈下降的趋势,但差异不明显(P>0.05)(图8)。

A. 肠道结构统计指标(***. P<0.05);B~D. HE染色;E~G. PAS染色;B、E. 对照组(对照组灌服鼠伤寒沙门菌);C、F.菌株Ec-12上清灌服组(试验组为灌服鼠伤寒沙门菌后又灌服菌株Ec-12上清组);D、G.空白组(空白组为只灌服等量PBS)A. Statistical indicators of intestinal structure (***. P<0.05); B-D. HE staining; E-G. PAS staining; B, E. Control group (received Salmonella Typhimurium); C, F. Supernatant irrigation treated group of strain Ec-12 (experimental group received Salmonella Typhimurium and Ec-12 strain); D, G. Mock group (the equal amount of PBS was administered) 图7 菌株Ec-12抑制鼠伤寒沙门菌引起小鼠肠道显微结构变化Fig.7 Inhibition of Salmonella Typhimurium by strain Ec-12

A. 对照组(对照组灌服鼠伤寒沙门菌);B.菌株Ec-12上清灌服组(试验组为灌服鼠伤寒沙门菌后又灌服菌株Ec-12上清组);C.空白组(空白组为只灌服等量PBS);D. 结肠细胞的凋亡率(***. P<0.05) A. Control group (received Salmonella Typhimurium); B. Supernatant irrigation treated group of strain Ec-12 (experimental group received Salmonella Typhimurium and Ec-12 strain); C. Mock group (the equal amount of PBS was administered); D. Apoptosis rate of colon cells (***. P<0.05)
3 讨 论
冠突散囊菌俗称“金花菌”常见于茯砖茶。而金花的实质就是冠突散囊菌第一层闭囊壳呈现出来的金黄色[13]。早期蔡正安等[14]模拟茯砖茶成型工艺和发花工艺,用非黑茶茶类和药用植物枝叶为发花基质材料,在未接种冠突散囊菌的条件下成功发出“金花”试验。近几年报道认为,大部分冠突散囊菌菌株可在改良查氏培养基和马铃薯葡萄糖培养基中生长,且其最适宜生长和产子囊孢子的温度是25~35 ℃,pH值接近5[15]。此外,周杨艳等[16]认为在液态培养条件下,冠突散囊菌在添加黑茶汤培养基中生长较好。本研究发现菌株Ec-12在PDA培养基和28 ℃条件下生长良好,Ec-12菌株的黄色囊壳在24 h颜色开始变深呈金黄色,且在PDB液态培养时,未加黑茶茶汤,生长良好。此外,冠突散囊菌在恒温震荡培养近84 h,菌丝体的干物质量达到了锋值。随着培养时间的延长,新产生菌丝体的干物质量则开始下降,至196 h时,新菌丝体干物质量达新低。研究认为后期菌丝体干物质量减少,也可能是由于菌丝体自溶造成。上述Ec-12菌株生长条件验证试验结果皆表明,Ec-12菌株生长稳定性较好,具有应用于生产的潜力。该结果为后续产业化生产提供一定参考。
冠突散囊菌(Eurotiumcristatum)是散囊菌目发菌科散囊菌属的成员。有研究表明E.cristatum可用于调节血液/脂质平衡和胆固醇代谢,增强免疫力,减轻肥胖和调节肠道菌群[17-21],作者之前的研究也发现,携带有冠突散囊菌的茶叶粉,能明显降低小鼠的高血脂质、高糖和胆固醇[5]。李响[11]报道冠突散囊菌的次级代谢产物具有抑制细胞生长的作用,在抗癌、抗肿瘤的应用上有很重要的参考价值。有研究从海藻中提取分离的内生真菌冠突散囊菌可产生蒽醌类化合物,具有止血、抗菌、泻下、利尿的作用[21];有报道称E.cristatum滤液对一些细菌或真菌菌株(如金黄色葡萄球菌、大肠杆菌和稻瘟病菌)具有显著的抑制活性[22-23]。覃金球[24]研究发现冠突散囊菌发酵液对金黄色葡萄球菌、大肠杆菌和枯草芽胞杆菌等有较强的抑制作用。而鼠伤寒沙门菌是一种常导致肠道感染的重要人畜共患病的食源性致病菌,它主要通过污染的食物或水经粪口传播,经胃入肠后,在肠道内增殖,黏附于肠黏膜上皮细胞,进而侵入固有层,引起的症状轻至肠炎重至败血症和全身系统性播散引起的内脏损害。本研究在体外试验发现E.cristatum上清液确实能明显抑制鼠伤寒沙门菌。且在电镜下也观察到Ec-12菌上清液引起鼠伤寒沙门菌变形,并在表层覆盖一层颗粒样物,影响了鼠伤寒沙门菌增殖。该结果与覃金球研究发现冠突散囊菌发酵液抑制金黄色葡萄球菌增殖是通过抑制生物膜的形成[24]有些类似,但并不完全一样,Ec-12菌上清液主要是引起鼠伤寒沙门菌大量的变形,最终影响了它的增殖。此外,耐热、耐酸碱及紫外稳定性试验也揭示,该菌株的上清在pH、温度和紫外光的作用下,有较稳定的抑制活性。
为了进一步揭示Ec-12菌上清液抑制小鼠的鼠伤寒沙门菌的初步机制,本研究选取7日龄BALB/c小鼠罐服试验,发现Ec-12上清明显抑制鼠伤寒沙门菌引起的腹泻和死亡。之前的报道认为E.cristatum产生的代谢物能抑制B.subtilis的生长[24]。E.cristatum的代谢物,如 cristatumin A、cristatumin D 和 3-O-(aD-呋喃核糖基) 可抑制某些细菌和真菌(如枯草芽胞杆菌、和金黄色葡萄球菌)[25-30]。因此,作者推测E.cristatum菌株Ec-12上清对金黄色葡萄球菌、鼠伤寒沙门菌和福氏志贺菌三种有害菌的抑制作用可能是由E.cristatum合成的次生代谢物引起,但详细的抑制机理及活性物质种类还有待后续进一步研究。
众所周知,人体和动物的免疫系统逾50%位于结肠[31]。结肠作为消化吸收的尾端,既承担吸收和分泌,又协助排粪的作用。因此,结肠紊乱会导致体内的毒素累积,造成体臭、口臭、皮肤暗晦、皮肤过敏、发疹及色素斑等等问题。结肠的炎症常伴随着大量的体内毒素累积也会加重肾脏和肝脏的负担,进而损及其它重要器官[32-33]。因此,为了进一步揭示这种抑制作用的初步机制,作者重点对鼠结肠进行HE、PAS和Tunel染色,结果发现Ec-12上清确实能保护结肠绒毛的完整,增加结肠壁黏液蛋白的分泌,减少了结肠细胞的凋亡。肠绒毛位于小肠的上皮和固有层向肠腔隆起的指状突起,内含有血小板,由固有膜和上皮向肠腔面突起形成,它不仅具有吸收养料的作用,同时肠绒毛也起到免疫防护屏障作用,它和黏液蛋白都是黏膜免疫系统的一部分[34]。
4 结 论
通过本研究得出初步的抑制机制,Ec-12菌株上清一方面直接作用于鼠胃肠道内的鼠伤寒沙门菌,破坏了鼠伤寒沙门菌结构完整性,同时又作用于鼠的肠道,维护了肠绒毛完整,促进了结肠黏液蛋白的分泌,减少了结肠细胞的凋亡,进而降低鼠伤寒沙门菌引起的腹泻及死亡。
