恶性肿瘤治疗后患者辅助生殖助孕结局影响因素分析
2024-03-01李月红方华蒋冬冬蔡雪芬杨晓慧郑备红孙艳
李月红,方华,蒋冬冬,蔡雪芬,杨晓慧,郑备红,4,孙艳,5*
(1.福建医科大学妇儿临床医学院,福州 350001;2.福建医科大学公共卫生学院,福州 350001;3.福建省妇幼保健院生殖医学中心,福建医科大学妇儿临床医学院,福州 350001;4.福建省产前诊断与出生缺陷重点实验室,福州 350001;5.福建省母胎医学临床医学研究中心,福州 350001)
随着恶性肿瘤患者发病的年轻化、生存期的延长以及初次生育年龄的推迟,有生育需求的育龄期恶性肿瘤患者比例逐渐增加,生育问题逐渐成为衡量其生活质量的关键指标[1]。辅助生殖技术(ART)是治疗不孕症的重要手段,迄今为止,关于恶性肿瘤育龄期女性ART治疗的安全性和有效性也是生殖医生关注的重点。尽管有多项研究已证实恶性肿瘤患者行ART助孕具有一定的安全性[2-4],但关于恶性肿瘤治疗后患者ART助孕结局的影响因素分析报道较少。因此,本研究旨在通过回顾性分析,比较恶性肿瘤治疗后不孕症女性与年龄匹配的非恶性肿瘤患者接受ART助孕结局的差异并分析其影响因素,以期为临床实践提供更实用的指导。
资料与方法
一、研究对象
采用回顾性病例对照研究,分析2003年1月至2021年10月在福建省妇幼保健院生殖医学中心接受体外受精/卵胞浆内单精子注射(IVF/ICSI)助孕治疗的不孕症女性的临床资料。
将首次接受IVF/ICSI助孕、既往恶性肿瘤病史的不孕症女性作为病例组,共纳入62例。根据年龄及取卵时间采用1∶2匹配的方式(每对匹配病例之间的年龄差不超过1岁、取卵时间控制在同1个月内),选取同期首次接受IVF/ICSI助孕治疗的未罹患恶性肿瘤患者作为对照组,共纳入124例。排除复发性流产患者、行胚胎植入前遗传学检测者、生殖系统畸形患者及资料不完整者。
不孕症诊断:夫妻双方未采取避孕措施,有规律性生活至少12个月未能获得临床妊娠。
两组患者ART程序一致,严格遵循本中心ART治疗流程。
本研究符合《赫尔辛基宣言》,经福建省妇幼保健院伦理委员会批准免除签署知情同意书(伦理号2022KYLLR01027)。
二、诊疗回顾
1.控制性促排卵:(1)早卵泡期长方案:在月经周期第2~5天注射促性腺激素释放激素激动剂(GnRH-a)3.75 mg进行降调节。28~35 d后评价垂体降调效果,若达到降调标准则给予促性腺激素(Gn)启动。当1个主导卵泡直径≥20 mm或3个主导卵泡直径≥17 mm,注射人绒毛膜促性腺激素(HCG)6 000~10 000 U扳机。垂体降调标准:血清雌二醇(E2)<50 pg/ml(183 pmol/L),卵泡刺激素(FSH)、黄体生成素(LH)均<5 U/L,无卵泡直径>10 mm,子宫内膜厚度<5 mm。(2)黄体期长方案:于月经期第3天开始口服避孕药21 d,在服避孕药的同时于月经周期第18天予短效GnRH-a 0.1 mg,达降调标准后给予Gn启动。当1个主导卵泡直径≥20 mm或3个主导卵泡直径≥17 mm时注射HCG 6 000~10 000 U扳机。(3)拮抗剂方案:于月经周期第2~3天启动Gn促排卵。采用固定方案或灵活方案给予GnRH拮抗剂0.25~0.5 mg/d直至扳机日。当2个主导卵泡直径≥18 mm或3个主导卵泡直径≥17 mm时注射HCG 6 000~10 000 U扳机或GnRH-a+HCG 2 000 U双扳机。(4)微刺激方案:于月经周期第2~5天开始连续5 d口服来曲唑5 mg/d,并给予人绝经期促性腺激素(HMG)75~150 U/d,根据卵泡生长和血清激素水平调整Gn剂量。当优势卵泡直径达18~20 mm时,注射HCG 10 000 U扳机。(5)高孕激素状态下促排卵方案(PPOS):于月经周期第2~3天开始口服醋酸甲羟孕酮8 mg/d至扳机日,同时启动Gn 150~300 U/d促排卵;当优势卵泡直径达18~20 mm,采用HCG 10 000 U扳机。(6)自然周期方案:月经周期第10天左右,根据卵泡发育情况每2~3 d返院定期超声监测卵泡发育,当优势卵泡直径达18~20 mm,予HCG 10 000 U扳机。
2.取卵、授精、胚胎移植:按照扳机标准进行扳机,36 h后在B超引导下经阴道穿刺取卵,根据男方精液情况进行IVF或ICSI;体外培养72 h(D3),若形成可移植胚胎,根据患者情况选择移植或冷冻卵裂期胚胎;剩余胚胎经患者知情同意后进行囊胚培养,对评分达到4BC及以上的囊胚进行移植或冷冻。卵裂期胚胎分级评分参照伊斯坦布尔共识[5],囊胚评分参照人类体外受精-胚胎移植(IVF-ET)实验室操作专家共识[6]。胚胎移植后给予黄体支持,移植后14 d检测β-HCG水平,移植后35 d行B超检查确定临床妊娠情况。
三、资料收集/随访及观察指标
通过医疗记录和电话随访获取恶性肿瘤患者肿瘤治疗史、辅助生殖助孕情况、妊娠结局情况等资料。随访截止日期至2022年10月30日。
受精率=D1出现双原核(2PN)及两个极体(2PB)卵子数/(IVF加精卵子数+注射MⅡ卵子总数)×100%;卵裂率=卵裂胚胎数/正常受精卵子数×100%;优质胚胎率=D3优质胚胎数/正常受精卵子数×100%;囊胚形成率=(D5/D6囊胚数)/用于培养囊胚的D3胚胎数×100%;累积妊娠率=超声可见孕囊的患者数/取卵周期的患者数×100%;每移植周期临床妊娠率=超声可见孕囊的周期数/移植周期总数(包括新鲜移植周期及冻融移植周期)×100%;每妊娠所需取卵周期数=取卵周期总数/临床妊娠周期总数;每妊娠所需移植周期数=移植周期总数(包括新鲜移植周期及冻融移植周期)/临床妊娠周期总数;每妊娠所需胚胎数=移植胚胎总数(包括新鲜胚胎及冻融胚胎移植)/临床妊娠周期总数。
临床妊娠的定义为胚胎移植术后35 d经超声检查发现子宫腔内至少有1个妊娠囊。
四、统计分析

结 果
一、病例组肿瘤治疗情况
病例组纳入62例恶性肿瘤治疗后的不孕症女性,主要肿瘤类型为甲状腺癌及卵巢交界性肿瘤,大部分患者均接受了手术治疗(表1)。

表1 病例组罹患恶性肿瘤类型及治疗情况
二、两组患者一般资料比较
本研究纳入了62例恶性肿瘤治疗后首次接受IVF/ICSI助孕治疗的不孕症女性(病例组),以及124例同期首次接受IVF/ICSI助孕治疗的未罹患恶性肿瘤的不孕症女性(对照组)。
两组患者不孕因素均以输卵管因素为主,病例组卵巢储备功能减退(DOR)占比高于对照组,组间不孕因素有统计学差异(P<0.05);病例组基础窦卵泡计数(AFC)显著低于对照组(P<0.05);两组患者间年龄、不孕年限、体质量指数(BMI)、基础性激素[FSH、LH、E2、睾酮(T)]水平、抗苗勒管激素(AMH)水平等比较均无统计学差异(P>0.05)(表2)。
表2 两组患者一般资料比较[(-±s),n(%)]
在随访期间所有病例组患者均存活,未发现肿瘤复发或新发肿瘤的情况。中位随访时间为56.37(39.52,87.30)个月。
三、两组患者首次IVF/ICSI助孕促排卵情况及实验室指标比较
病例组以早卵泡期长方案、微刺激方案、拮抗剂方案为主要促排卵方案,对照组以早卵泡期长方案和黄体期长方案为主要促排方案,组间促排卵方案有统计学差异(P<0.05)。与对照组比较,病例组Gn使用总量显著减少、Gn刺激天数显著缩短(P<0.05);两组间授精方式、获卵数、受精率、卵裂率、优质胚胎形成率、囊胚形成率方面比较均无统计学差异(P>0.05)(表3)。
表3 两组患者首次IVF/ICSI助孕的促排卵结局和实验室指标比较[(-±s),%,n(%)]
四、两组患者累积助孕周期妊娠结局比较
本研究中纳入患者累计完成335个移植周期。病例组累计移植110个移植周期,其中46个移植周期获得临床妊娠;对照组累计移植225个移植周期,其中110个移植周期获得临床妊娠。整个队列最终有142人获得临床妊娠,其中病例组43人、对照组99人。
两组患者在累积妊娠率、每移植周期的临床妊娠率、每妊娠所需取卵周期数、每妊娠所需移植周期数、每妊娠所需移植胚胎数、每妊娠所需移植优质胚胎数方面,差异均无统计学意义(P>0.05)(表4)。
五、影响ART助孕临床妊娠的关键因素
以是否获得临床妊娠为因变量,对本研究所有纳入患者(包括病例组及对照组)行ART助孕后的临床妊娠结局进行单因素Logistic回归分析,结果显示年龄、移植胚胎数、移植次数、HCG日子宫内膜厚度、AFC、获卵数、移植优质胚胎数有统计学意义(P<0.05)(图1);进一步将有意义的指标纳入多因素Logistic回归分析,结果显示,恶性肿瘤病史不是ART妊娠结局的影响因素[OR=1.683,95%CI(0.736,3.847),P=0.217],而年龄[OR=0.850,95%CI(0.776,0.932),P<0.001]和获卵数[OR=1.121,95%CI(1.023,1.228),P=0.014]是ART妊娠结局的独立影响因素,年龄越小、获卵数越多,妊娠几率越大(图2)。
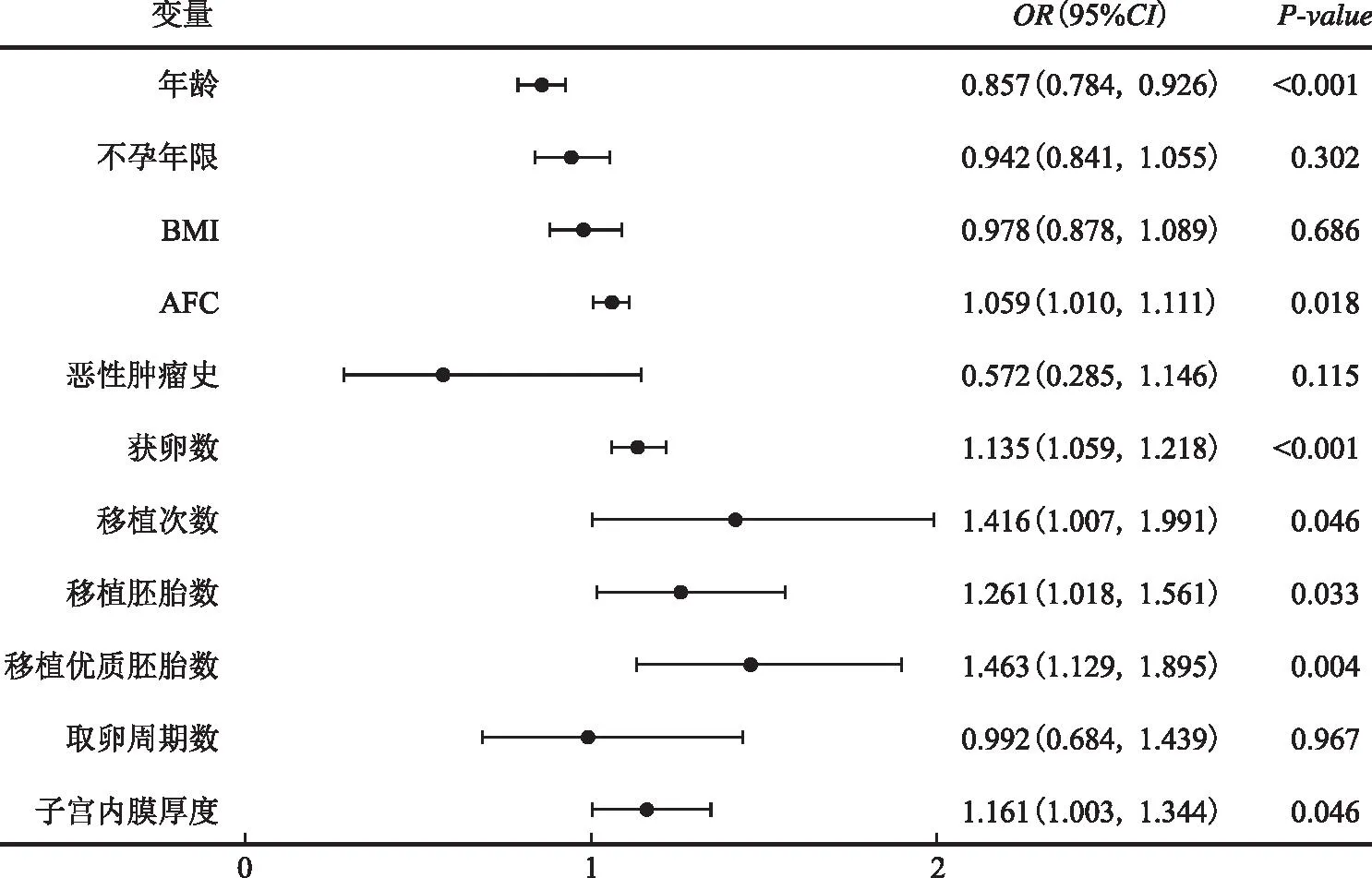
图1 临床妊娠单因素Logistic回归分析结果

图2 临床妊娠多因素Logistic回归分析结果
六、影响恶性肿瘤患者ART临床妊娠的关键因素及其预测准确度
恶性肿瘤患者(病例组)临床妊娠的单因素Logistic回归分析显示,年龄和获卵数是临床妊娠的影响因素(P<0.05)(图3);进一步行多因素Logistic回归分析显示,获卵数[OR=1.150,95%CI(1.023,1.293),P=0.020]是恶性肿瘤患者术后ART助孕妊娠结局的唯一的独立影响因素,而年龄没有显示相关性[OR=0.917,95%CI(0.812,1.036),P=0.164](图4)。

图3 恶性肿瘤患者临床妊娠单因素Logistic回归分析结果

图4 恶性肿瘤患者临床妊娠多因素Logistic回归分析结果
分别将年龄、获卵数以及两者联合的Logistic回归分析结果作为预测指标对恶性肿瘤患者术后ART助孕妊娠结局进行预测效力分析:获卵数(AUC=0.755,P=0.001)在预测临床妊娠结局方面优于年龄(AUC=0.628,P=0.112),而年龄与获卵数联合预测临床妊娠效力高于单个指标预测(AUC=0.786,P<0.001)。根据约登指数计算相应的诊断界值:年龄联合获卵数的最佳诊断界值点为获卵数为8枚、年龄41岁,敏感度为0.737,特异度为0.814(图5)。

A:年龄;B:获卵数;C:年龄联合获卵数。图5 预测恶性肿瘤患者妊娠结局的ROC曲线
讨 论
虽然恶性肿瘤患者总体存活率正在上升[7],但女性恶性肿瘤术后怀孕的几率仍较普通女性低40%[8]。手术、放疗、化疗是肿瘤治疗常见手段,确保肿瘤预后的同时也带来生育力下降的远期副作用,其相关的生殖细胞毒性作用、卵巢储备功能降低和早绝经风险增加[9]。AMH和AFC是预测卵巢储备功能的重要因子[10-11]。本研究中女性恶性肿瘤术后AFC、AMH较非恶性肿瘤女性低,与既往文献报道[12]一致。相对于非肿瘤患者而言,女性恶性肿瘤患者在抗肿瘤治疗后存在卵巢储备功能降低的风险。因此,关注肿瘤预后的同时,肿瘤患者的生育问题也是亟需解决的临床问题。
年轻的恶性肿瘤患者往往需要借助ART帮助实现生育愿望。据报道,恶性肿瘤患者接受ART治疗的几率是一般人群的2倍[13]。目前已有越来越多的研究证实,部分恶性肿瘤患者接受ART治疗是安全的[2-4],但关于ART治疗后能否提高恶性肿瘤患者的妊娠率尚无定论。有小型研究报道,保留生育能力治疗的年轻子宫内膜癌或子宫内膜非典型增生患者有78.7%通过ART治疗实现临床妊娠[14]。Condorelli等[15]对乳腺癌治疗后患者进行多中心回顾性队列研究,超过8年的随访结果表明,相较于自然过程,接受ART治疗的乳腺癌患者具有更高的妊娠率(59% vs. 26%,P=0.001)。国内学者李静等[16]研究表明,与年龄匹配的普通不孕症女性相比,接受IVF/ICSI治疗的恶性肿瘤患者累积妊娠率相仿(67.9% vs. 70.4%,P=0.546)。这表明恶性肿瘤患者通过ART治疗可以获得良好的妊娠结局。与之相反,有限的数据显示,女性恶性肿瘤患者接受ART治疗并没有明显提高妊娠率[17]。需要强调的是,恶性肿瘤疾病本身是导致不孕症风险增加的原因之一[18],部分研究存在未调整混杂因素(如不孕病史、年龄等)以及纳入参考人群不同等问题,故导致研究结论存在不一致。在本研究中,恶性肿瘤患者与年龄匹配的健康不孕女性相比累积助孕结局相似,虽然累积妊娠率、每移植周期临床妊娠率略低,但差异无统计学意义(P>0.05),与李静等[16]研究结果一致。
迄今为止,恶性肿瘤病史对于ART助孕结局的影响仍存在争议。Meernik等[19]的Meta分析认为恶性肿瘤病史对ART助孕结局产生负面影响。需要强调的是,该研究中存在显著异质性且缺乏对年龄的校正。在调整年龄后,Huang等[20]对64例甲状腺癌不孕症女性的回顾性分析表明,甲状腺癌病史不会影响首次IVF/ICSI助孕的妊娠结局,但可能会使获卵数和高质量胚胎数降低。卵母细胞及纳入的肿瘤类型不同可能解释这些差异。Luke等[21]研究表明,使用自体卵母细胞的恶性肿瘤患者术后ART妊娠的可能性降低,并且因恶性肿瘤类型有所不同,然而使用供体卵母细胞的恶性肿瘤患者术后ART妊娠率与非恶性肿瘤女性相似。我们的研究结果支持Luke等[21]的结论,本研究中多因素Logistic回归表明恶性肿瘤病史不是ART妊娠结局的影响因素,而获卵数是恶性肿瘤患者术后ART妊娠结局的独立影响因素,获卵数越多,妊娠机会越大。值得一提的是,恶性肿瘤患者通常被认为是卵巢低反应人群[22-24],然而本研究中恶性肿瘤患者Gn刺激剂量低、Gn刺激天数短,但获卵数并未显著低于对照组。可能的解释:一方面,本研究纳入的肿瘤患者年轻、预后好,肿瘤类型恶性程度低者占比多;另一方面,促排卵方案的差异以及Gn使用策略的不同。这些可能是肿瘤患者获卵数较好的原因。受限于研究样本量,进一步分层研究结果的可靠性、准确性难以把握,本研究未对肿瘤类型及促排卵方案进一步研究。
ART治疗后怀孕的机会是生殖医生与肿瘤患者共同关注的焦点。然而,迄今为止,尚无可靠的预测指标可以为恶性肿瘤患者提供生育咨询。尽管卵巢标志物对卵巢储备功能的预测能力极佳,但对于ART成功率的预测价值有限[25]。获卵数是ART助孕成功与否的重要指标。现有数据表明,ART的妊娠率与获卵数直接相关[26-27]。我们的研究支持既往研究结论,本研究中获卵数与妊娠结局呈正相关,其预测妊娠结局的AUC为0.755,提示获卵数具有良好的预测价值。与预期结果不同的是,母亲年龄通常被认为是ART妊娠结局的独立影响因素[28]。研究表明,对于进行辅助生殖的≥35岁的女性,年龄每增加1~2岁,累积妊娠率降低约10%[29]。本研究中年龄作为单一指标并没有显示出较高的预测价值,而年龄联合获卵数预测妊娠结局的AUC=0.786,大于单个指标预测。分析可能的原因:一方面,随着年龄增加获卵数减少,同时伴随着卵子、胚胎质量下降以及染色体非整倍风险增加[30]。而本研究纳入肿瘤患者的平均年龄大于35岁,干扰了年龄对于妊娠结局的预测效力。另一方面,实际年龄与生殖年龄不同且受限于研究的样本量,年龄未呈现出阳性结果。此外,本研究发现当恶性肿瘤患者年龄>41岁、获卵数<8个时获得妊娠的可能性较低。需要强调的是,即使仅有1个获卵数也存在妊娠的机会,因此,该诊断界值仅作为参考。对于高龄、获卵数极少的恶性肿瘤患者也不应拒绝ART治疗,尤其是尚未完成生育计划的患者。
综上所述,育龄期女性恶性肿瘤术后患者行ART助孕可以获得良好的妊娠结局,术后评估其获卵数的水平结合患者年龄可以有效预测妊娠结局。既往恶性肿瘤病史不应该限制ART的使用,相反,鉴于肿瘤患者抗肿瘤治疗以及年龄相关的生育力下降,建议在条件允许的情况下推荐有生育需求的恶性肿瘤患者积极进行ART助孕。然而,本研究为单中心研究,纳入的样本量有限,未能获取肿瘤分期、病理类型等详细治疗信息,无法对肿瘤、肿瘤类型进行分层分析,尚需扩大样本量、多中心、随机对照研究进一步证实。
