低浓度微酸性电解水对纯培养及海虾中副溶血性弧菌与腐败希瓦氏菌的杀灭作用
2024-03-01刘阳王程可苡杨宇罗宗洪常冠红王新张春玲
刘阳,王程可苡,杨宇,罗宗洪,常冠红,王新,张春玲
(西北农林科技大学 食品科学与工程学院,陕西 杨凌,712100)
生活水平的提高和膳食结构的转变,使得人们更加倾向于将肉类食品作为蛋白质摄入源。海产品作为一种优质的蛋白质来源,对于大众营养和健康必不可少。副溶血性弧菌(Vibrioparahaemolyticus)是导致海产源食物中毒的最主要致病菌,它可引起海水养殖动物间弧菌病的流行和暴发性死亡,误食该菌感染的海产品易引发胃肠炎和败血症等疾病[1]。副溶血性弧菌常与海产品中的特定腐败菌-腐败希瓦氏菌(Shewanellaputrefaciens)共存于近岸海水和海产品中。腐败希瓦氏菌能还原海产动物肌肉中的氧化三甲胺并产生H2S气体,同时能够降解蛋白质等营养成分,造成海产品营养物质的破坏和风味品质的劣变。副溶血性弧菌和腐败希瓦氏菌的污染已造成严峻的食品安全问题和极大的经济耗损[2-3],因此寻找一种高效的方法来减少或消除食品中的食源性致病菌和腐败菌对食品安全和人类健康至关重要。
常用化学类杀菌剂双氧水、臭氧、季氨化合物等在食品加工中的使用会导致化学残留和环境污染问题。常用物理方法有超高压杀菌、辐照杀菌等,但由于灭菌成本高,应用限制多,不适合大规模使用。微酸性电解水(slightly acidic electrolyzed water, SAEW)作为一种广谱型的非热杀菌技术,是通过电解稀盐酸和/或氯化钠溶液产生的具有特殊理化性质的水溶液。SAEW已被证明对多种病原体具有较强的杀菌作用[4-5]。SAEW具有高效广谱的杀菌效果及绿色环保的优点,被认为是食品工业中使用的化学消毒剂的有效替代品,已被应用于水果、蔬菜和肉类等食品中病原菌的杀灭和控制,延长产品货架期,并能保持原有的色泽、风味及质构[6-8]。
虽然已证明SAEW在食品行业应用的有效性,但是作为含氯杀菌剂,其在食品中的使用浓度受到严格的监管。GB 28234—2020《酸性电解水生成器卫生要求》规定在食品生产加工中SAEW可使用的有效氯浓度(available chlorine concentration, ACC)为40~80 mg/L。另外,含氯消毒剂清洗有机农产品和肉类食品后,水中残留的ACC规定不得超过4 mg/L[9]。因此,低浓度微酸性电解水(low concentration slightly acidic electrolyzed water, LcSAEW)可能是最适合应用于食品消毒的选择。已证明LcSAEW(0~10 mg/L)对单核细胞增生性李斯特菌[10]、大肠杆菌O157∶H7[11]有较好的杀灭效果,但该技术对海虾中优势致病菌-副溶血性弧菌和优势腐败菌-腐败希瓦氏菌的杀灭效果以及作用机制尚未探究。本研究对LcSAEW处理纯培养及海虾中副溶血性弧菌和腐败希瓦氏菌的杀灭效果进行对比,并通过生长曲线、内容物渗漏、电导率、膜电位、活性氧(reactive oxygen species, ROS)的测定以及细胞超微结构的观察,探究对两种细菌的灭活机理,为进一步研究LcSAEW杀菌机制提供依据。
1 材料与方法
1.1 材料与试剂
腐败希瓦氏菌CHPC 1.1833由上海海洋大学蓝蔚青教授赠送,副溶血性弧菌ATCC 17802由本实验室保存;ATP试剂盒、Bradford蛋白浓度测定试剂盒、活性氧检测试剂盒,上海碧云天生物技术有限公司;DiBAC4(3),北京索莱宝科技有限公司;LIVE/DEAD BacLight细菌细胞活性测定试剂盒,赛默飞世尔科技有限公司;中国对虾(Fenneropenaeuschinensis),购买于陕西杨凌海鲜市场,每只约20 g。
1.2 仪器与设备
Harmony-Ⅱ型微酸性电解水生成器,北京睿安德有限公司;PTH 027型余氯测量计,英国百达灵有限公司;FE28-Standard型pH/ORP仪,上海梅特勒-托利多仪器有限公司;Bioscreen C型微生物生长曲线仪,芬兰Oy Growth Curves Ab公司;Spark型酶标仪,上海帝肯贸易有限公司;AZ86031型水质检测仪,中国台湾衡欣科技股份有限公司;PinAAciie 900F型火焰原子吸收光谱仪,美国Perkin Elmer公司;Nano SEM-450型扫描电子显微镜,美国FEI公司;Leica TCS SP8 X型激光共聚焦显微镜,德国Leica公司;UV2550型紫外可见分光光度计,日本岛津仪器有限公司;DH-11L型拍打式均质器,宁波洛尚智能科技有限公司。
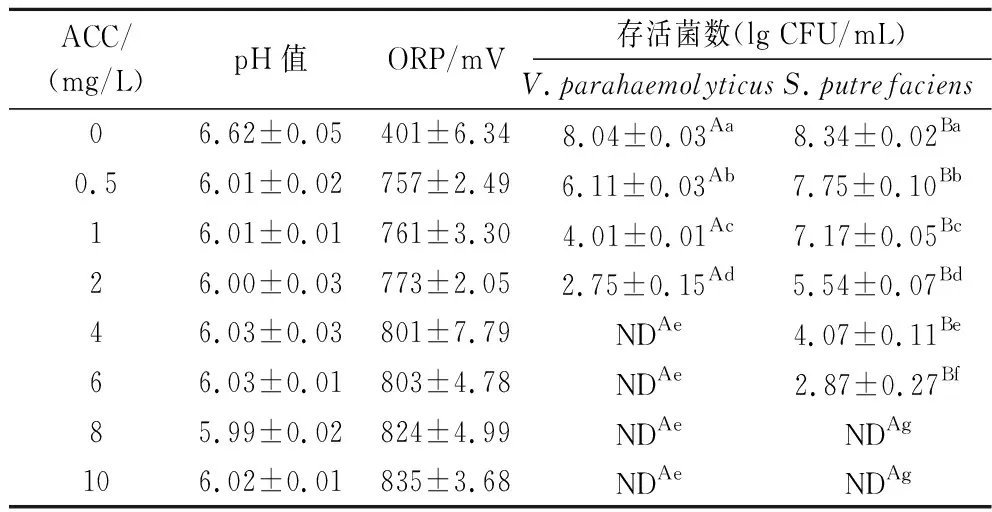
表1 不同有效氯浓度的低浓度微酸性电解水对副溶血性弧菌和腐败希瓦氏菌的灭活效果Table 1 Inactivation effect of slightly acidic electrolyzed water with different available chlorine concentrations onV.parahaemolyticus and S.putrefaciens
1.3 实验方法
1.3.1 菌悬液与LcSAEW的制备
将副溶血性弧菌(或腐败希瓦氏菌)冻存液划线到3% NaCl TSA(或LB)平板上获得单菌落,挑取单菌落于3% NaCl TSB(或LB)肉汤中37 ℃(或25 ℃)振荡培养18 h。用0.85%的生理盐水洗涤(5 000×g,10 min,4 ℃)并调整菌悬液浓度至108CFU/mL。同时,通过电解水发生器电解0.1% NaCl和0.01% HCl溶液制备后稀释得到低浓度微酸性电解水(LcSAEW),立即测定其ACC、pH值与氧化还原电位(oxidation-reduction potential, ORP)值。
1.3.2 LcSAEW对纯培养菌悬液的处理
将1 mL菌悬液加入到9 mL不同浓度的LcSAEW中,处理30 s后用0.5% Na2S2O3中和剂终止杀菌。然后用生理盐水进行梯度稀释, 从适宜梯度中取0.1 mL涂布于硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂平板或铁琼脂平板进行细菌计数。无菌去离子水处理作为空白对照。
1.3.3 虾样品的接种及LcSAEW对接种虾的处理
参照WANG等[12]方法,将虾沸水浴20 min,灭活虾体内的原生细菌。待虾冷却到室温(25±2) ℃,将1 mL不同菌悬液分别滴加于虾的背部和腹部,静置附着20 min。接种浓度约为7 lgCFU/g。接种后,将虾放入180 mL LcSAEW(ACC=10 mg/L)中,分别浸泡0.5、1、3、5、10 min。处理结束后,将虾转移至中和剂中均质2 min,如1.3.2节所述进行细菌计数。未处理的接种虾作为对照组。
1.3.4 微生物生长曲线
将不同处理后的副溶血性弧菌和腐败希瓦氏菌菌悬液按照10%接种量添加于3% NaCl TSB和LB肉汤中,培养温度分别设置为37 ℃和25 ℃,用微生物生长曲线分析仪每隔1 h测定1次OD600nm值,总运行时长为24 h。每组3个平行。以培养时间为横坐标,OD600nm为纵坐标,绘制微生物生长曲线。
1.3.5 膜电位测定
细菌膜电位的测定参照FADHEL等[13]方法。在不同处理后的菌悬液中加入1 μmol/L荧光染料DIBAC4(3),黑暗中孵育20 min,使用多功能酶标仪检测荧光强度,激发/发射波长为492/515 nm。
1.3.6 电导率的变化
将不同处理后的菌悬液在12 000 r/min条件下离心3 min,收集上清液,然后使用水质检测仪测定其电导率。
1.3.7 细菌胞内物质渗漏量测定
将不同处理后的菌悬液在12 000 r/min条件下离心3 min,收集上清液。使用紫外可见分光光度计测定OD260nm表示DNA含量。蛋白质含量采用Bradford蛋白浓度测定试剂盒测定。K+浓度使用火焰原子吸收光谱仪测定766.5 nm处的吸光度。
1.3.8 细胞内ROS水平测定
ROS检测试剂盒测定细胞内ROS水平。在LcSAEW处理前,先将细菌悬液在12 000 r/min条件下离心3 min,将细胞悬浮于10 mmol/L DCFH-DA溶液,37 ℃孵育20 min。再用无菌生理盐水清洗,去除多余的DCFH-DA。
1.3.9 细菌内ATP含量测定
将不同处理后的菌悬液在12 000 r/min条件下离心3 min,弃上清液,加裂解液破碎细菌,离心取上清液,按照ATP检测试剂盒说明测定ATP浓度。
1.3.10 扫描电子显微镜观察
将不同处理后的菌悬液于8 000 r/min条件下离心5 min,弃上清液。所得沉淀用2.5%的戊二醛溶液悬浮后固定10 h,用无菌生理盐水洗涤3次后,分别用30%、50%、70%、90%、100%乙醇梯度脱水后重悬,取适量样品滴至导电硅片上,CO2临界点干燥后固定喷金,在扫描电镜下观察菌体形态。
1.3.11 激光共聚焦显微镜观察
将不同处理后的菌悬液于8 000 r/min条件下离心5 min,弃上清液后悬浮至无菌生理盐水中。向每1 mL细菌悬液中加入3 μL SYTO 9/PI的2X染料,在黑暗中孵育15 min。滴加5 μL在载玻片上,使用激光共聚焦显微镜观察荧光并拍照分析。SYTO 9和PI染料的激发/发射波长分别为485/540 nm和535/610 nm。
1.4 统计分析
所有实验均为3次重复,结果以平均值±标准偏差表示。采用SPSS 20.0软件对数据进行单因素方差分析,采用Duncan′s法进行显著性分析,差异显著水平P<0.05;采用Origin 2022软件作图。
2 结果与分析
2.1 LcSAEW对纯培养副溶血性弧菌和腐败希瓦氏菌的杀灭效果
不同ACC的LcSAEW的理化性质及对副溶血性弧菌和腐败希瓦氏菌的杀灭情况如表1所示。相比于对照组,ACC为0.5、1、2 mg/L的SAEW处理后,副溶血性弧菌分别减少了1.93、4.03、5.29 lg CFU/mL,而腐败希瓦氏菌分别减少了0.59、1.17、2.8 lg CFU/mL。当ACC为4、8 mg/L时,副溶血性弧菌和腐败希瓦氏菌相继被杀灭至未检出水平,可知LcSAEW对副溶血性弧菌的杀菌效果更显著。并且随着ACC增加,两种菌的细菌数量均显著下降(P<0.05),说明ACC是影响杀菌效果的主要因素。与先前的报道结果一致,ACC越高,LcSAEW对大肠杆菌[11]、沙门氏菌[14]以及铜绿假单胞菌[15]的杀菌活性也越强。
2.2 LcSAEW处理对虾表面接种菌的杀菌效果
LcSAEW(ACC=10 mg/L)对接种了副溶血性弧菌和腐败希瓦氏菌的海虾进行不同时间(0.5、1、3、5、10 min)的处理,结果如图1所示。与对照组相比,杀菌效果随着处理时间的延长而显著增强(P<0.05)。当处理时间为10 min时,副溶血性弧菌和腐败希瓦氏菌的微生物数量分别下降了1.6、1.25 lg CFU/g。LcSAEW杀灭含有机物质的食品基质中的微生物时,LcSAEW中的有效作用成分在有机物质作用下会产生损耗[16],故海虾表面接种菌与纯培养细菌杀灭效果差异较大。
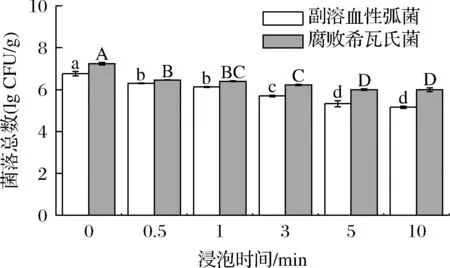
图1 低浓度微酸性电解水处理对虾表面接种的副溶血性弧菌和腐败希瓦氏菌的杀灭效果
2.3 LcSAEW处理对细菌生长的影响
通过测定生长曲线进一步评估了LcSAEW对2种菌的抑制作用,结果如图2所示。在对照组(ACC=0 mg/L)中,副溶血性弧菌(图2-A)与腐败希瓦氏菌(图2-B)都经过2 h迟缓期后迅速进入对数生长期,随后在13 h和14 h达到稳定期。随着ACC的增加,两种菌的迟缓期都明显延长,并且最终细菌浓度(OD600nm)都相应降低。值得注意的是,在ACC为10 mg/L时腐败希瓦氏菌被完全抑制生长,而ACC为6 mg/L时即可彻底杀灭副溶血性弧菌,与平板计数结果一致。LI等[10]报道ACC为12 mg/L的LcSAEW可在30 s内完全杀灭单核细胞增多性李斯特菌,说明不同的细菌对ACC敏感性存在一定差异。

A-副溶血性弧菌;B-腐败希瓦氏菌图2 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌生长的影响
2.4 LcSAEW处理对细胞内容物的影响
2.4.1 DNA和蛋白质的泄漏
细胞内物质泄漏的测定是细胞膜完整性损伤的重要评价指标[17-18]。如图3所示,与对照组相比,副溶血性弧菌和腐败希瓦氏菌经LcSAEW处理后细胞外DNA水平显著升高(P<0.05),且呈浓度依赖关系。而细胞外蛋白水平虽然呈增加趋势,但只有副溶血性弧菌在ACC为10 mg/L时显著高于对照组(P<0.05)。当LcSAEW作用于细菌时,释放到细胞外的蛋白质和DNA大分子,可作为膜损伤的主要特征物质[17]。蛋白质与DNA泄露的变化趋势一致,进一步验证了LcSAEW对细胞膜完整性的破坏。
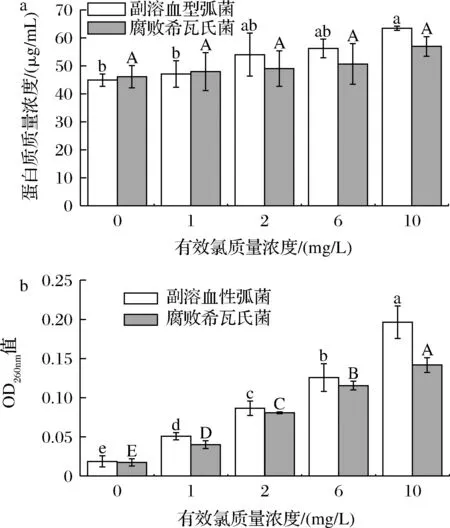
A-蛋白质;B-DNA图3 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌的胞内蛋白质和DNA渗漏的影响
2.4.2 细胞内K+的渗漏
K+是细菌内最丰富的阳离子,参与基本的生命活动,并调节细胞的渗透压和氧化还原电位[19]。钾通道的激活和钾离子的泄漏与超极化现象密切相关,K+的泄漏已被用来监测抗菌剂造成的细菌膜破坏[20]。如图4所示,除了腐败希瓦氏菌在ACC为1、2 mg/L时,经LcSAEW处理后2种细菌的上清液中K+浓度(与对照组对比)都具有显著性差异(P<0.05),与膜电位检测结果完全吻合。细胞内K+的损失会造成多种代谢途径受阻,破坏细胞渗透压的调节和内环境稳定。

图4 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌胞内K+渗漏的影响
2.5 LcSAEW处理对细菌膜电位和电导率的影响
膜电位指质子通量引起的电化学梯度在细胞膜上产生的电位差[21],是合成ATP的驱动力之一。本研究用探针DiBAC4(3)检测LcSAEW对副溶血性弧菌与腐败希瓦氏菌的膜电位的影响。如图5-A所示,ACC为6、10 mg/L的LcSAEW处理后2种细菌的膜电位(与对照组对比)都存在显著性差异(P<0.05)。LcSAEW使2种细菌的膜电位降低,导致细胞膜超极化,且呈ACC依赖性。LIU等[22]报道了SAEW可引起腐败希瓦氏菌和腐生葡萄球菌的超极化现象,与本研究结论一致。膜电位发生超极化可能是由于LcSAEW处理导致了细胞膜上离子通道的失活和破坏[23],部分带电离子跨膜运输,使膜内外电位差增大,极化状态加强[24]。
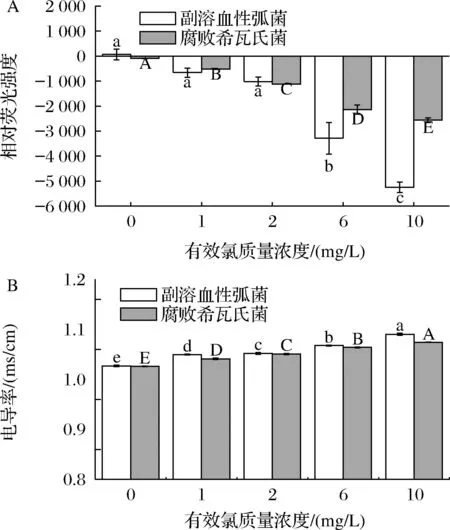
A-膜电位;B-电导率图5 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌的膜电位和电导率的影响
细菌电导率的变化可以反映其细胞膜通透性的改变,其改变常伴随着胞内小分子物质如离子、磷酸盐等电解质的流出[25]。如图5-B所示,经LcSAEW处理后,随着浓度的增加,副溶血性弧菌和腐败希瓦氏菌的电导率相应升高,且与对照组对比都具有显著性差异(P<0.05)。根据膜电位、电导率和胞外K+含量等通透性实验结果,都说明细菌膜内外出现离子紊乱,标志着细胞膜通透性的增强,导致细胞功能异常。
2.6 LcSAEW处理后细胞内ROS和ATP水平的变化
ROS是细胞代谢的副产物,过量累积会导致细胞内生物大分子的氧化损伤,从而破坏细菌结构和功能。如图6-A所示,随着ACC的增加,2种细菌胞内ROS的含量都逐渐增加。尤其是当ACC为6和10 mg/L时,ROS水平显著高于对照组(P<0.05)。有研究报道,SAEW有效地抑制了单增李斯特菌[10]和假单胞菌[26]的抗氧化酶系统的活性。因此,本研究中LcSAEW可能破坏了菌体的抗氧化防御系统,导致了ROS的大量产生和积累,从而诱导细胞膜上多不饱和脂肪酸的过氧化[27]以及蛋白质羰基化。而上述2.4.1节中,细胞外蛋白水平没有明显变化,可能是蛋白质很快会与细菌内ROS[28]或LcSAEW中氯物质发生反应。

A-ROS;B-ATP图6 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌胞内ROS和ATP的影响
ATP是微生物可利用能量的基本载体。ATP含量的降低会影响菌体的生命活动,抑制其生长和分裂[29]。本研究中ATP的测定采用生物发光法。如图6-B所示,与对照组相比,LcSAEW可显著降低细胞内ATP浓度(P<0.05),且具有ACC浓度依赖性。细菌内ATP的迅速耗尽,可能是因为LcSAEW攻击细胞膜导致ATP的泄漏;膜电位(质子梯度)的消耗引起ATP的合成受阻[27];以及细胞内ATP酶的持续水解[30]。
2.7 LcSAEW处理对细菌超微结构的影响
2.7.1 细胞形态变化
为了证实LcSAEW引起的细菌损伤,采用扫描电子显微镜观察处理后的菌体形态(图7)。对照组的副溶血性弧菌和腐败希瓦氏菌,均表现出典型的革兰氏阴性杆菌的结构,表面规则光滑。经LcSAEW处理的副溶血性弧菌(图7-A)表面出现明显的凹陷及褶皱,且随着LcSAEW浓度的升高,菌体严重皱缩甚至形成不规则小孔,导致内容物泄漏。而腐败希瓦氏菌(图7-B)经LcSAEW处理后表面结构无明显坍塌,仅在质量浓度≥2 mg/L时出现凹陷和皱缩。结果表明,LcSAEW对2种细菌都具有一定的损伤作用,破坏程度呈浓度依赖性。并且在相同浓度下,副溶血性弧菌较腐败希瓦氏菌表现出更显著的结构变化。
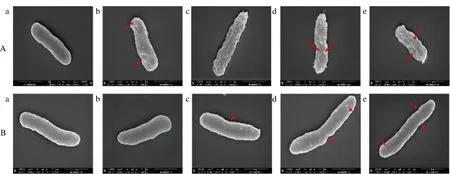
A-副溶血性弧菌;B-腐败希瓦氏菌图7 低浓度微酸性电解水处理后副溶血性弧菌和腐败希瓦氏菌的SEM图像
2.7.2 细胞质膜完整性
使用混合荧光染料Syto 9和PI进行菌体染色,检测经LcSAEW处理后细胞质膜的通透性变化(图8)。低分子质量(~10 Da)绿色荧光染料Syto 9可以穿透完整和受损的细胞质膜,而高分子质量(~668 Da)红色荧光染料PI只能穿透受损的细胞质膜[31]。对照组的副溶血性弧菌和腐败希瓦氏菌均显示Syto 9染料的绿色荧光,说明细胞膜是完整的。而经LcSAEW处理的细菌出现黄色或红色荧光,且随着LcSAEW浓度的升高,2种荧光比例增加,表明质膜完整性受损。并且在相同浓度下,副溶血性弧菌的黄色或红色荧光比例明显高于腐败希瓦氏菌,表明LcSAEW对副溶血性弧菌细胞质膜完整性的破坏更强。

A-副溶血性弧菌;B-腐败希瓦氏菌图8 低浓度微酸性电解水处理后副溶血性弧菌和腐败希瓦氏菌的CLSM图像
3 结论
本研究以海虾中优势致病菌-副溶血性弧菌和优势腐败菌-腐败希瓦氏菌为研究对象,探究了LcSAEW对纯培养及海虾表面接种菌的杀菌效果以及作用机制。结果表明,LcSAEW对2种菌均具有较强的杀灭作用,杀菌效果呈ACC依赖性;并且随着处理时间的增长,LcSAEW对虾表面接种菌的杀灭效果也增强。LcSAEW杀灭副溶血性弧菌和腐败希瓦氏菌可能的机制包括:a) LcSAEW破坏细胞膜完整性,导致膜通透性增加,造成DNA、蛋白质、ATP、K+等内容物的泄漏,激光共聚焦显微镜和扫描电子显微镜观察结果证实了LcSAEW对细胞外部结构的破坏作用;b) LcSAEW造成细胞膜超极化现象,细菌膜电位的改变干扰细胞正常的代谢活动,从而导致细菌死亡。部分离子通道激活导致K+等电解质的泄露正是造成细胞膜超极化的原因之一,而电导率的增加证明了膜内外的离子紊乱;c) LcSAEW造成ATP的快速耗尽,抑制细胞的生命活动;d) LcSAEW导致了ROS的大量产生和积累,造成细胞中生物大分子(蛋白质和DNA)的氧化损伤,以及细胞膜上多不饱和脂肪酸和膜蛋白的过氧化,从而破坏细菌细胞膜的结构和功能。
