低温β-1,4-内切葡聚糖酶的基因挖掘、异源表达及其酶学性质表征
2024-03-01圣弟青钮成拓闫亚楠郑飞云刘春凤王金晶李崎
圣弟青,钮成拓,闫亚楠,郑飞云,刘春凤,王金晶,李崎
(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
β-1,4-内切葡聚糖酶(EC3.2.1.4)是纤维素酶系中的一种,能够随机作用于纤维素无定形区中的β-1,4-糖苷键,将纤维素分子水解成长度不同的寡糖链[1]。纤维素酶的应用十分广泛,在洗涤、生物质能源等行业具有广泛的用途。在生物质能源中,β-1,4-内切葡聚糖酶可以在其他酶类的协同作用下降解纤维素为寡糖,从而最终转化为生物乙醇[2]。在洗涤行业,β-1,4-内切葡聚糖酶添加在洗涤剂中可以提升洗涤剂的洗涤效率,同时提高棉质衣物的光亮度改善棉纤维的柔软性,保护棉纺织物等作用[3-4],因此具有很高的商业价值。最早被应用在洗涤行业的β-1,4-内切葡聚糖酶来自BacillusKSM-635,首先由ITO[4]报道,最适温度40 ℃,最适pH值为9.5,在pH 11.0保持70%以上活性,目前为花王公司生产的Biotex。因为β-1,4-内切葡聚糖酶在洗涤行业上的应用环境通常都比较苛刻,通常需要其具有低温、耐碱以及抗表面活性剂等稳定的酶学性质。目前,对于β-1,4-内切葡聚糖酶的研究工作大部分集中在提高酶活力热稳定性等方向研究,并应用在饲料加工和生物能源等领域[5-6],对于可应用在洗涤纺织行业的β-1,4-内切葡聚糖酶的研究相对较少,并且对应用在洗涤行业的β-1,4-内切葡聚糖酶通常需要具有低温和耐碱性的酶学特征,因此,获得具有低温和碱性耐受能力的β-1,4-内切葡聚糖酶有利于提升其在洗涤行业的应用价值[7]。
β-1,4-内切葡聚糖酶的分布十分广泛,在古细菌、细菌、真菌、昆虫和动物胃肠道中均有报道[8-10]。然而,不同家族来源β-1,4-内切葡聚糖酶的酶学性质也有很大差异[11]。例如,真菌来源的β-1,4-内切葡聚糖酶通常具有较好的热稳定性和催化活性,且能够实现胞外分泌生产,在能源、饲料行业具有广泛的应用[12]。但是,真菌酶的最适pH值一般呈中性或偏酸性,无法在洗涤行业进行应用。在食草动物体内也分离得到一些β-1,4-内切葡聚糖酶基因,但是性质差别较大,且较难分离利用[5]。与之相比,细菌来源β-1,4-内切葡聚糖酶一般具有较宽的pH范围和温度范围,且具有易分离提取的特点,因此目前在洗涤行业中应用的β-1,4-内切葡聚糖酶大多来源于细菌。例如,最早应用于洗涤剂中的工业酶就分离自碱性环境的嗜碱芽孢杆菌[13-14]。
基于高通量测序方法的更新与计算方法的发展,通过对已获得基因组的挖掘已经成为发现新型天然酶的一种技术手段,而生物信息学的发展能够进一步解析新发现酶的相关信息[15]。截止到2022年12月,已有241 015 745条基因序列被测序分析并记录在GenBank中,虽然其中有很多基因序列暂时没有被注释所编码的蛋白质特性与功能,但是很多氨基酸序列已被解析出功能和特征,为具有独特酶学特性的新酶挖掘提供了宝贵的资源。目前通过基因挖掘获得新酶,并对其酶学性质进行表征已成为获得新酶的一个重要研究方向[16-17]。SANANGELANTONI等[18]通过基因挖掘获得了一种热稳定性高且底物特异性强的新型β-螺旋植酸酶;周茂志等[19]通过基因组数据挖掘获得了9个新的扁桃酸消旋酶基因及活性蛋白,并成功异源表达出来源于放射性土壤杆菌Agrobacteriumradiobacter的ArMR 酶。通过基因挖掘手段也可以获得新型β-1,4-内切葡聚糖酶,LIN等[20]通过基因挖掘成功从MicrobacteriumkitamienseS12中挖掘得到一种最适温度为35 ℃的新型冷适应性β-1,4-内切葡聚糖酶,其在0~5 ℃能够保持30%~40%的相对酶活;DHUME等[21]从MrakiarobertiiA2-3挖掘得到的耐寒内切葡聚糖酶的最适温度为15 ℃,而比酶活力到17.38 U/mg,具有在洗涤行业实际应用的潜力。
因此,本论文通过基因挖掘手段筛选得到一种新的低温β-1,4-内切葡聚糖酶基因,并在EscherichiacoliBL21中实现异源可溶性表达;在此基础上,对新酶进行了表达和纯化,并表征了其酶学性质,为其在洗涤和纺织行业的应用奠定基础。
1 材料与方法
1.1 材料与设备
通过基因挖掘得到的β-1,4-内切葡聚糖酶基因(Genbank No.WP_246130614)命名为EgDC,由安生达(苏州)公司经过密码子优化后合成,并连接在pET-22b(+)载体,在重组蛋白N端连接His-tag标签。DNA Marker、E.coliBL21(DE3)感受态细胞、高保真酶、限制性内切酶、T4连接酶等分子试剂,大连TaKaRa公司;Ni-NTA纯化树脂预装柱、Bradford法蛋白浓度测定试剂盒、SDS-PAGE快速制备试剂盒等,生物工程(上海)有限公司;氯化钠、甘油、胰蛋白胨、酵母粉、用作底物的羧甲基纤维素钠(Carboxymethylcellulose sodium,CMC-Na)等,国药集团化学试剂有限公司。
紫外-可见光分光光度计,上海MAPADA 仪器有限公司;FiveEasy pH 计,Mettler Toledo(上海)有限公司;冷冻离心机,德国Eppendorf 公司;恒温水浴锅,金坛市宏华仪器厂;Powerpac Basic 型蛋白电泳仪,美国BIO-RAD 公司;电子天平,奥豪斯仪器(常州)有限公司;SPX-250 生化培养箱,上海跃进医疗器械厂;MR-96T型智能酶标仪,骋克仪器(上海)有限公司;全自动高压蒸汽灭菌锅,日本HIRAYAMA株式会社;PL2002电子天平,METTLER TOLEDO公司;10 μL-1 mL不同型号移液枪,德国Eppendorf 公司;Sonics Vibra-Celltm超声破碎仪,美国Sonics公司;GeIDoc-ItTM 凝胶成像系统,美国UVP公司;MICROL 17台式高速离心机,美国Thermo Scientific公司。
1.2 实验方法
1.2.1 基因挖掘和序列分析方法
基因挖掘出发序列在碳水化合物活性酶数据库pfam官网(http://pfam.xfam.org/)进行检索;在NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行blast对比搜索;利用Mega X 程序基于连接法构建进化树并在iTOL网站(https://itol.embl.de/)进行图片展示;利用clustal W程序对得到β-1,4-内切葡聚糖酶氨基酸序列进行多序列比对;采用ESPript 在线服务器(http://espript.ibcp.fr/ESPript/ESPript/)进行可视化结果分析。
1.2.2 重组β-1,4-内切葡聚糖酶的构建
重组大肠杆菌的构建通过安生达(苏州)公司进行挖掘得到的β-1,4-内切葡聚糖酶基因密码子优化、合成后在其N段连接his-tag标签,并连接至pET-22b(+)质粒。通过双酶切验证重组质粒正确性后,通过化学转化的方法将其转化进入E.coli感受态细胞中,并涂布于含硫酸卡那霉素的LB固态平板。在此基础上,通过将克隆转接至液体LB培养基后提取质粒,并通过双酶切和基因测序验证确定阳性克隆。
1.2.3 重组大肠杆菌的诱导表达及纯化
从平板挑取阳性转化子接种至含100 μg/mL氨苄青霉素的TB液体培养基,于37 ℃、40×g下振荡培养至OD600值为0.7~0.8后,加入终浓度1 mmol/L 异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导表达,并设置不添加IPTG诱导的对照组,在20 ℃培养48 h。取培养菌液40 mL于4 000×g离心5 min收集菌体,加入30 mL Tris-HCl缓冲液(20 mmol/L,pH 7.0)重悬菌体,并调节OD600值为5。在冰浴条件下通过超声波破碎仪(500 W/750 W,美国Sonics公司)破碎细胞。破碎条件如下:300 W,超声3 s、间隔7 s,30 min。破碎后得到的液体为全细胞裂解液,经4 000×g离心10 min后收集上清液,即为粗酶液。
β-1,4-内切葡聚糖酶的纯化采用Ni-NTA预装重力柱纯化(上海生工生物工程有限公司)。通过梯度洗脱确定目标蛋白洗脱缓冲液咪唑浓度后,在最优咪唑浓度下洗脱目标蛋白,并采用截留分子质量为3 000 Da的蛋白超滤管浓缩洗脱液,经PD-10脱盐柱换盐后,最终获得纯化后蛋白样品。纯化后蛋白样品通过SDS-PAGE进行分析。
1.2.4 β-1,4-内切葡聚糖酶的酶活力测定
β-1,4-内切葡聚糖酶的酶活力测定方法参考3,5-二硝基水杨酸试剂(3,5-dinitrosalicylic acid,DNS)法[22]。取1.5 mL CMC-Na底物溶液于EP管中,40 ℃恒温水浴5 min,加入0.5 mL酶液,充分摇匀后于40 ℃恒温水浴锅中准确反应60 min,最后加入1 mol/L NaOH溶液作为反应终止剂。随后加入2 mL DNS试剂置于沸水浴中反应5 min,流水冷却后在分光光度计测定OD540值。
酶活力单位定义:在pH 7.0、40 ℃条件下,每分钟催化水解羧甲基纤维素钠生成1 μmol还原糖所需酶量为1个酶活力单位[23]。
1.2.5 β-1,4-内切葡聚糖酶的最适温度和温度稳定性测定
最适温度测定方法如下:将酶液在不同温度条件(15、20、25、30、35、40、45、50、55、60 ℃)下测定酶活力,将最高酶活力定义为100%,计算相对酶活力,其中测得酶活力最大值对应的温度即为β-1,4-内切葡聚糖酶的最适温度。
温度稳定性测定方法如下:将酶液置于15、20、25、30、35、40、45、50、55、60 ℃保温60 min,迅速冰浴冷却至40 ℃后参考1.2.4节方法测定酶活力,以在相同温度条件下处理后酶活力与未处理酶活力的比值表征酶的剩余酶活力,以最高酶活力定义为100%计算剩余酶活力。
1.2.6 β-1,4-内切葡聚糖酶的最适pH和pH稳定性测定
最适pH值测定方法如下:分别配制20 mmol/L醋酸/醋酸钠缓冲液(pH 5.0~6.0)、20 mmol/L Tris-HCl缓冲液(pH 6.5~10.0)和20 mmol/L Gly-NaOH缓冲液(pH 10.0~12.0),并与羧甲基纤维素钠底物等体积混合;将酶液在相应pH条件下测定酶活力,以最大酶活力为100%计算相对酶活力。
pH稳定性测定方法如下:将酶液置于上述缓冲液中于40 ℃恒温处理1 h后,在最适温度下测定酶活力,以相同pH条件下处理后酶活力与未处理酶活力的比值表征酶的剩余酶活力。
1.2.7 金属离子、表面活性剂和化学试剂对β-1,4-内切葡聚糖酶酶活力的影响
在底物溶液中加入终浓度分别为1 mmol/L和10 mmol/L的金属离子溶液(K+、Cu2+、Ba2+、Mg2+、Fe3+、Mn2+、Zn2+、Ca2+、Li+、Ni2+、Na+、Co2+)以及终质量浓度10 mg/L的表面活性剂和化学试剂[十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、十二烷基苯磺酸(dodecyl benzene sulfonic acid, LAS)、聚山梨醇酯-20 (Tween-20)、聚氧乙烯山梨糖醇酐单硬酸酯(Tween-60)、聚山梨酯-80 (Tween-80)、聚乙二醇辛基苯基醚(Triton)、二甲基亚砜(dimethyl sulfoxide, DMSO)、苯甲磺酰氟(phenyl methane sulfonyl fluoride, PMSF)、盐酸胍(guanidine hydrochloride, GuHCl)、溴甲烷(bromomethane, MB)、丙酮(acetone, AC)、二硫苏糖醇(dithiothreitol, DTT)、N-亚硝基吗啉(N-nitrosomorpholine, NNM)、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、尿素(urea)],再加入β-1,4-内切葡聚糖酶酶液在最适条件下反应60 min后测定酶活力,以未处理测得的酶活力为100%计算相对酶活。
1.2.8 β-1,4-内切葡聚糖酶的底物特异性分析
分别以CMC-Na、微晶纤维素、滤纸和棉等为底物,在最适条件下测定β-1,4-内切葡聚糖酶的酶活力,分析β-1,4-内切葡聚糖酶对不同底物的水解能力。
1.2.8 β-1,4-内切葡聚糖酶的催化动力学参数分析
将CMC-Na底物与20 mmol/L Tris-HCl缓冲液(pH 7.0)混合,配制成质量浓度分别为0.5、1.0、1.5、2、3、4、5、6、7、8、9、10、15、20、25 mg/mL的底物溶液,在最适条件下测定酶活力[24]。通过拟合Lineweaver-Burk双倒数曲线计算Km和Vmax值,Vmax除以对应的底物浓度即为催化常数kcat值,进一步计算可得催化效率常数kcat/Km值。
1.2.8 β-1,4-内切葡聚糖酶的催化动力学参数分析
将纯化后的β-1,4-内切葡聚糖酶液分别置于pH 8.0和pH 9.0环境,并保持温度为40 ℃。每隔10 min加入羧甲基纤维素钠底物测定酶活力,直到剩余酶活力达到初始酶活力的50%以下[25]。将β-1,4-内切葡聚糖酶在不同pH条件下酶活力降至一半所需要的时间定义为酶的半衰期。
2 结果与分析
2.1 β-1,4-内切葡聚糖酶序列挖掘
基于获得耐低温和耐碱β-1,4-内切葡聚糖酶的目标,通过pfam数据库筛选得到一株BacillusKSM-635来源的低温、耐碱β-1,4-内切葡聚糖酶基因(Genbank No.1G01_A);将该酶保守功能域氨基酸在NCBI数据库进行blastp搜索,共获得209个潜在内切葡聚糖酶基因序列。所筛选到的β-1,4-内切葡聚糖酶在活性区域具有高度的保守性,为了保证酶基因的新颖性,保留同源性在40%~75%的氨基酸序列,共筛选得到99株潜在氨基酸序列,并构建了系统进化树。从图1-a可以看出,基于进化距离以及来源分布,β-1,4-内切葡聚糖酶主要来源于芽孢杆菌属,同时在梭状芽孢杆菌、奇异球菌、栖热袍菌、假单胞菌属微生物中也鉴定得到部分新型酶基因。
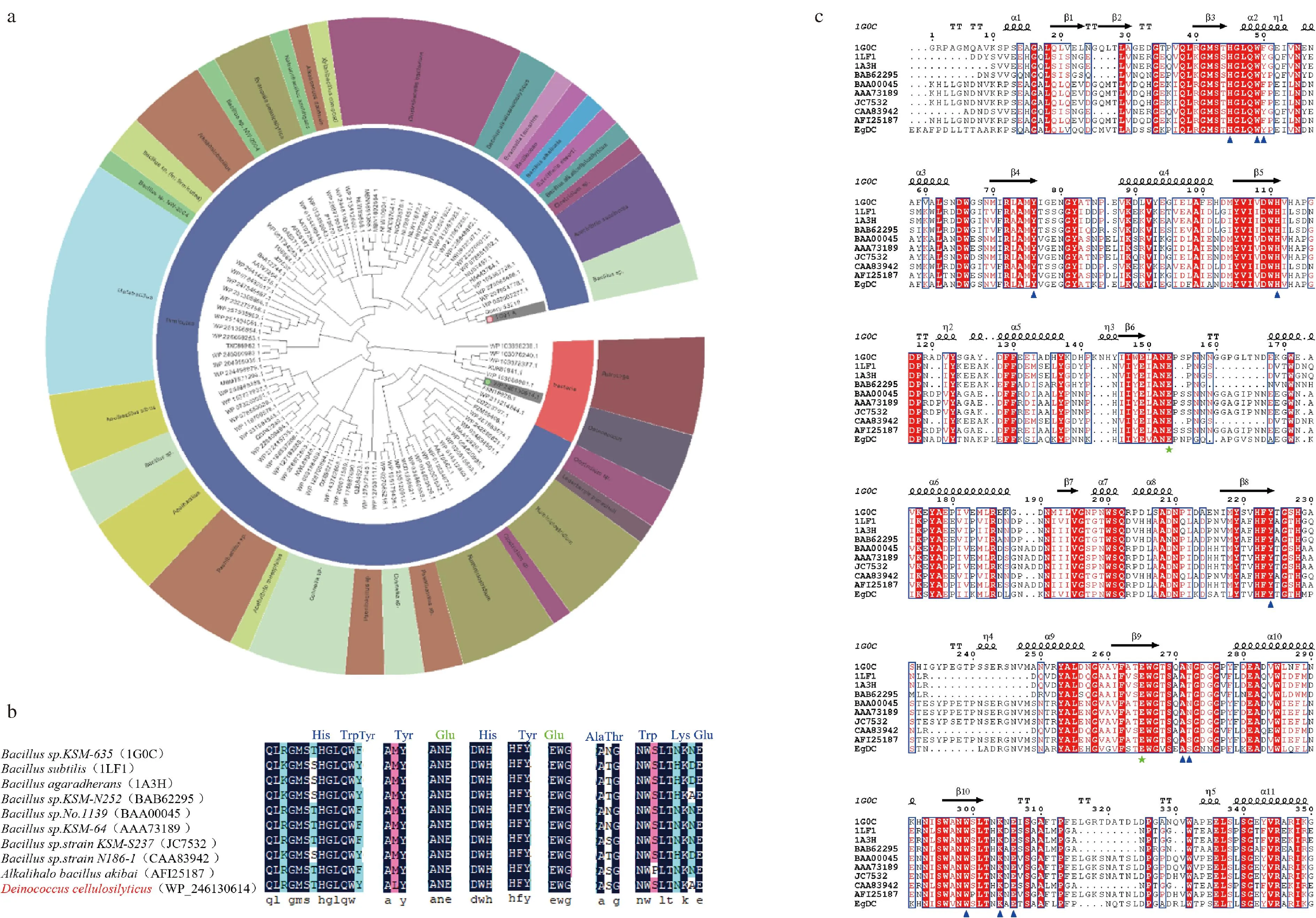
a-挖掘得到酶基因搭建的系统进化树;b-潜在β-1,4-内切葡聚糖酶的保守氨基酸序列比对;c-WP_246130614编码蛋白与其同源性较高的蛋白多序列比对结果图1 β-1,4-内切葡聚糖酶的基因挖掘结果分析
为进一步筛选具有潜在工业应用价值的β-1,4-内切葡聚糖酶基因,首先去除具有组合纤维素酶功能域、缺少CBM结构域等不符合筛选特定保守域的序列;在此基础上,基于栖热袍菌、假单胞菌属菌株特性,其来源β-1,4-内切葡聚糖酶通常不具有低温、耐碱性的特征,因此也被排除。经过上述2轮筛选,共排除49个酶序列,共余49个酶序列。剩余序列通过分析序列氨基酸占比情况,并计算了各β-1,4-内切葡聚糖酶的理论最适pH值。为保证碱性条件下的应用,筛选理论最适pH值在7.0以上的序列,考虑到在洗涤行业中的低温环境,分析低温β-1,4-内切葡聚糖酶的氨基酸序列特点,筛选具有更少的内部作用力、盐桥数量少和更多非极性残基暴露的序列[26]。为了确定挖掘得到的β-1,4-内切葡聚糖酶基因的功能,将筛选剩下的内切葡聚糖酶氨基酸序列中的关键催化区域与BacillusKSM-635来源内切葡聚糖酶1G0C序列进行氨基酸序列比对。从图1-b和图1-c可以看出,筛选得到的β-1,4-内切葡聚糖酶氨基酸序列的催化功能域和底物结合位点(蓝色)与已验证的模板酶序列具有高度保守性,其具有相同的催化活性位点Glu155和Glu259(绿色),这表明筛选得到的内切葡聚糖酶基因具有潜在的β-1,4-内切葡聚糖酶催化能力。考虑到基因序列的可获得性和操作性,选择与内切葡聚糖酶1G0C氨基酸序列相似性为60.83%的Deinococcuscellulosilyticus来源内切葡聚糖酶EgDC(Genbank No.WP_246130614)进行下一步研究。
2.2 β-1,4-内切葡聚糖酶EgDC的异源表达及纯化
将内切葡聚糖酶EgDC基因通过pET-22b(+)载体转化进入E.coliBL21,成功搭建重组大肠杆菌。通过含pET-22b(+)-EgDC的重组大肠杆菌的发酵液和全细胞裂解液的SDS-PAGE分析研究了酶的表达情况。如图2-a所示,重组大肠杆菌的发酵液与全细胞裂解液都在44.3~66.4 kDa均出现了条带,与酶分子质量理论值58 kDa基本相符。与此同时,在24 h和48 h发酵液中出现了明显条带,证明内切葡聚糖酶EgDC成功实现了表达。在此基础上,基于重组β-1,4-内切葡聚糖酶EgDC蛋白质C端带有his-tag标签,通过Ni2+亲和层析对其进行纯化。通过SDS-PAGE分析,纯化后的EgDC显示单一蛋白质条带,表观分子质量为58 kDa,与理论值相符。

a-重组β-1,4-内切葡聚糖酶发酵液、全细胞裂解液和纯化酶的SDS-PAGE分析;b-粗酶活力分布情况图2 重组β-1,4-内切葡聚糖酶表达结果分析
为了进一步验证重组大肠杆菌对β-1,4-内切葡聚糖酶EgDC的可溶性表达的程度,测定了含pET-22b(+)-EgDC的重组大肠杆菌诱导40 h后的发酵液、粗酶液和全细胞裂解液的总酶活力。如图2-b所示,发酵40 h后粗酶液酶活力为(62.25±3.98) U/mL。其中,全细胞裂解液中测得酶活力为(49.74±1.65) U/mL,约占粗酶液酶活力的3/4;此外,少量重组酶被分泌到发酵液中[(16.55±1.01) U/mL]。由此可见,β-1,4-内切葡聚糖酶EgDC绝大部分存在于细胞周质,少部分分泌到胞外。
2.3 β-1,4-内切葡聚糖酶EgDC的酶学性质分析
2.3.1 β-1,4-内切葡聚糖酶的最适温度和温度稳定性
测定了β-1,4-内切葡聚糖酶EgDC的最适温度和温度稳定性。如图3-a所示,β-1,4-内切葡聚糖酶EgDC的最适温度为40 ℃,与之前报道的能够在洗涤行业进行应用的内切葡聚糖酶的最适温度(30~45 ℃)相符。但是,EgDC在20~40 ℃时依然保持70%以上的相对酶活力,这有利于其在低温环境下的应用。在此基础上,将EgDC在不同温度下温育1 h后测定其残余酶活力。如图3-b所示,EgDC的剩余酶活力随着温度的提高而逐渐降低。当温度低于45 ℃时,温育1 h后EgDC仍可以保持60%以上的活性;而当温度高于50 ℃时,温育1 h后EgDC的剩余酶活力下降较明显。在60 ℃处理1 h时后EgDC的剩余酶活力仅剩10%~20%。
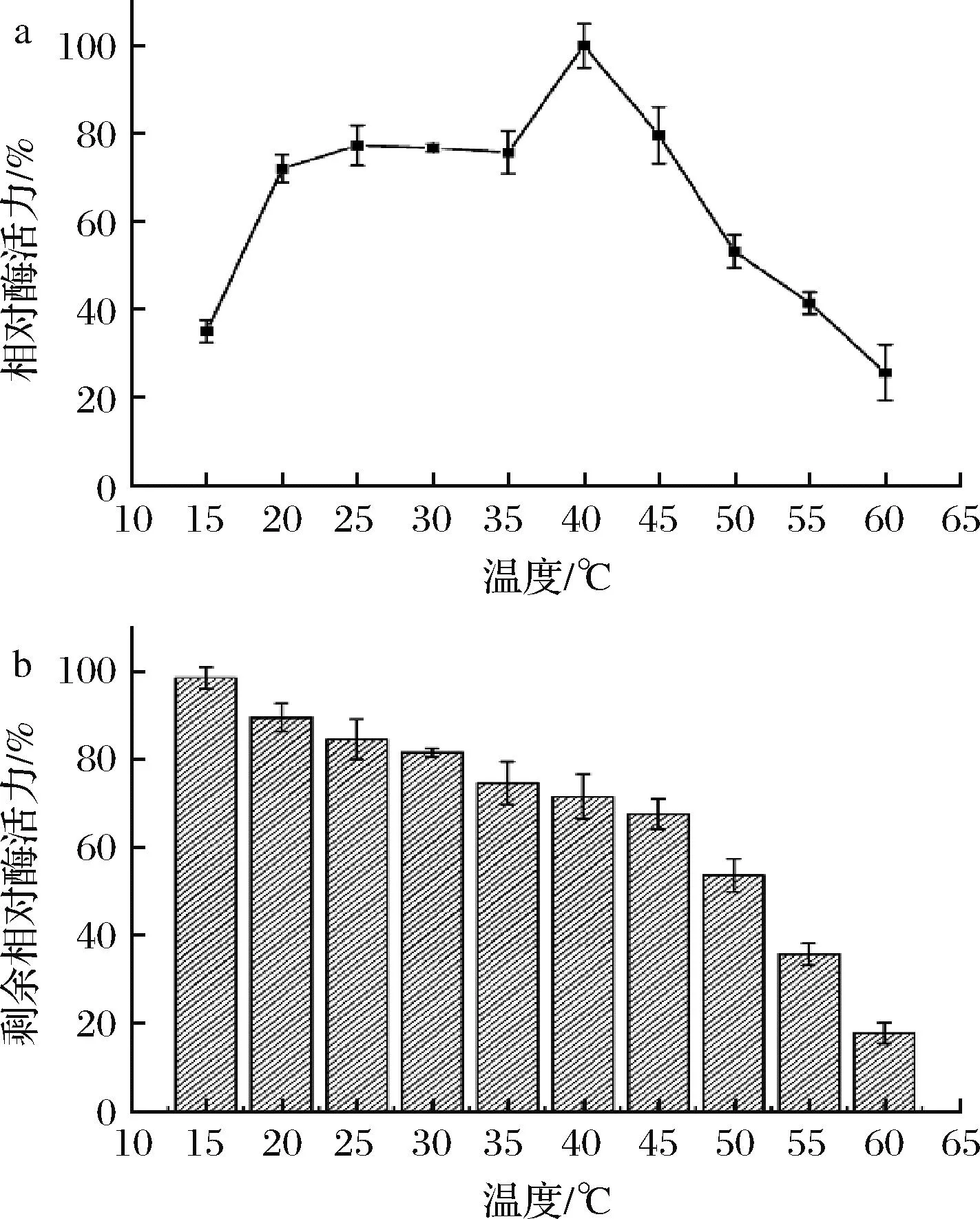
a-β-1,4-内切葡聚糖酶EgDC的最适温度曲线;b-EgDC的温度稳定性图3 β-1,4-内切葡聚糖酶EgDC的温度酶学特征
2.3.2 β-1,4-内切葡聚糖酶的最适pH和pH稳定性
测定了β-1,4-内切葡聚糖酶EgDC的最适pH值和pH稳定性。如图4-a所示,EgDC的最适pH值为6.5。在pH 6.0~8.0时,EgDC的相对酶活力能保持90%以上;当pH值>8.5时,EgDC的相对酶活呈现显著下降趋势,剩余酶活力低于60%。在EgDC的pH稳定性方面,EgDC在中性条件下的稳定性较好,其在pH 6.5~8处理1 h后依然能保持高于60%的剩余酶活力。在pH值>8.5时,EgDC的稳定性相对较差,其在处理1 h后的剩余酶活力在20%~40%(图4-b)。
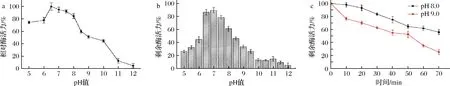
a-β-1,4-内切葡聚糖酶EgDC的最适pH值曲线;b-EgDC的pH稳定性;c-EgDC在pH 8.0和pH 9.0下的半衰期图4 β-1,4-内切葡聚糖酶EgDC的pH酶学特征
同时测定了β-1,4-内切葡聚糖酶EgDC在pH 8.0和pH 9.0条件下的半衰期。如图4-c所示,EgDC在pH 8.0条件下经70 min处理后的剩余酶活力依然在55%以上,说明EgDC具有一定程度的耐碱性。EgDC在pH 9.0条件下随着处理时间延长,剩余酶活力呈现明显下降趋势,在50 min左右剩余50%的酶活力。
2.3.3 金属离子、表面活性剂和化学试剂对β-1,4-内切葡聚糖酶的影响
测定了金属离子对β-1,4-内切葡聚糖酶EgDC酶活力的影响。如图5-a所示,1 mmol/L的Mn2+、Ca2+和10 mmol/L的K+、Ba2+、Mg2+、Li+、Na+对β-1,4-内切葡聚糖酶EgDC具有促进作用。其中,10 mmol/L的Ba2+对EgDC酶活力的促进作用最明显,在其存在条件下酶活力可达初始酶的130%左右。在1 mmol/L时,大部分金属离子(如K+、Ba2+、Mg2+、Ca2+、Na+)对EgDC酶活力具有一定的抑制作用,而当浓度增加到10 mmol/L时其抑制作用均变弱,甚至具有一定的促进作用。在所有金属离子中,对EgDC酶活力抑制作用最强的为Cu2+和Zn2+。在含10 mmol/L Cu2+或Zn2+情况下,EgDC的相对酶活力低于初始酶的10%,甚至接近为0。在洗涤条件下,能够耐受一定浓度的金属离子可以有效提高β-1,4-内切葡聚糖酶在洗涤中的应用价值。

a-金属离子对β-1,4-内切葡聚糖酶EgDC酶活力的影响;b-表面活性剂及有机试剂对β-1,4-内切葡聚糖酶EgDC酶活力的影响图5 β-1,4-内切葡聚糖酶EgDC对金属离子、表面活性剂和有机试剂的耐受性分析
同时测定了化学试剂(包括有机试剂、表面活性剂和抑制剂)对EgDC酶活力的影响。如图5-b所示,EgDC对大部分化学试剂表现出较好的耐受性,其中Tween-60对EgDC酶活力具有促进作用。在10 mg/L Tween-60条件下,EgDC酶活力达到初始酶的120%以上。尽管阴离子表面活性剂烷基苯磺酸钠(sodium alkylbenzenesulfonate,LAS)对于EgDC酶活力具有较强的抑制作用,但是Tween-60、Tween-80、TritonX-100这些非离子表面活性剂对酶活力的影响非常小。在10 mg/L阴离子表面活性剂SDS存在情况下,EgDC也具有初始酶75%以上的活性,这说明β-1,4-内切葡聚糖酶EgDC具有一定的适应洗涤环境的能力,能够与表面活性剂进行复配使用;此外,有机试剂(如甲苯、丙酮、二甲亚砜、尿素)对酶活力的影响不是很显著;EDTA、PMSF和盐酸胍等抑制剂对EgDC酶活力没有较大的影响,说明EgDC催化关键区域无需丝氨酸或金属离子。
2.3.4 β-1,4-内切葡聚糖酶的底物特异性分析
β-1,4-内切葡聚糖酶EgDC的底物特异性分析结果如表1所示。EgDC对可溶性底物羧甲基纤维素钠的降解活性最高,达到(26.38±1.43) U/mg;此外,其对于微晶纤维素也有一定的活性[(12.31±1.23) U/mg]。EgDC在以滤纸或棉作为底物时的酶活力较低。这可能是由于EgDC结构中存在碳水化合物结合位点(carbohydrate binding module, CBM),对催化底物存在一定选择性。

表1 β-1,4-内切葡聚糖酶EgDC的底物特异性Table 1 Substrate specificity of β-1,4-endoglucanase EgDC
2.3.5 β-1,4-内切葡聚糖酶的酶促动力学和半衰期
以羧甲基纤维素钠为底物测定了β-1,4-内切葡聚糖酶EgDC的比酶活力和催化动力学参数。如表2所示,通过拟合Michaelis-Menten方程计算,EgDC在最适条件下的Km值和Vmax值分别为(0.043±0.000 5) mg/mL和(29.67±0.065) U/(mg·s),其kcat和kcat/Km的值分别为(22.14±0.49) s-1和(520.03±17.07) s-1/mg(表2)。与其他研究报道[14]相比,EgDC的Km值更低,而其kcat/Km值,说明EgDC对羧甲基纤维素钠具有更高的亲和力以及更好的的催化性能,说明该酶在洗涤行业具有潜在应用价值。
3 结论
本文通过基因挖掘获得了一株D.cellulosilyticus来源的新低温β-1,4-内切葡聚糖酶基因EgDC,并在大肠杆菌中实现了可溶性表达。EgDC的比酶活力为(26.38±1.43) U/mg,其最适温度和最适pH值分别为40 ℃和6.5,且在低温和中性环境下具有较好的稳定性。该酶对金属离子、化学试剂以及表面活性剂均具有较强的耐受性。与其他报道[14,27]相比,EgDC具有较更高的kcat/Km值,说明具有更佳的催化性能。上述结果说明,这种新型低温β-1,4-内切葡聚糖酶具有洗涤行业所需要的大部分性质,具有潜在的工业应用价值。近年来研究者对于生存环境比较特殊的极端微生物的研究较多,这也成为潜在的工业酶资源挖掘的主要方向,但是这种方法存在菌株筛选、目的酶基因难以获得,极端微生物难以培养以及较低的开发效率等缺陷。该研究基于已有的序列进行生物信息学分析,实现通过基因挖掘获得特异的酶基因,为以后针对不同行业的特殊需求挖掘新型工业酶提供了可选途径。
