基于组学分析优化兽疫链球菌的透明质酸发酵生产
2024-03-01胡云箫吴俊俊赵北辰2王阳康振
胡云箫,吴俊俊,赵北辰2,,王阳,康振*
1(糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(食品合成生物技术教育部工程研究中心,江南大学未来食品科学中心,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)
透明质酸是由葡萄糖醛酸和N-乙酰葡萄糖胺通过β-1,3和β-1,4糖苷键交替串联形成的酸性直链黏多糖[1-2],主要存在于人和动物的结缔组织以及部分细菌的荚膜层中,具有保湿、润滑、抗炎等多种生理功能,现已广泛应用于食品、化妆品以及医学领域。
透明质酸的获取方法有组织提取法、化学合成法、体外酶法和微生物发酵法。组织提取法、化学合成法和体外酶法因原材料受限、生产成本高等原因不适于透明质酸的大规模工业生产。兽疫链球菌是目前工业上最主要的透明质酸生产菌株[3],能够天然合成高分子质量透明质酸,同时具有透明质酸发酵周期短,生产强度大,胞外杂多糖少产物提纯简便等优点。然而,兽疫链球菌存在遗传背景不清晰,基因工程改造困难的问题,围绕其透明质酸合成能力的提升主要通过培养条件优化策略实现。PATIL等[4]采用全因子设计和中心复合设计的方式优化兽疫链球菌生产透明质酸的培养基配比,摇瓶中最大平均发酵生产率达到0.798 g/L。AMADO等[5]首次使用玉米浸泡液作为主要氮源,通过间歇式生物反应器发酵兽疫链球菌得到透明质酸3.48 g/L。SHUKLA等[6]利用甘蔗糖蜜作为碳源,优化温度、pH和搅拌速率,最终采用兽疫链球菌在3.7 L分批补料发酵罐中生产透明质酸3.31 g/L。LAI等[7]以正十二烷和正十六烷作为氧载体,采用兽疫链球菌在配备螺旋带状叶轮的发酵罐中发酵透明质酸,产量达到4.25 g/L。
随着合成生物学的发展,研究人员相继在大肠杆菌、枯草芽孢杆菌和谷氨酸棒杆菌等模式微生物中引入透明质酸代谢途径实现透明质酸的合成。YU等[8]在大肠杆菌中通过替换稀有密码子及优化辅因子Mg2+质量浓度使产量达到190 mg/L。WOO等[9]通过基因敲除成功调控大肠杆菌中葡萄糖和半乳糖消耗速率,进一步过表达透明质酸前体合成途径基因在大肠杆菌中实现利用葡萄糖和半乳糖生产透明质酸,产量可达29.98 mg/L。但利用大肠杆菌生产透明质酸,通常存在透明质酸产量低及透明质酸难以转运到细胞外的问题。JIA等[10]在枯草芽孢杆菌中构建了人工操纵子组成表达系统,并采取两阶段诱导策略使透明质酸摇瓶产量达到6.8 g/L。但枯草芽孢杆菌胞外多糖成分复杂,且发酵后期菌体易破裂,这为透明质酸的分离提纯带来了困难。CHENG等[11-12]通过操纵子优化、启动子工程、RNA干扰及敲除乳酸脱氢酶基因等策略在5 L发酵罐发酵透明质酸28.7 g/L。WANG等[13]通过引入水蛭透明质酸酶破坏谷氨酸棒杆菌透明质酸囊状层的策略显著提升透明质酸产量,最终在5 L发酵罐中分批补料发酵使透明质酸产量高达74.1 g/L。但由谷氨酸棒杆菌发酵生产透明质酸,发酵周期长,转化率低且产物提取工艺不成熟。由此可知,以上工程菌株均难以取代兽疫链球菌达到工业化生产水平,加强兽疫链球菌遗传背景的解析至关重要。
兽疫链球菌(Streptococcuszooepidemicus)WSH-24可以天然合成透明质酸,且其发酵周期短,发酵成本低,产物分离提纯操作简便。本文旨在对兽疫链球菌WSH-24进行全基因组测序及转录组测序,以解除其基因组信息不清晰的限制。接着分析其代谢途径,并基于组学分析结果,优化培养基中氨基酸和维生素含量以提高兽疫链球菌WSH-24的透明质酸生产能力,为其分子改造及产量提升提供支撑。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株
S.zooepidemicusWSH-24为作者所在试验室保藏菌株。
1.1.2 试剂
蛋白胨、酵母粉,美国OXIOD公司;乳酸标准样品,深圳西尔曼科技有限公司;氨基酸、牛肉浸粉、酪蛋白胨、腺嘌呤、鸟嘌呤、尿嘧啶、烟酰胺、泛酸、吡哆胺、吡哆醛、核黄素、盐酸硫胺素、L-鸟氨酸、生物素,上海麦克林生化科技有限公司;氰钴胺素,阿达玛斯试剂有限公司;EZ-10柱式细菌基因组DNA抽提试剂盒,生工生物工程(上海)有限公司;其余试剂均为分析纯试剂,国药集团化学试剂有限公司。
1.1.3 培养基
a)THY培养基(种子培养基)(g/L):牛肉浸粉10.0,蛋白胨20.0,葡萄糖2.0,碳酸氢钠2.0,酵母提取物2.0,磷酸氢二钠0.4,氯化钠2.0;固体培养基另添加琼脂粉15 g/L。
b)FSB培养基(发酵培养基)(g/L):酪蛋白胨10.0,葡萄糖20.0,MOPs 42.0,氯化钠1.5,磷酸氢二钾2.0,酵母浸粉3.5,硫酸镁0.4;pH 7.0。
c)基础培养基[14]:葡萄糖20.0 g/L,十二水合磷酸氢二钠1.5 g/L,磷酸二氢钾0.5 g/L,七水合硫酸镁0.5 g/L,腺嘌呤30.0 mg/L,鸟嘌呤30.0 mg/L,尿嘧啶30.0 mg/L,生物素0.1 mg/L,氰钴胺素0.1 mg/L,烟酰胺2.0 mg/L,泛酸0.8 mg/L,吡哆胺0.8 mg/L,吡哆醛1.0 mg/L,核黄素0.4 mg/L,盐酸硫胺素0.4 mg/L,L-鸟氨酸100.0 mg/L;pH 7.0。
d)补料培养基:葡萄糖400 g/L。
1.2 仪器与设备
高压蒸汽灭菌锅,日本Hirayama株式会社;UV2450紫外分光光度计,日本Shimadzu公司;恒温振荡培养箱,上海知楚仪器有限公司;葡萄糖-乳酸生物传感分析仪,深圳西尔曼科技有限公司;pH计,瑞士Mettler-Toledo公司;低温高速冷冻离心机,美国Beckman公司;1 L、3 L全自动发酵罐,迪必尔上海生物工程有限公司。
1.3 实验方法
1.3.1 全基因组测序及比较基因组分析
全基因组测序:将S.zooepidemicusWSH-24 菌株摇瓶培养到对数中前期,12 000 r/min、4 ℃条件下离心5分钟,弃上清液,使用细菌基因组DNA抽提试剂盒提取基因组,达到要求的基因组在Hiseq平台上进行全基因组测序。
用于比较基因组学分析的菌株及其在NCBI数据库中的基因组登录号分别为:S.zooepidemicusMGCS 10565(CP001129.1)、S.zooepidemicusATCC 35246(CP002904.1)、S.zooepidemicusH70(FM204884.1)和S.zooepidemicusCY(CP006770.1)。
1.3.2 转录组测序
将WSH-24菌株摇瓶培养到对数中前期,12 000 r/min、4 ℃条件下离心5 min,弃上清液,使用液氮速冻菌体并转移至研钵内研磨成粉末,用药匙将粉末转移至1 mL充满Trizol的离心管中,并在Sangon Biotech(上海)的Illumina HiSeq平台上进行转录组测序。
1.3.3 孔板发酵
种子液的制备:挑取已活化平板上的单菌落至装有5 mL液体THY培养基的50 mL离心管中,37 ℃、220 r/min过夜培养8~10 h。
孔板发酵:以1%(体积分数)接种量将种子液接种于装有1.5 mL液体培养基的24孔板中,37 ℃、350 r/min培养12 h。
1.3.4 发酵罐发酵
种子液的制备:同1.3.1节种子液的制备。
二级种子液的制备:以初始OD600=0.1将种子液接种于装有25 mL液体THY培养基的250 mL挡板锥形瓶中,37 ℃、220 r/min培养8~9 h。
发酵罐发酵:以10%(体积分数)接种量将二级种子液接种于发酵罐中进行分批补料发酵,1 L发酵罐发酵罐装液量为0.6 L,3 L发酵罐发酵罐装液量为1.5 L。37 ℃、初始搅拌300 r/min、初始通气量3 m3/(m3·min)。使用50%(体积分数)氨水自动补碱并维持pH值在7.0左右,使用搅拌桨和通气量控制溶氧在20%左右,当初始葡萄糖消耗至10 g/L时,流加补料控制葡萄糖质量浓度在10 g/L左右。发酵过程中定期取样测定并记录。
1.3.5 发酵样品处理
发酵结束后,常温、8 000 r/min离心10 min,取上清液,加入3倍体积无水乙醇于-20 ℃过夜醇沉,次日4 ℃、8 000 r/min离心,取沉淀常温晾干乙醇,使用超纯水复溶到所需体积,多次醇沉重复上述操作。
1.3.6 透明质酸含量测定
Bitte-Muir法测定[15-16]。纯化后的透明质酸溶液稀释相应倍数,取200 μL溶解装有在1 mL硫酸硼砂溶液(4.77 g四硼酸钠溶解于500 mL浓硫酸)的比色管中,沸水浴15 min,冷却后加入50 μL咔唑溶液(1.25 g咔唑溶解于500 mL无水乙醇)显色,测定OD530的值。并根据葡萄糖醛酸标曲计算透明质酸含量。
葡萄糖醛酸标曲:分别配制质量浓度为0、10、20、30、40、50 mg/L的葡萄糖醛酸样品,测定同上。以葡萄糖醛酸样品浓度为横坐标,对应OD530值为纵坐标,绘制标准曲线。
1.3.7 其他参数测定
菌体生长情况:发酵液稀释相应倍数,于600 nm波长下测定菌体浊度。
乳酸含量:取1 mL发酵液样品,离心取上清液,稀释相应倍数,经过0.22 μm膜过滤后使用葡萄糖-乳酸生物传感分析仪测定。
2 结果与分析
2.1 兽疫链球菌WSH-24全基因组测序
兽疫链球菌WSH-24是实验室前期筛选获得的一株高效透明质酸生产菌株,但其基因组信息尚未测定,限制了对该菌株基因组层面的了解及基于基因组信息的相关研究。为了弥补该菌株基因组信息缺失,应用三代测序Hiseq平台对兽疫链球菌WSH-24进行全基因组建库测序,WSH-24全基因组图谱如图1所示。测序结果表明,WSH-24的完整基因组大小为2 147 053 bp,GC含量为41.75%,共有CDS 1 969个。将预测得到的编码序列与各数据库中的蛋白序列进行比对,全部1 969个基因在NR、COG和KEGG等数据库均比对成功。其中比对成功率最高的数据库为NR数据库,成功比对蛋白1 967个,占基因总数的99.90%。
2.2 兽疫链球菌WSH-24中心代谢途径分析
中心碳代谢(central carbon metabolism,CCM)主要包括糖酵解途径(glycolytic pathway,EMP)、磷酸戊糖途径(pentose phosphate pathway,PPP)以及三羧酸循环(tricarboxylic acid cycle,TCA cycle),为机体提供能量同时为其他代谢如氨基酸代谢、维生素代谢、透明质酸代谢等提供前体物质,是机体的核心代谢路径[17]。如图2-a所示,分析全基因组测序结果,菌株WSH-24具有完整的EMP途径和PPP途径,但TCA循环不完全,根据现有数据库报道仅可比对到琥珀酰辅酶A合成酶(succinyl-CoA synthetase,SCS)。为了进一步明确菌株WSH-24的CCM对透明质酸代谢的影响,对该菌株进行了转录组测序。分析转录组测序结果可知,菌株EMP途径基因转录水平最强,远高于其他代谢途径。这意味着在该菌株生长过程中,主要通过EMP途径来获取能量。此外,该菌株中乳酸脱氢酶基因ldh转录强度高,中心代谢溢流[18]严重(图2-b)。
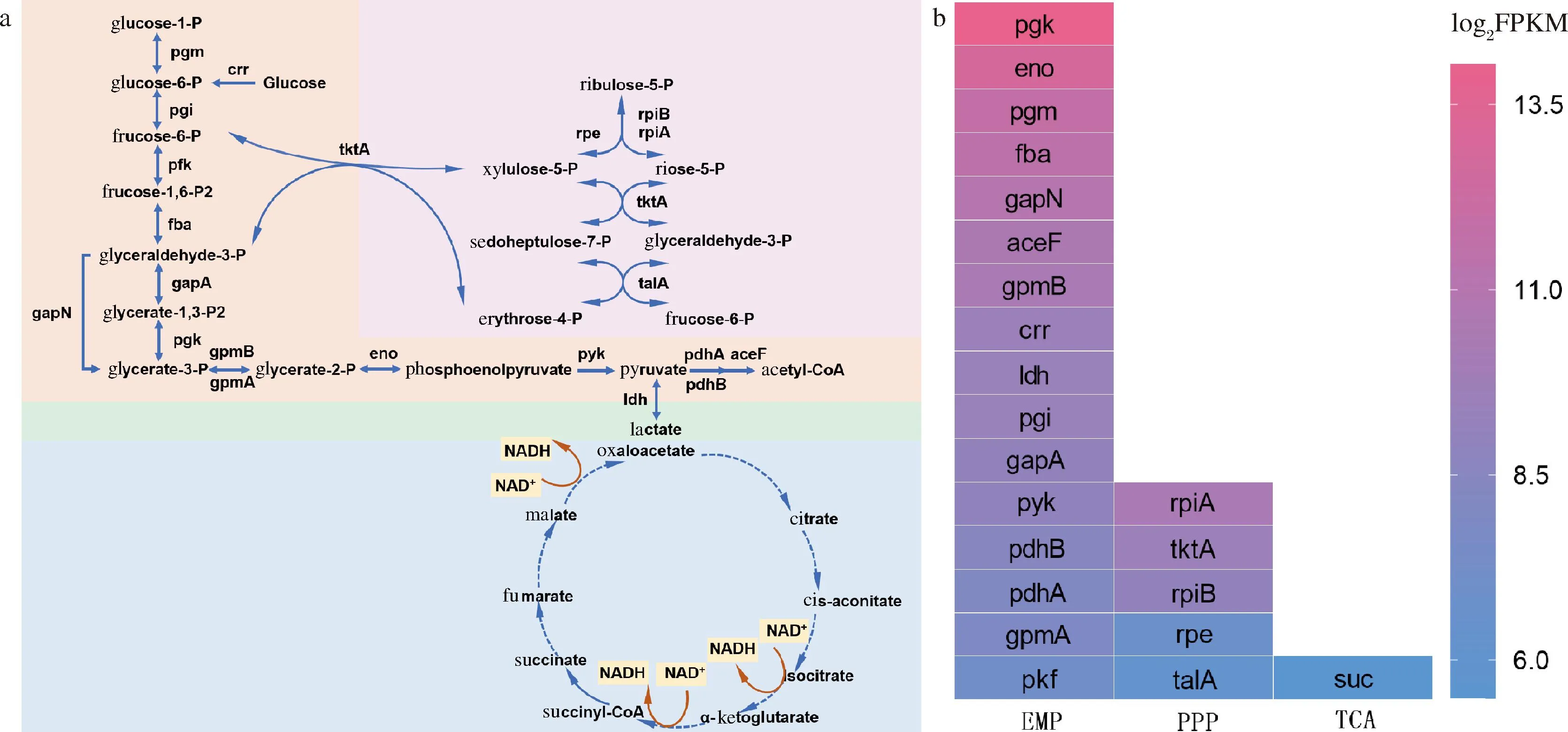
a-维生素B族代谢途径基因转录情况;b-添加维生素B族培养基中菌株生长过程图2 兽疫链球菌WSH-24的中心代谢途径
2.3 兽疫链球菌WSH-24氨基酸代谢途径解析及优化
氨基酸是合成蛋白质以及生物分子的重要前体物质,在为生物体的代谢中起着至关重要的作用,不仅可以影响菌株生长速度,还可以激活或抑制菌株部分生物合成[19]。兽疫链球菌发酵透明质酸的培养基比谷氨酸棒杆菌等代谢工程改造的透明质酸生产菌种的培养基复杂的多,需要添加大量的酵母粉(3.5 g/L)、牛肉浸粉(10.0 g/L)和酪蛋白胨(10.0 g/L),才可以支持透明质酸的发酵和菌体的生长。通过分析兽疫链球菌WSH-24的氨基酸合成代谢通路,我们发现兽疫链球菌缺失部分氨基酸的合成代谢途径基因(表1)。

表1 氨基酸代谢途径缺失基因Table 1 Missing genes in amino acid metabolic pathways
为验证兽疫链球菌WSH-24的氨基酸缺陷型,将其接种于基础培养基中,观察其生长情况。结果如图3-a所示,在不添加任何氨基酸的培养基中菌株无法正常生长(CK-);在添加0.5 g/L全部20种氨基酸的培养基中菌株能够正常生长(CK+);在分别去除缬氨酸(Val)、谷氨酰胺(Gln)、精氨酸(Arg)和色氨酸(Trp)的氨基酸培养基中菌株无法生长。该结果初步表明Val、Gln、Arg和Trp为菌株WSH-24的必需氨基酸,无法自身合成。为了进一步验证该结论,我们对WSH-24菌株分别在不同缺陷型培养基中的生长过程进行了分析。如图3-b所示,在氨基酸缺陷型培养基中,菌株在整个生长周期均无法正常生长,2 h开始OD600出现下降趋势,这一结果证实了菌株WSH-24为Val、Gln、Arg和Trp 4种氨基酸缺陷型。

a-20种氨基酸缺失对菌株生长的影响;b-分别缺乏Val、Gln、Arg和Trp培养基中菌株生长情况图3 氨基酸缺陷型确定
结合上述实验结果,采用1 L发酵罐分析外源添加4种必需氨基酸对兽疫链球菌WSH-24透明质酸发酵情况的影响。如图4所示,外源添加氨基酸对菌株的生物量无明显促进作用,但可以促进透明质酸的合成。外源添加Val、Gln、Arg和Trp为1.0 g/L时,透明质酸产量最高,可达到(2.65±0.02) g/L,相比初始野生型菌株产量(2.09±0.02) g/L提高了26.79%。
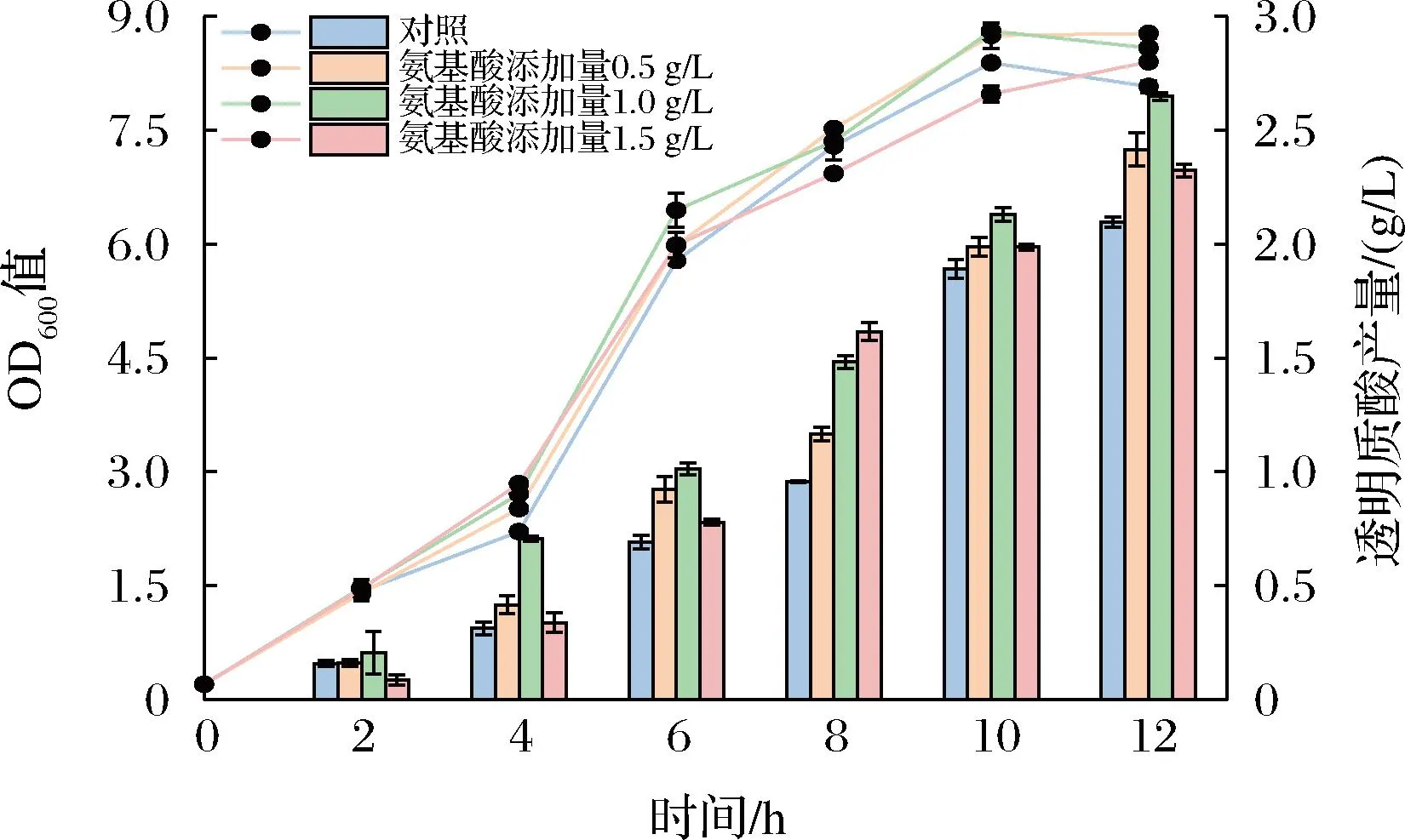
图4 氨基酸添加对透明质酸发酵的影响
2.4 兽疫链球菌维生素B族合成分析及优化
维生素B族是微生物代谢活动过程中多种酶的重要辅因子,具有促进菌体生长、增强菌体代谢的作用[20]。对维生素B族代谢途径基因转录强度进行分析,发现各代谢途径相关基因均具有较低的归一化单基因表达丰度(fragments per kilobase million,FPKM)[21],基因转录水平低(图5-a)。为了分析维生素B族是否可以促进菌体生长及代谢,分别向基础培养基中外源添加维生素B1、维生素B2、维生素B5、维生素B6、维生素B7和维生素B12。结果如图5-b所示,添加维生素B5、维生素B7和维生素B12的培养基中,菌株OD600值相较未添加任何维生素的对照(CK-)提高明显,分别提高23.98%、22.41%和21.85%,且与全部添加6种维生素的培养基中菌株生长情况相当(CK+)。该结果表明维生素B5、维生素B7和维生素B12的添加能够有效促进菌体生长。
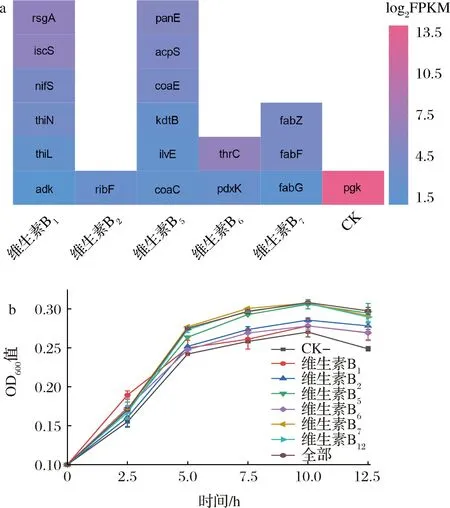
a-B族维生素代谢途径基因转录水平;b-添加B族维生素培养中菌株生长过程图5 维生素B族缺乏情况确定
结合上述实验结果,采取外源添加3种维生素B族的方式分批补料发酵(1 L发酵罐),以改善菌株生长,提高透明质酸产量。按照1.13基础培养基中维生素B5、维生素B7和维生素B12的比例进行外源添加,分别添加一倍体积维生素B5、维生素B7和维生素B12及2倍体积维生素B5、维生素B7和维生素B12,即维生素B50.8 mg/L、维生素B70.1 mg/L和维生素B120.1 mg/L及维生素B51.6 mg/L、维生素B70.2 mg/L、维生素B120.2 mg/L。结果如图6所示,添加3种维生素的培养基中菌株12 h的OD600值均高于对照(未添加维生素),且透明质酸产量也均高于对照。当外源添加维生素B50.8 mg/L、维生素B70.1 mg/L和维生素B120.1 mg/L时,透明质酸产量最高,可达(2.46±0.07) g/L,相比初始野生型菌株提高了21.33%。
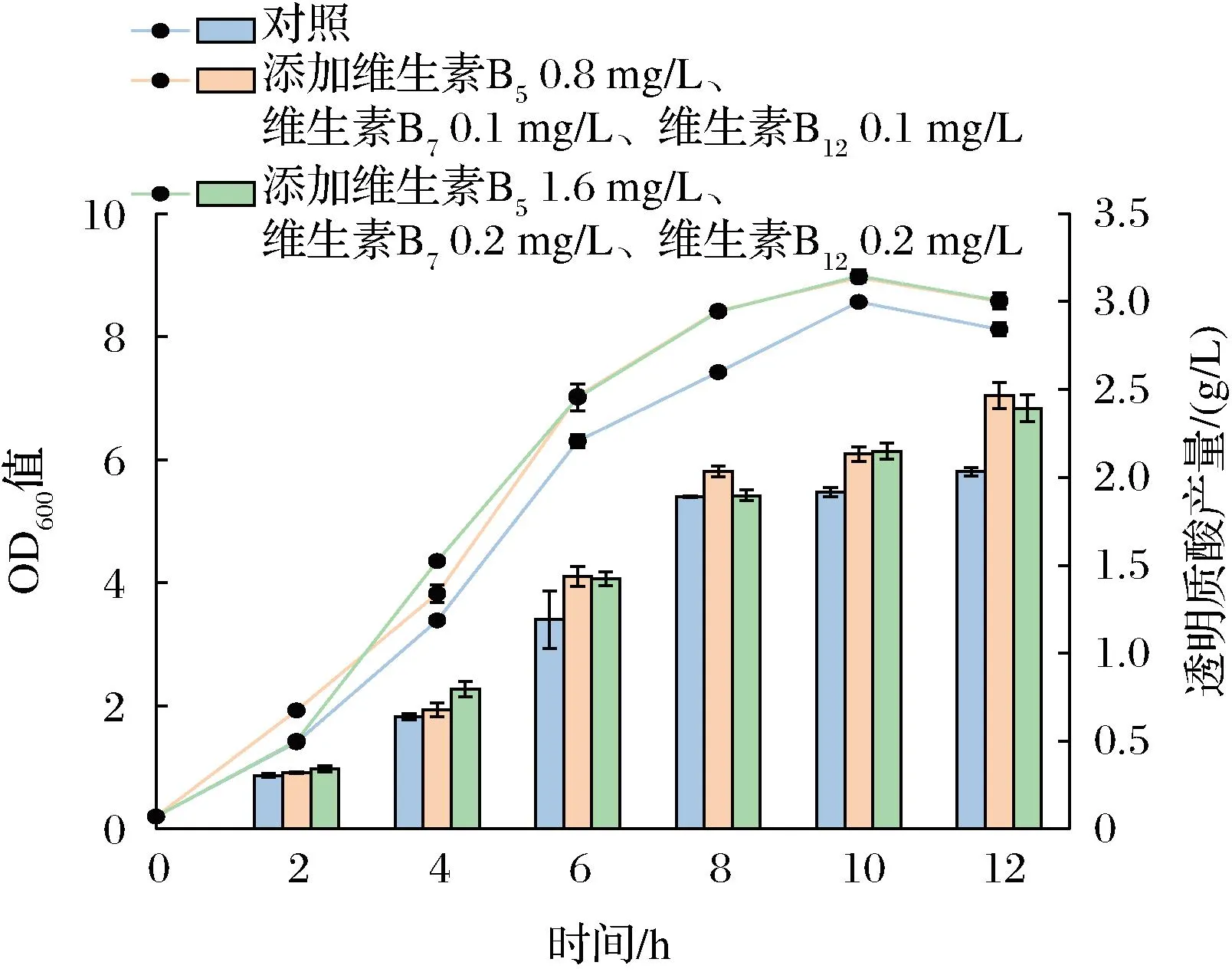
图6 B族维生素添加对透明质酸发酵的影响
2.5 3 L罐分批补料发酵生产透明质酸
结合上述单因素实验结果,选取最高透明质酸产量对应的氨基酸添加量(外源添加氨基酸Val、Gln、Arg和Trp均1.0 g/L)和维生素添加量(外源添加维生素B50.8 mg/L、维生素B70.1 mg/L和维生素B120.1 mg/L),对培养基进行组合优化,并采用3 L发酵罐对组合优化结果进行验证。结果如图7所示,优化培养基中必需氨基酸和B族维生素的供应对细胞的生长有明显促进作用,菌株生长速率和细胞密度均明显提升。产物透明质酸和副产物乳酸在整个发酵过程中均不断积累。透明质酸产量在12 h达到最高值(5.63 g/L),生产强度为0.31 g/(L·h),相较野生型提升了33.33%。
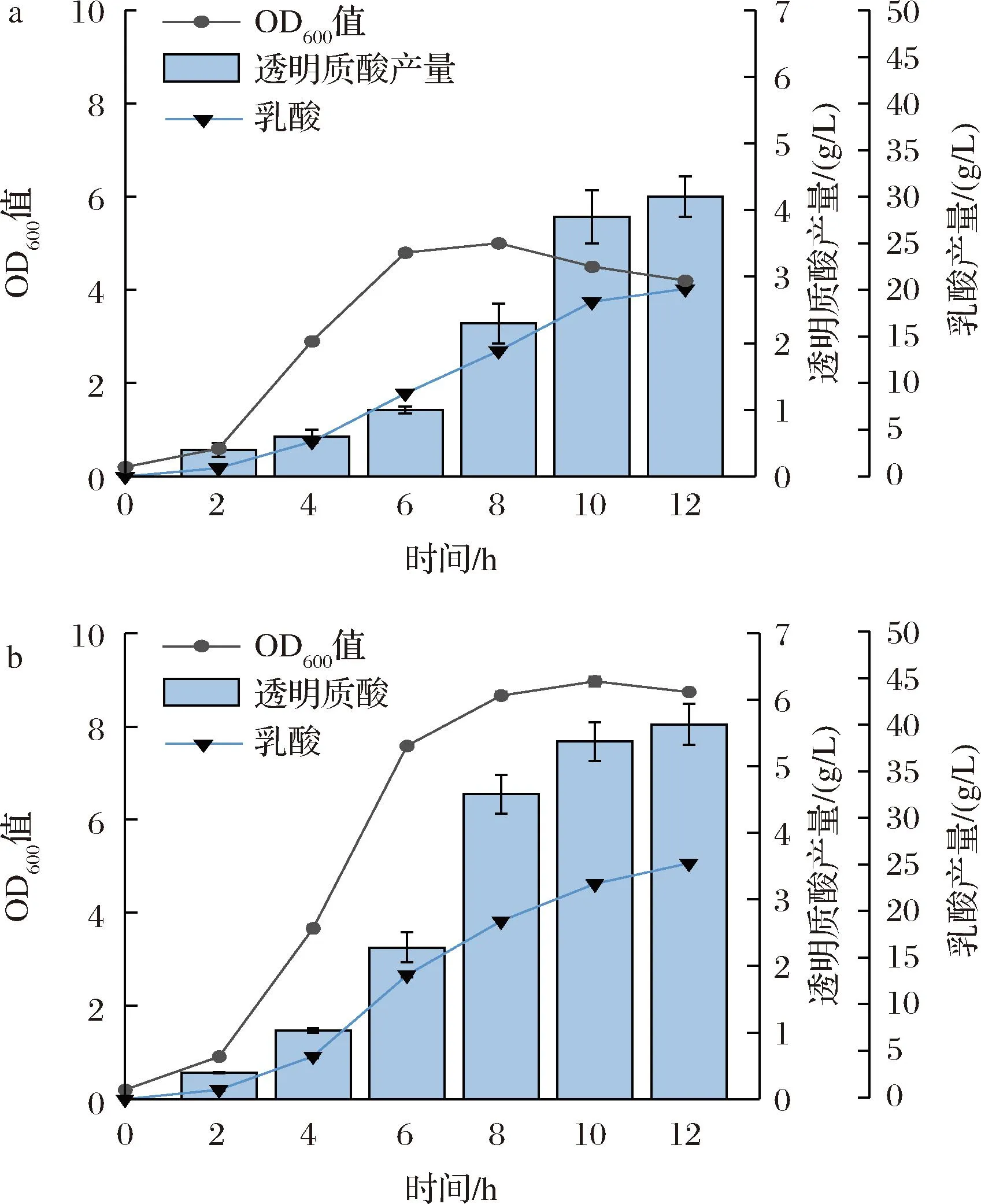
a-未优化菌株3L罐分批补料发酵情况b-培养基优化后菌株3L罐分批补料发酵情况图7 3 L罐分批补料发酵生产透明质酸
3 结论
兽疫链球菌是目前工业上透明质酸发酵生产的主要生产菌株,也是唯一可以生产食品用透明质酸原料的菌种。但兽疫链球菌对培养基的要求远比谷氨酸棒杆菌等菌种高,发酵培养基中需要添加大量的酵母粉等营养成分。分析其遗传特征和代谢特征将有望对该菌种的改造奠定基础。本研究通过对兽疫链球菌WSH-24进行全基因组测序,发现了该菌株具有高效的糖酵解和乳酸合成能力以及不完整的三羧酸循环。此外,结合组学分析及生长曲线实验分析,确定了兽疫链球菌WSH-24为缬氨酸、谷氨酰胺、精氨酸和色氨酸4种氨基酸缺陷型,同时维生素B5、维生素B7和维生素B12的合成基因转录水平过低不足以维持菌体生长。结合上述结果,通过额外添加必需的氨基酸和B族维生素,优化培养基组分,最终3 L发酵罐中透明质酸产量可达5.63 g/L,生产强度可达0.31 g/(L·h),相较优化前提高33.33%。开发兽疫链球菌基因编辑工具,回补部分缺失的氨基酸代谢途径,有望降低兽疫链球菌对丰富培养基培养条件的依赖度。同时,兽疫链球菌属于乳酸菌,其发酵过程消耗的葡萄糖被大量的转化为乳酸副产物,以乳酸脱氢酶编码基因ldh作为靶点,采用基因编辑系统对其进行改造,实现碳代谢流调控[22]增加葡萄糖/透明质酸转化率,有利于透明质酸产量的进一步提升。本研究为透明质酸的产量提升提供了指导,同时为兽疫链球菌的应用拓宽提供了支撑。
