M1型巨噬细胞来源的外泌体微小RNA-16-5p对心房肌细胞电生理的影响
2024-03-01程燕妮王学文曹真付韫韬柯元甲郭珂欣李雅佳龙晓建赵庆彦
程燕妮 王学文 曹真 付韫韬 柯元甲 郭珂欣 李雅佳 龙晓建 赵庆彦
近年来研究表明外泌体在心房颤动(简称房颤)的发生发展中起重要作用[1]。外泌体可通过调节细胞间的信息交流从而调控基因表达,影响心房重构和房颤的发生[2]。有研究结果显示巨噬细胞来源的富含微小RNA(miRNA,miR)的外泌体可调控心肌细胞炎症反应和电重构等病理过程[3]。miRNA是外泌体介导细胞间信号通讯的重要功能分子。研究发现,miR-16-5p可促进心肌细胞的内质网应激和氧化应激,抑制miR-16-5p表达可减少细胞凋亡及炎症,减轻心肌损伤[4]。既往研究已证实炎症和房颤的关系密切,临床和基础研究均发现房颤发生时心房M1型巨噬细胞浸润明显增多[5-6]。但M1型巨噬细胞分泌的外泌体miR-16-5p对心肌细胞电重构是否有作用尚不明确。本研究旨在探讨M1型巨噬细胞来源的外泌体miR-16-5p对心房肌细胞电生理的影响及潜在机制。
材料与方法
1.材料:RAW264.7细胞(小鼠单核巨噬细胞系)、HL-1细胞(小鼠心房肌细胞系)均购于武汉Procell实验室。脂多糖(LPS)购于Sigma公司,中性鞘磷脂酶抑制剂(GW4869,一种外泌体抑制剂)购于MCE公司,转染试剂Lipofectamine 6000(Lipo6000)、蛋白定量试剂盒(BCA试剂盒)均购于碧云天公司,RNA提取试剂(Trizol)购于TakaRa公司,细胞快速裂解液(RIPA裂解液)、第一链cDNA合成试剂盒、蛋白激酶B(AKT)抗体、肿瘤易感基因101蛋白(TSG101)抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购于赛维尔生物科技有限公司,磷脂酰肌醇激酶(PI3K)抗体、磷酸化AKT(p-AKT)抗体均购于爱博泰克生物科技有限公司,CD81购于三鹰公司,miR-16-5p阴性对照(miR-16-5p NC)、miR-16-5p模拟物(miR-16-5p mimics)及miR-16-5p抑制物(miR-16-5p inhibitor)均由武汉勤达创新生物科技有限公司合成。
2.方法
(1)巨噬细胞的培养及分组:首先将RAW264.7细胞接种在含有10%胎牛血清的高糖培养基的大皿中并置于37 ℃、5%CO2环境中培养,当细胞增殖至密度达到80%~90%时进行传代,将细胞分为5组:①LPS组:LPS诱导刺激RAW264.7细胞24 h使其分化为M1型巨噬细胞后不施加任何干预;②miR-16-5p NC组:将miR-16-5p NC转染RAW264.7细胞后诱导分化;③miR-16-5p mimics组:将miR-16-5p mimics转染RAW264.7细胞使miR-16-5p过表达,再诱导分化;④miR-16-5p inhibitor组:将miR-16-5p inhibitor转染RAW264.7细胞抑制miR-16-5p表达,再诱导分化;⑤LPS+GW4869组:RAW264.7细胞经LPS诱导完成后,更换新鲜培养基并加入10 μM GW4869继续培养48~72 h。
(2)巨噬细胞的诱导:将巨噬细胞以1×106个细胞/孔接种于六孔板中,每孔添加LPS(500 ng/ml)刺激24 h分化为M1型巨噬细胞,诱导结束后用磷酸盐缓冲液(PBS)洗涤细胞1~2次,加入含10%胎牛血清的高糖培养基中继续培养,采用光学显微镜观察巨噬细胞形态变化,采用免疫荧光观察未分化组及分化组巨噬细胞标志物小鼠含生长因子样模体黏液样激素样受体(F4/80)和诱导型一氧化氮合酶(iNOS)表达水平,采用实时荧光PCR(qRT-PCR)检测M1型巨噬细胞特定表面受体标记物肿瘤坏死因子(TNF)-α和iNOS表达情况。
(3)巨噬细胞转染miR-16-5p:首先向250 μl的高糖培养基中加入5 μl的lipo6000转染试剂,轻轻吹打使之混匀,室温静置5 min,另向250 μl的高糖培养基中分别加入5 μl miR-16-5p NC/mimics/inhibitor,轻轻吹打混匀,将含有lipo6000的高糖培养基分别与含有miR-16-5p NC/mimics/inhibitor的高糖培养基混合配置成转染复合物并充分混匀,室温静置20 min。将六孔板接种好的细胞更换为无血清培养基,分别将转染复合物加入对应六孔板的各个孔中,培养4~6 h后更换为完全培养基,加入LPS诱导为M1型巨噬细胞,继续培养细胞48 h。
(4)qRT-PCR检测:巨噬细胞分别转染miR-16-5p NC、miR-16-5p mimics、miR-16-5p inhibitor 48 h后,trizol提取总RNA并测定浓度及纯度,按照第一链cDNA合成试剂盒说明书操作将其逆转录为cDNA,进行定量PCR扩增,以U6为内参基因,各引物序列如表1所示。每个样品均设3个复孔,以2-ΔΔCt法计算miR-16-5p相对表达水平。

表1 qRT-PCR引物序列
(5)外泌体的提取及鉴定:收取各组细胞上清液,采用超速离心法收集外泌体,4 ℃低温冷冻离心机中以300 g离心10 min,去除沉淀;2 000 g离心10 min,去除沉淀;10 000 g离心30 min,收集上清液,用滤过膜过滤后,以100 000 g离心2 h,收集沉淀,加入适量PBS重悬。采用透射电镜法鉴定外泌体,将外泌体重悬液用2.5%戊二醛在4 ℃冰箱固定过夜,将样本滴置在碳支持膜铜网上3~5 min,滤纸吸掉多余的液体,滴加2%磷钨酸在碳支持膜铜网上静置2~3 min,用滤纸吸去多余液体,室温干燥,透射电子显微镜下观察外泌体形态,并采集图像。采用蛋白质免疫印记法(Western blot)检测外泌体标志蛋白CD81和TSG101。
(6)HL-1细胞快速起搏及分组:采用快速电刺激构建房颤细胞模型,用电烙铁在培养皿盖两侧打孔,将灭菌的碳电极(直径0.5 mm)分别置入两侧孔中,电极一侧与培养皿中的培养基接触,另一端连接刺激系(Master 8以色列),以1.0 V/cm的电压、10 Hz频率刺激HL-1细胞48 h建立房颤细胞模型。起搏HL-1细胞分为5组:A组(起搏HL-1细胞+LPS组外泌体)、B组(起搏HL-1细胞+miR-16-5p NC组外泌体)、C组(起搏HL-1细胞+miR-16-5p mimics组外泌体)、D组(起搏HL-1细胞+miR-16-5p inhibitor组外泌体)、E组(起搏HL-1细胞+LPS+GW4869组外泌体)。将提取的各组外泌体与对应分组的HL-1细胞共培养48 h。
(7)全细胞膜片钳检测HL-1细胞动作电位:首先用水平电极拉制仪(PB-7,日本Narishige公司)拉伸玻璃电极,从尾部灌充电极内液,入水电阻约为4~10 MΩ。在显微镜下选取合适细胞后,通过微操纵器将微电极推向细胞并紧贴细胞表面,同时观测微电极电阻变化,待细胞与微电极形成巨阻封接,破膜后可形成全细胞记录方式。将膜片钳设定为电流钳模式,记录HL-1细胞动作电位时限,测量复极化达50%和90%的动作电位时限(APD50、APD90)。
(8)Western blot检测各组心房肌细胞PI3K、p-AKT、AKT蛋白表达水平:将各组心房肌细胞用PBS清洗1~2次,加入RIPA裂解液提取总蛋白,BCA法进行蛋白定量。各组等样上量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,蛋白条带分离后电转至硝酸纤维素膜上,室温下用无血清快速封闭液封闭30 min,洗膜3次,孵育对应一抗过夜,再次洗膜3次,孵育对应二抗,洗膜后使用化学发光试剂盒进行显影拍照,采用Image J软件进行条带灰度值分析。
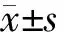
结 果
1.M1型巨噬细胞的鉴定:未分化RAW264.7细胞在倒置显微镜下为圆形,经过LPS诱导为M1型巨噬细胞后,细胞生出伪足,形态发生变化。免疫荧光检测M1型巨噬细胞标记物结果显示,相对于未分化巨噬细胞,LPS诱导后M1型巨噬细胞特异性标志物荧光强度明显增高。见图1。PCR检测LPS诱导后M1型巨噬细胞表面特异性受体TNF-α和iNOS的mRNA表达水平均高于未分化巨噬细胞(4.79±0.93比1.13±0.07;3.80±0.37比0.98±0.04,P均<0.01)。

图1 巨噬细胞免疫荧光检测结果[A~D依次为未分化巨噬细胞的细胞核(DAPI)、F4/80、iNOS、Merge,×400;E~H依次为LPS诱导后M1型巨噬巨噬细胞的DAPI、F4/80、iNOS、Merge,×400,图H中箭头所示为M1型巨噬细胞生出伪足]
2.miR-16-5p NC组、miR-16-5p mimics组及miR-16-5p inhibitor组巨噬细胞miR-16-5p相对表达水平比较:miR-16-5p NC组、miR-16-5p mimics组及miR-16-5p inhibitor组巨噬细胞miR-16-5p相对表达水平分别为1.03±0.04、13.92±3.34、0.42±0.05,其中miR-16-5p mimics组高于miR-16-5p NC组(P<0.001),而miR-16-5p inhibitor组低于miR-16-5p NC组(P<0.05)。
3.外泌体的鉴定:各组外泌体呈球状囊泡样结构,大小为20~200 nm,见图2,符合外泌体的形态特征。各组外泌体采用Western blot检测其标志蛋白CD81和TSG101表达水平,二者均明显表达,提取的外泌体可供后续实验使用。
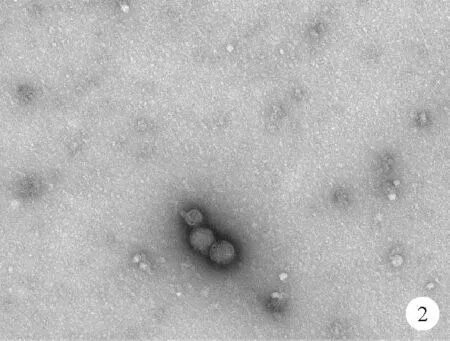
图2 外泌体电镜图(×10 000)
4.A组、B组、C组、D组及E组HL-1细胞动作电位比较:A组和B组HL-1细胞APD50和APD90比较差异均无统计学意义(P>0.05);C组HL-1细胞APD50和APD90均短于A组(P<0.05);D组及E组HL-1细胞APD50和APD90均长于A组(P<0.01)。见图3和表2。
图3 A组、B组、C组、D组及E组HL-1细胞典型动作电位

表2 A组、B组、C组、D组及E组HL-1细胞动作电位比较
5.A组、B组、C组、D组及E组HL-1细胞相关蛋白表达水平比较:A组和B组HL-1细胞PI3K表达水平、p-AKT/AKT比较差异均无统计学意义(P>0.05);C组HL-1细胞PI3K表达水平、p-AKT/AKT均低于A组(P<0.001);D组及E组HL-1细胞PI3K表达水平、p-AKT/AKT均高于A组(P<0.001);5组HL-1细胞AKT表达水平比较差异均无统计学意义(P>0.05)。见表3。

表3 A组、B组、C组、D组及E组HL-1细胞相关蛋白表达水平比较
讨 论
心脏不同类型细胞分泌的外泌体通过介导各种信号转导参与心房重构及炎症反应,形成房颤发生的重要病理基质。Li等[7]发现成纤维细胞来源的外泌体通过降低L型钙通道Cav1.2蛋白的表达来增加房颤的易感性。Shaihov等[8]发现心外膜脂肪源性外泌体可缩短多能干细胞源性心肌细胞的动作电位持续时间,使其发生电重构。我们前期研究发现,快速心房起搏犬心外膜脂肪组织存在大量促炎型巨噬细胞浸润,向心外膜脂肪组织注射氯膦酸二钠脂质体后,心房周围巨噬细胞浸润明显减少,房颤不易诱发,且维持时间缩短[6]。快速心房起搏犬心房组织和静脉血中外泌体含量升高,静脉注射外泌体抑制剂可减轻心房纤维化及炎症反应,降低房颤的易感性[9]。为探讨M1型巨噬细胞来源的外泌体对心房肌细胞电生理的影响及具体机制,我们将各组巨噬细胞外泌体与快速起搏心房肌细胞共培养并使用全膜片钳记录动作电位,结果发现M1型巨噬细胞来源的外泌体使心房肌细胞动作电位时限明显缩短,而加入GW4869抑制外泌体分泌使心房肌细胞动作电位时限相对延长。miRNA是外泌体介导细胞间信号通讯的重要功能分子。已有研究表明,M1巨噬细胞来源的外泌体miR-29a介导心肌细胞NOD样受体热蛋白结构域蛋白3(NLRP3)的激活[10],而心肌细胞NLRP3的激活可上调Ryanodine受体2(RyR2)的表达,促进肌浆网异常的钙释放。Toro等[4]证实miR-16-5p的过表达促进心肌细胞的氧化应激,靶向miR-16-5p可能在内质网应激介导的心脏损伤中发挥心脏保护作用。为进一步研究M1型巨噬细胞外泌体中miR-16-5p对心房肌动作电位的影响,我们通过向巨噬细胞转染miR-16-5p,发现miR-16-5p过表达使起搏心房肌细胞动作电位时限缩短,而沉默miR-16-5p基因则使起搏心房肌细胞动作电位时限相对延长,以上结果表明M1型巨噬细胞来源的外泌体miR-16-5p可缩短心房肌细胞动作电位时限。
已有研究证实PI3K是miR-16-5p的直接靶点,miR-16-5p可负向调控PI3K的表达,进而影响其下游蛋白表达,促进细胞自噬和调亡[11-12]。张飞龙等[13]研究发现下调PI3K/AKT/内皮型一氧化氮合酶(eNOS)通路可增加糖尿病大鼠房颤的易感性。Ko等[14]研究发现快速起搏HL-1细胞中PI3K/Akt信号转导降低,通过影响心房肌细胞的晚钠电流参与心肌电重构。本研究分别检测5组起搏HL-1细胞PI3K及其下游蛋白AKT、p-AKT表达情况,结果显示miR-16-5p过表达下调PI3K和p-Akt的表达水平,而对细胞中总Akt的影响可忽略不计,使用miR-16-5p抑制物可上调PI3K和p-Akt的表达水平。
综上所述,M1型巨噬细胞外泌体miR-16-5p可缩短心房肌细胞动作电位时限,可能与抑制PI3K/AKT通路有关。抑制M1型巨噬细胞外泌体分泌或抑制miR-16-5p表达可减缓快速起搏心房肌细胞电重构的发生,但对电重构相关离子通道是否有影响及具体机制需进一步深入研究。
