紫色光合细菌LH1-RC复合物的结构生物学研究进展*
2024-02-29岳星宇王征宇于龙江
岳星宇,王征宇,于龙江†
①中国科学院植物研究所 光生物学重点实验室,北京 100093;②中国科学院大学,北京 100049;③茨城大学理学部,日本水户 310-8512
光合作用是地球上最大规模的能量和物质转换过程,是自然界中最重要的化学反应之一,同时也是人类社会赖以生存和发展的物质基础。在生命起源不久后,光合细菌便作为可以进行光合作用的古老生物出现在地球上,并通过复杂的途径进化出了目前所发现的各种类型的光合生物及代谢途径[1]。
在20世纪初期,科学家们发现光合细菌可以利用外源有机化合物作为碳源并利用光能进行光异养生长的过程,非常类似于绿色植物中的光合作用反应[2]。但不同的是,这种紫色非硫细菌并不产生氧气,不能满足最初为绿色植物定义的“光合作用”准则,因此当时的生物学家并不认为这一类微生物为“光养生物”。随后的几十年间,科学家们就紫色硫细菌的光合反应过程进行了深入研究,证实了这类微生物可以利用二氧化碳和硫化氢在光照下生长[3],认为发生在硫细菌中的这一代谢过程是与绿色植物光合作用类似的反应,并且重新给出了光合作用反应的化学方程式[4]。生物学家们开始逐渐接受这一观点,并证实厌氧光异养生长广泛发生在不同种类的光合细菌当中。这些基于叶绿素的光合作用广泛分布于7类群的细菌中:紫细菌(purple bacteria)、绿硫细菌(green sulfur bacteria)、丝状无氧光养生物(filamentous anoxygenic phototrophs)、日光杆菌(heliobacteria)、氯酸杆菌(chloroacidobacteria)、芽单胞菌(gemmatimonadetes)和蓝细菌(cyanobacteria)[1]。其中,紫细菌因其易培养、生长速度快、具有单一的光系统(Ⅱ型),一直以来都是光合作用分子生物学、生物化学、遗传学和结构生物学研究的重要模式生物,并且随着研究的深入,这一古老的原核生物的光合作用分子机制逐步得以解析。在紫细菌中通常含有两种捕光天线复合物(light-harvesting complexes,LH),分别为核心捕光天线复合物LH1和外周捕光天线复合物LH2。LH2在一些紫细菌,如Rhodospirillum(Rsp.)rubrum、Halorhodospira(Hlr.)halochloris等中不存在。LH1则存在于所有的紫细菌中,围绕反应中心(reaction center, RC)形成核心捕光天线-反应中心超级复合物(LH1-RC core complex, LH1-RC)。在紫细菌的光合作用反应中,光能首先被光合膜上的LH2和LH1所捕获,进而传递到RC进行电荷分离反应,产生的电子依次传递,最终将质醌还原为氢醌。氢醌离开RC后进入醌池(quinone pool, Q pool),被细胞色素bc1(cytochromebc1, Cytbc1)复合物重新氧化为醌,同时将电子转移到周质侧的可溶性电子载体蛋白,最终将电子传递到RC中被光氧化的特殊对分子(P),使RC回到初始状态,形成环式电子传递链。与此同时,光合膜的两侧会形成跨膜质子梯度,用来启动ATP合酶(ATPase)产生ATP[5-7](图1)。RC和LH2的结构生物学研究已有几十年的历史,并取得了很多重要的成果,但是LH1-RC由于其自身的特殊性导致结构生物学研究进展缓慢。直到近年来,随着同步辐射光源和冷冻电镜技术的不断发展,不同光合细菌来源的LH1-RC复合物的高分辨率结构才得以解析,为我们理解这些复合物的多样性和相关的分子机制提供了必不可少的结构基础。本文将就这些复合物的结构生物学研究进展进行系统的介绍。
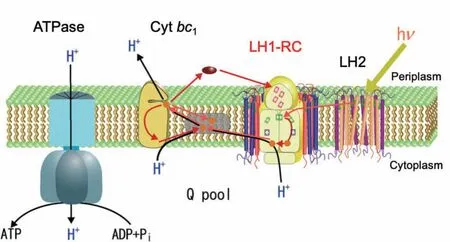
图1 紫色光合细菌主要光合膜复合物示意图。光能首先被LH2和LH1捕获,然后传递到RC进行电荷分离,电子依次传递,最终传递给Cyt bc1,并通过可溶性的电子载体蛋白将被光氧化的RC还原,形成环式电子传递链。与此同时,光合膜的两侧形成电化学梯度来驱动ATP合酶合成ATP,从而完成光能到化学能的转换
1 反应中心复合物
光合作用单元(photosynthetic unit)的概念是在20世纪30年代由R. Emerson等人提出的[8-9],指的是可以独立地执行光合作用反应过程的最小单位。它通常是包含多组分的色素-蛋白复合物,可以接收由捕光天线复合物传递而来的能量并进行光驱动的电荷分离反应,形成跨膜的质子梯度,完成能量转换和物质转换。在此基础上,Clayton于1963年正式提出紫细菌“反应中心”这一术语,用以区别于光合作用单元[10]。随后,Clayton便开始在紫细菌中分离纯化RC复合物,通过用去垢剂Triton X-100处理光合膜囊泡,首次获得了Rhodobacter(Rba.)sphaeroides的RC复合物样品[11]。在此后的数十年间,Clayton与合作者一起运用生物物理和生物化学等手段对这些纯化产物进行了理化性质的表征。在获得了纯化的RC复合物之后,研究人员也开始尝试获得其晶体,以通过X射线晶体学技术对三维结构进行解析。在20世纪80年代初,Michel和Feher等人先后获得了Blastochloris(Blc.)viridis和Rba.sphaeroides的RC晶体,并解析了它们的三维结构[12-13]。Blc.viridis的RC结构是人类历史上第一个获得解析的膜蛋白复合物三维结构,打破了膜蛋白不能结晶的神话,也拉开了包括LH2和LH1-RC等复合物在内的膜蛋白结构生物学研究的序幕。鉴于其里程碑式的科学意义,Hartmut Michel、Johann Deisenhofer和Robert Huber三人于1988年被授予诺贝尔化学奖。
截至目前,研究人员共获得了三种不同紫细菌R C 高分辨率的晶体结构(图2),分别来源于Blc.viridis、Rba.sphaeroides和Thermochromatium(Tch.)tepidum。从这些结构中可以看出,RC复合物由三个或四个亚基组成,分别为L(light)、M(medium)和H(heavy)亚基。另外,在一些物种中存在一个结合4个c型血红素的亚基,称为Cyt亚基(cytochrome)。L和M亚基均为五次跨膜α螺旋结构,具有伪双重对称性,其对称轴垂直于膜平面。L及M亚基作为支架蛋白以非共价键的方式结合可以供电子传递的辅因子,并通过其对称性使辅因子形成了两个分支,分别为A分支及B分支。这些辅因子通常包括4个细菌叶绿素分子(bacteriochlorophylls, BChls)、2个脱镁细菌叶绿素分子(bacteriopheophytins,BPhes)、2个醌分子(ubiquinones)、1个类胡萝卜素分子及1个金属离子(一般是Fe2+,在其他物种如绿色非硫细菌Roseiflexus(Rfx.)castenholzii中为Mn2+)。在辅因子的4个细菌叶绿素分子中,位于周质侧的2个细菌叶绿素分子以二聚体的形式存在,它可以使吸收的光子发生电荷分离,被称为特殊对分子。由于其Qy波长的最大吸收位于870 nm,因而也被称为P870[14]。A分支与B分支中的辅因子在不同物种中有一定的变化。如:研究人员在紫细菌Rhodopseudomonas(Rps.)palustris中RC-LH114-W型的复合物中发现其不存在QB位点,这可能是由于RC-LH114-W型复合物相对于RC-LH116型复合物有更高的醌还原活性[15];在Rba.veldkampii和Rhodobaca bogoriensis的LH1-RC复合物中发现,其分支B中出现了一个额外的BPhe[16-17];绿色非硫细菌Roseiflexus(Rfx.)castenholzii反应中心分支B的附属BChl被替换为BPhe[19-20]。QA一般为泛醌(ubiquinone, UQ)、甲基荼醌(menaquinone,MQ)或在其他物种如Rsp.rubrum中为红醌(rhodoquinone, RQ),分支B中的醌类及类胡萝卜素分子的种类在不同物种及不同生长环境条件下有所不同[18]。在绿色非硫细菌Rfx.castenholzii中QA及QB位点均存在MQ[19-20],而非在紫细菌QB位点常见的UQ。
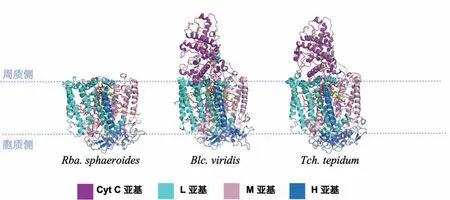
图2 不同紫色光合细菌中单独解析的反应中心复合物的结构。Rba. sphaeroides的反应中心含有H、M和L三个亚基,而Blc.viridis和Tch. tepidum的反应中心在周质侧还含有一个结合了4个血红素的Cyt亚基。蛋白亚基颜色设置如图中色块所示
H亚基通过N端的跨膜螺旋固定在光合膜上,其主要的结构域附着靠近在L和M亚基的胞质侧。H亚基的作用被认为是保护反应中心的醌位点不受胞质中离子的影响,并且为QB质子化提供特定的质子通道[21]。在含有PufX亚基的紫细菌中,H亚基会与PufX亚基胞质侧相互作用,在LH1-RC复合物组装过程中发挥一定的功能[22]。同时也有研究表明在失去H亚基后,RC仍可正常工作[23]。虽然H亚基广泛存在于紫细菌反应中心中,但在其他物种如绿色非硫细菌Rfx.castenholzii反应中心中便缺乏H亚基,其跨膜螺旋位置被仅含有一个跨膜螺旋的小亚基Protein I代替,因而该跨膜螺旋被认为对LH1-RC复合物的稳定性起到了重要作用[18-19]。Gemmatimonas phototrophica中的H亚基则分为两个结构域,分别为较小的跨膜多肽Ht及位于胞质侧较大的多肽Hc[24]。此外,在紫细菌Rba.capsulatus反应中心QA位点处鉴定出了H亚基独特的短α螺旋结构,这与其他紫细菌在相同区域所鉴定出的二级结构存在明显差异,额外的短α螺旋结构可能在将QA位点与胞质间隔离方面起到一定的作用[25]。
在含有Cyt亚基的RC复合物中,绝大多数的Cyt亚基没有跨膜区域,而是通过其N端的半胱氨酸酰化形成脂蛋白锚定在光合膜的周质侧,同时Cyt亚基也会通过非共价作用与L和M亚基相互作用形成稳定的复合物。在一些物种,如绿色非硫细菌Rfx.castenholzii[19-20]及紫细菌Rhodopila(Rpi.)globiformis中的Cyt亚基缺失N端半胱氨酸残基,但是N端存在一个跨膜螺旋,可以起到相似的锚定作用[26]。在含有Cyt亚基的RC中,水溶性电子载体蛋白通过与Cyt亚基中的Heme 1基团接触从而将电子传递到特殊对分子将其还原,在不含Cyt亚基的物种中则直接将电子传递到特殊对分子。可溶性电子载体一般为Cytc2[27],此外也发现了其他种类的电子载体如Cytc8[28]、Cytcy[29]、Cytc2m[30]及高电位铁硫蛋白HiPIP[31]等。Adir等人在解析了Rba.sphaeroides的RC晶体结构的基础上,通过共结晶的方法获得了RC:Cytc2的晶体结构[32]。Yu等人则在解析了Tch.tepidumLH1-RC复合物的基础上,通过类似的方法解析了LH1-RC:HiPIP共复合物的结晶结构[33]。这两个结构的解析,为研究瞬时生物能量传递事件、揭示热力学上不利于发生的跨蛋白间长程电子传递提供了基础。
蛋白质分子机器在发挥功能的时候通常是动态的,不断发展的时间分辨结构解析技术为蛋白复合物,特别是光敏蛋白的动态结构解析提供了条件。Wöhri等人通过时间分辨劳厄衍射技术探测了Blc.viridisRC光诱导构象变化过程,发现RC中特殊叶绿素对被激发后3 ms内,位于紫色细菌RC中保守的Tyr-L162的羟基朝特殊对移动了1.3 Å的距离,并与Thr-M185及一个水分子(Wat501)的羟基产生了新的氢键相互作用,从而稳定了Tyr-L162去质子化状态。Tyr-L162的去质子化耦合构象切换,可能有助于在古老的反应中心自发形成酪氨酸自由基产生化学势,从而揭示了紫色细菌光合作用初级电荷分离反应的机制[34]。
Dods等人利用时间分辨-串行飞秒晶体学技术对紫细菌Blc.viridisRC复合物的动态结构进行研究,发现由光触发的结构扰动首先发生在反应中心的特殊叶绿素对分子上。这对叶绿素分子被快速地光氧化,电子从这对叶绿素分子转移到位于胞质侧的甲基萘醌分子上,并使这个辅因子朝下游更低的电势复合物移动。这项研究首次用实验证明了长久以来通过光谱动力学分析的紫色光合细菌反应中心电子传递过程,同时观测结果揭示了蛋白质通过构型动态变化来稳定电子转移反应过程[35]。
2 外周捕光天线复合物
含有外周捕光天线的光合细菌中,外周捕光天线复合物在光合膜上通常是大量存在的,并且在光谱上表现出不同的吸收特性。一些物种如紫细菌Rps.acidophilastrain 7050中含有与B800-850 LH2复合物光谱吸收特性不同的B800-820 LH3复合物[36]。此外,一些物种如紫细菌Rps.palustris在低光照培养条件下会形成仅在800 nm处存在吸收的LH4复合物[37]。继研究人员于1985年及1987年获得Blc.viridis和Rba.sphaeroides反应中心复合物晶体结构,McDermott等人于1995年获得了紫细菌Rps.acidophila外周捕光天线复合物LH2的高分辨率晶体结构[38]。这是研究人员在光合细菌中解析的第一个捕光天线复合物结构,被认为是RC复合物结构解析之后的第二个具有里程碑意义的研究成果[7]。紧随其后,1996年Michel团队解析了Rsp.molischianum的LH2复合物的晶体结构[39]。在此后的20多年里,尽管科学家对其他LH2复合物的结构开展了研究,但是结果都不尽人意,一直都没有再获得过高分辨率的结构[40]。直到近几年,研究人员通过冷冻电镜技术并结合分子生物学方法获得了来自Marichromatium(Mch.)purpuratum2.4 Å LH2结构[41]、Rba.sphaeroides2.1 Å LH2结构[42]及Rps.palustris中PucA-LH2、PucB-LH2、PucD-LH2和PucE-LH2四个结构[43]。LH2复合物由7~9对αβ异二聚体、多个细菌叶绿素a及类胡萝卜素组成。不同物种的LH2其αβ异二聚体数量及光谱吸收特性均有所不同。如在上述几个物种中,LH2中分别由7、8及9对αβ异二聚体组成。α和β多肽通常由40~70个氨基酸组成,形成疏水的跨膜结构域和在光合膜两侧延伸的极性C端及N端结构域。细菌叶绿素通过LH2跨膜区域保守的氨基酸残基与细菌叶绿素中心的Mg2+配位。同时,相邻的LH2亚基之间的距离在同一物种间基本保持一致,这有利于激发能沿着LH2环有效传递。此外,在Rps.palustrisLH2中含有额外的6个γ多肽,同时,由于PucD-LH2 B850型BChl的C31基团不参与形成αβ异二聚体氢键相互作用网络,其Qy吸收由850 nm蓝移至800 nm处(图3)。

图3 不同紫色光合细菌中外周捕光天线LH2复合物的结构。左侧为从周质侧俯视观察,右侧为从光合膜平行方向观察。Rps. acidophila、Rsp. molischianum、Rba.sphaeroides、Mch. purpuratum和Rps. palustris的LH2分别由7~9对αβ多肽组成。虽然αβ多肽通常含有多拷贝基因,但目前所解析的结构中都是由αβ均质二聚体组成。蛋白亚基和色素颜色设置如图中色块所示
3 核心捕光天线及反应中心(LH1-RC)复合物
核心捕光天线复合物LH1与LH2的基本组成单元类似,一般由跨膜的α和β多肽、细菌叶绿素和类胡萝卜素组成,主要区别是αβ异二聚体的数量。RC和LH2的结构解析之后,LH1-RC复合物的精细结构引起了广泛的关注,但由于其组成的复杂性和独特的整体结构,经过近30年的努力,一直都没有获得高分辨率的三维结构。在这期间,发表了大量关于不同物种来源的LH1-RC复合物分离纯化、理化性质表征和低分辨率的结构测定的研究成果,可是高分辨率结构的缺失严重阻碍了人们对该复合物的认识。
1995年,Karrasch等人通过生长二维晶体并结合电子显微镜技术获得了8.5 ÅRsp.rubrum体外重组LH1复合物投影结构(projection structure)[44]。投影图像显示,LH1复合物由16个αβ异源二聚体组成了一个封闭的圆环。2002年,Jamieson等人发表了天然状态的Rsp.rubrumLH1-RC复合物8.5 Å的二维晶体投影结构[45],通过计算两种不同形式的晶体获得了两种投影结构。其中一个图像显示为圆形的LH1环,另一个则为椭圆形的LH1环。2003年,Scheuring等人通过原子力显微镜(AFM)研究了来自紫细菌Blc.viridis的光合膜[46],结果显示,当LH1环包围RC时,LH1环呈椭圆形,而当RC不存在时,LH1环逐渐松弛成圆形,该结果强有力地证实了LH1环的形状可以通过与RC相互作用来调节。2003年,Roszak等人在Rps.palustris中报道了首个LH1-RC 4.8 Å分辨率的晶体结构[47],这也是RC结构解析将近20年之后获得的首个接近于原子级分辨率的LH1-RC复合物晶体结构。Roszak等人的结果表明LH1环由15个αβ异源二聚体及相关的辅因子组成,同时在靠近QB位点的第16个αβ异源二聚体位置处存在一个名Protein-W的跨膜亚基,阻止了LH1环的闭合,该位点也被认为是潜在的醌交换通道。
在Roszak等人报道结构之后的十多年里,研究人员相继获得一些LH1-RC复合物的晶体,并通过X射线晶体学技术得到分辨率较低的三维结构[22,48]。直到2014年,Niwa等人获得了紫细菌Tch.tepidumLH1-RC 3.0 Å分辨率的晶体结构[49]。四年之后,Yu等人进一步将Tch.tepidumLH1-RC晶体结构分辨率突破性地提高至1.9 Å[50],这也是目前所获得的LH1-RC复合物中分辨率最高的,在整个结构中鉴定出了将近1 000个水分子。Tch.tepidumLH1-RC复合物由16个αβ异二聚体及RC四个亚基Cyt、M、L、H共36个亚基组成,每个αβ异二聚体中含有2个BChla分子、1个螺菌黄素分子及1个Ca2+。Ca2+与α和β多肽上氨基酸和2个水分子配位形成双金字塔式的配位,来介导αβ多肽之间的相互作用,从而有利于LH1亚基在周质侧的紧密连接(图4)。这与Yu等人之前获得的Sr/Ba取代型的LH1-RC复合物的晶体结构中Sr/Ba离子的结合略有不同[51],这些结果一起揭示了Ca2+的结合对稳定LH1环的构象起到一定的作用,从而有助于LH1 Qy跃迁红移及为提高LH1-RC复合物的热稳定性提供了坚实的结构基础[51-52]。同时,由于有LH1环状结构的保护,RC相比于之前的RC-only复合物更接近于天然状态,很多新的结构细节得以解析。
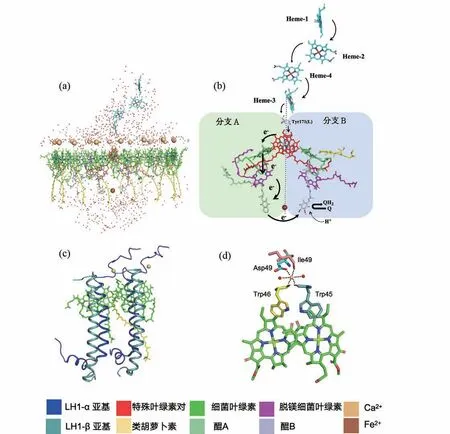
图4 高分辨率结构中所展示的LH1-RC复合物的结构细节(PDB: 5Y5S)。(a)LH1-RC复合物中所有辅因子和水分子的空间排布。(b)反应中心中辅因子的空间排布,包括4个细菌叶绿素、2个脱镁细菌叶绿素、2个醌分子、1个类胡萝卜素和1个非血红素铁。这些辅因子形成两个独立的横跨膜的分支(分支A和分支B),具有伪二重对称性(虚线),电荷分离和电子传递发生在A分支中。实线箭头指示的是光驱动电子传递的路径,虚线箭头表示从胞质侧接受两个质子,将可移动的QB还原成QBH2,进而从反应中心解离进入醌池。(c)具有代表性的两对LH1亚基,以及所结合的钙离子的位置。(d)钙离子结合位点放大图,参与钙离子结合的部分氨基酸残基同时也与细菌叶绿素分子相互作用。蛋白亚基和色素颜色设置如图中色块所示
2017年,诺贝尔化学奖授予了对冷冻电镜技术作出重大贡献的三位科学家,也预示着超大分子复合物的结构解析正式进入了冷冻电镜时代,不同细菌来源的LH1-RC复合物的结构解析进入了井喷状态,这也得益于几十年间的科学家们艰苦卓绝的不断努力。Blc.viridis、Rba.sphaeroides、Rsp.rubrum、Rps.palustris、Thiorhodovibrio(Trv.) strain 970、Rpi.globiformis、Allochromatium(Alc.)tepidum、Rba.veldkampii和Rba.capsulatus的LH1-RC结构相继被报道。总的来说,目前已解析的LH1-RC复合物结构多呈椭圆形,由16或17个αβ异源二聚体组成封闭的LH1环围绕RC,或由10~15个αβ异源二聚体组成开放的环围绕RC(图5)。在Rba.sphaeroides中存在二聚体形式的LH1-RC复合物,其LH1环由28个αβ异源二聚体组成S型阵列围绕两个RC[54-56],而芽单胞菌Gemmatimonas phototrophica的LH1-RC复合物由双LH1环围绕RC组成,这也是迄今为止所获得的尺寸最大的LH1-RC复合物[24]。在LH1-RC复合物中,每个LH1单元通常含有2~3个BChl分子,它们以椭圆形排列形成一个开放或封闭的LH1 BChl环,并在近红外区表现出不同的光谱吸收(图6),来自Blastochloris属和Halorhodospira属的紫细菌中含有BChlb,其LH1 Qy吸收带通常超过1 000 nm,这是目前已知的所有光合物种中可以进行光合作用所吸收的最长波长的光能[57-58]。相比之下,大多数紫细菌中含有BChla,其在880 nm附近存在LH1 Qy典型吸收[59-60]。但是一些含BChla的紫细菌存在不寻常的LH1 Qy波段,其Qy吸收带大于900 nm,如Roseospirillum(Rss.)parvum930I、Caldichromatium(Ccm.)japonicum、Tch.tepidum和Trv. strain 970分别在909、912、915、963 nm处存在LH1 Qy吸收[61-64]。在已知结构的LH1-RC复合物如Tch.tepidum、Trv. strain 970和Alc.tepidum中,LH1亚基中结合或部分结合钙离子[50,53,65-66]可导致其LH1 Qy吸收发生红移;一些物种中如紫细菌Blc.viridis的LH1中存在额外的γ亚基,被认为可以在增强LH1环刚性结构上起到与钙离子结合类似的作用,从而导致LH1 Qy红移[67]。此外,每个LH1亚基中类胡萝卜素的数量在不同物种中也不相同,例如紫细菌Rba.sphaeroides、Rba.capsulatus和Rfx.castenholzii的每个LH1亚基中非共价结合两个类胡萝卜素分子[25,54],而非其他紫细菌中常见的结合一个类胡萝卜素分子。此外一些研究表明,LH1环中类胡萝卜素和细菌叶绿素的排列可能对醌交换有一定的影响[25],即堵塞了可能的醌交换通道,这与LH1开环式的结构中的辅助小亚基有类似的效应。

图5 不同光合细菌中LH1-RC复合物的结构。LH1-RC复合物的结构生物学研究揭示了该复合物的多样性和模块化特性,虽然来自不同菌属,但是这些细菌均含有II型反应中心,由封闭或开口的LH1环包围着反应中心复合物,整体上具有一定的相似性。另外,虽然可以形成二聚体形式的LH1-RC复合物,但是单体的LH1-RC核心复合物比二聚体更广泛存在。蛋白亚基和色素颜色设置如图中色块所示
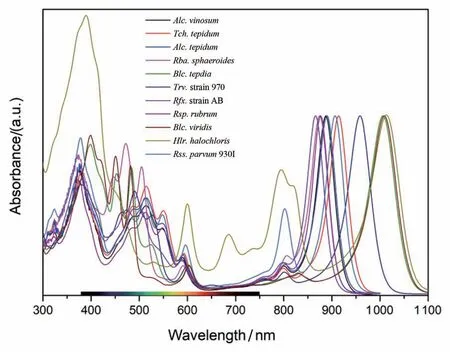
图6 目前已知的代表性的LH1-RC复合物的吸收光谱图。细菌叶绿素的Qy吸收主要分布在800~1 020 nm之间的红外区域,类胡萝卜素分子的吸收则主要位于450~550 nm的蓝绿光区域。绝大多数的LH1-RC只含有一类细菌叶绿素,极少数物种,如Rss. parvum 930I和Hlr. halocholiris的LH1-RC复合物同时含有两类细菌叶绿素。不同LH1-RC复合物吸收光谱参考图中标示
例如对于上述的Rps.palustris,Swainsbury等人通过冷冻电镜技术解析了高分辨率的两种形式的LH1-RC复合物结构[15],RC-LH114-W和RC-LH116。其中RC-LH116为闭合形式的LH1-RC复合物,占LH1-RC复合物总量的90%,而RCLH114-W为开环式的LH1-RC复合物,占LH1-RC复合物总量的10%。RC-LH114-W整体结构与之前报道的结果类似,但Protein W是通过形成三次跨膜螺旋并取代一个LH1亚基的位置,从而在LH1环上形成一个间隙。生化实验结果表明RC-LH114-W相对于RC-LH116具有更高的Cytc2氧化速率,意味着Protein W在介导LH1环开口并促进醌交换上起到重要作用。类似的情形还出现在含有PufX亚基的LH1-RC复合物中。一部分Rhodobacter属的紫细菌,如Rba.sphaeroides、Rba.veldkampii和Rba.capsulatus等中含有编码跨膜多肽PufX的基因,它在阻止LH1环闭合及LH1-RC复合物的二聚化上起到一定的作用[16,25,54]。半封闭的LH1环出现一个较大的间隙,被认为是介导醌交换的一个独特的通道。研究人员在敲除PufX基因后发现,LH1复合物形成由17个αβ异二聚体组成的封闭的环,并且这个突变体的光合效率明显下降。此外,Rba.sphaeroides的LH1-RC复合物中含有另一个多肽Protein Y (在其他论文中也被称为PufY)。研究表明,PufY的缺失会破坏位于开口附近的LH1亚基的稳定性,这可能会影响醌的转运速率[54]。在Blc.viridis中LH1环由17个αβ异二聚体及16个γ多肽组成并形成封闭状态。由于第17个γ多肽的缺失在LH1环上形成了一个间隙,这可能作为醌转运的通道[12]。与之类似的是在Rpi.globiformis中,LH1环由16个αβ异二聚体及11个γ样多肽组成并成封闭状态,αβ异二聚体和γ样多肽在结构上的不对称性使LH1环上形成了一部分间隙,这可能为醌的交换提供了一个有效的途径[26]。另外还有Rfx.castenholzii,由于其Cyt亚基的N-跨膜螺旋和外侧的TMx多肽所形成的异二聚体中不含有色素分子,而留下的孔隙也被认为可能是醌转运的潜在通道[20]。
4 展望
随着科学技术的飞速发展,紫色光合细菌光合膜复合物的结构生物学研究已经取得了一系列的重要进展。虽然高分辨率的LH1-RC结构为深入理解不同物种间复合物的多样性、紫细菌光合电子传递链中光能的吸收及能量传递等分子机制提供了最基本的信息,但仍存在一些未解决的问题。例如,目前仍无法确定控制LH1环组装和调节αβ多肽数量的分子机制,同时色素及辅因子在空间上相互协调并形成多样性的LH1-RC复合物的调控方式仍不清晰。深入了解紫细菌光合膜复合物的组装及调节机制,有利于研究人员设计高效稳定的人工光合系统,从而模拟自然界中的光合作用。同时,虽然研究人员基于解析的结构推测了醌在LH1环内外交换的可能的途径,但对于开放和闭合状态的LH1-RC复合物的醌交换速率及醌交换的分子机制仍并不清晰。该过程也是光合作用原初反应中关键限速步骤,可能为揭示光合效率调控机制提供重要的见解。近年来,冷冻电子断层成像技术(cryo-ET)开始发展,被认为是实现跨尺度生物成像的重要结构生物学手段。相比传统的冷冻电镜方法,cryo-ET技术有着更多的优势,如不需要分离纯化样品,无需使其脱离原生环境,能最大程度保留生物样品的自然状态。因此,研究人员可以通过冷冻电子断层成像、低温冷冻电镜技术、时间分辨串行飞秒晶体学技术、计算模拟、光谱学及基因遗传操作等研究方法进一步揭示目前存在的一些问题。相信未来研究人员能够更加深入理解紫细菌光合作用的分子机制,并为合成生物学等学科的发展及人工光合作用的开发及应用提供更多的思路和理论基础。
