植物光合作用原初反应与电子传递调控*
2024-02-29陈铸峰田利金
陈铸峰,田利金
中国科学院植物研究所 光生物学重点实验室,北京 100093
光合作用是地球上最重要的光生物化学反应,是作物产量与生物质形成的物质基础。在全球粮食需求日益增加、耕地面积不增反降的背景下,提高作物单产的任务愈加紧迫。传统的作物产量提升以栽培改良和作物耐逆-抗病性状改良为主,随着这方面改良潜力的充分发掘,作物产量提升的趋势已经放缓。相比之下,植物光合作用效率还有极大的提升空间,在作物增产方面的潜力有待释放。在未来,高光效改良有望成为作物育种的关键方向之一。
植物生长离不开光,但自然界中的光环境极为恶劣,光强和光质都时刻发生着剧烈的变化。“物竞天择,适者生存”,植物为应对复杂的光环境演化了多种光合作用调控机制,这保障了植物的生存和繁衍,孕育了五彩缤纷、生机勃勃的地球。然而,适者生存却非强者生存,自然界的演化以最佳的生存和繁衍为目标,而非人类所追求的最大生物量。自然的光合调控最大限度地保护植物免受强光和波动光损伤,却牺牲了相当的光能转化效率,伴随着大量的能量损失。换言之,自然界中的植物以“低能效”换取“低损耗”。随着现代学科交叉融合,多组学、分子育种及合成生物学技术的发展,以高效节能为目标改造乃至创制光能转化调控机制成为可能,理论和初期的实验均支持人为干预的新型植物光合调控机制将大幅提升光合效率并优化生物固碳效率。这方面的研究将为保障国家粮食安全、发展高效生物固碳技术提供重要的理论指导。
大多数作物利用太阳光能的效率在1%左右,而理论计算表明此效率具有非常大的提升空间,可以高于5%[1]。目前国际上已有不少聚焦于光合效率提升的科研进展,最近的进展可见相关综述[2]。提高光合作用效率的技术路线主要基于光反应和碳反应两方面:一方面是光合捕光、传能、转能以及电子传递链传递效率的优化;另一方面是光合固碳反应的优化,包括提高核酮糖-1,5-二磷酸羧化/加氧酶(ribulose-1,5-bisphosphatecarboxylase/oxygenase, RuBisCO)羧化活性、降低光呼吸等。本文将聚焦高等植物光合作用光反应,从捕光和电子传递两个方面介绍光合作用的动态调控机制,以期为优化光反应调控提供新思路。
植物光合作用光反应的发生场所位于叶绿体中的类囊体膜(图1),多数光反应调控机制也发生于此。光合作用的光反应包含原初反应、光合电子传递和光合磷酸化(图2)。光合原初反应指光系统II(photosystem II, PS)和光系统I(photosystem I, PSI)进行捕光并完成电荷分离,实现从光到电的转换。光合电子传递指电子在PSII和PSI的分级驱动下,通过电子传递链传递到铁氧还蛋白-NADP+还原酶,生成还原型烟酰胺腺嘌呤二核苷酸磷酸,即还原型辅酶Ⅱ(NADPH)。伴随着电子传递,细胞色素通过Q循环将质子泵入类囊体囊腔侧,加上PSII在囊腔侧氧化水释放出的质子,形成跨膜质子梯度,驱动ATP合酶生成ATP,即光合磷酸化。光反应的每一个具体过程均伴随着相应的调控机制,以确保精密的光合机器高效运转。
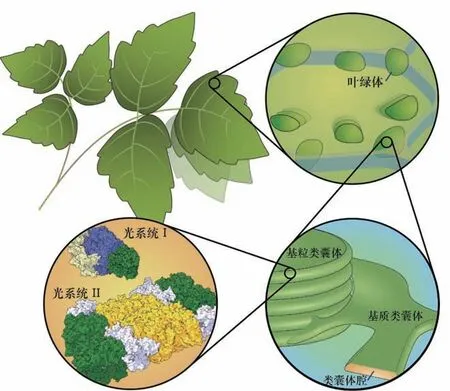
图1 高等植物光合作用场所概览。蛋白图像参考已有的结构数据(PDB: 5L8R, 5MDX)
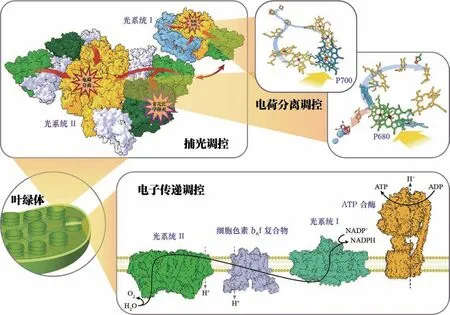
图2 光合调控途径概览。注意图中蛋白之间的距离、数量比例不代表真实情况。ADP (adenosine diphosphate),二磷酸腺苷;ATP (adenosine triphosphate),三磷酸腺苷;NADP+/NADPH (nicotinamide adenine dinucleotide phosphate),烟酰胺腺嘌呤二核苷酸磷酸(氧化/还原态)。蛋白和电子载体辅基图像参考已有的结构数据(PDB: 3wu2, 5L8R, 5MDX, 6FKF, 6RQF)
1 原初反应及其调控
原初反应包含捕光和电荷分离两个过程,发生场所为光系统I和光系统II。光系统由光合天线和光反应中心组成,其中天线吸收光子,将光能传递到反应中心,后者是电荷分离的场所。“光合天线+反应中心”的结构设计是植物适应太阳光的结果。对于光合作用而言,太阳光是相对稀疏的能量来源。粗略估算,即使在1 800 μE·m-2·s-1的充分阳光光照下,叶片中每个叶绿素每秒也只能获得约10个光子[3],而相较之下,清晨等时段的阳光低至10 μE·m-2·s-1。为了氧化一个水分子,光系统必须在较短时间内吸收9~10个光子。借助捕光天线增加反应中心的吸收截面积,可以确保光系统捕光的速率即使在阳光较弱时也足以驱动光反应(图3)。然而,捕光天线也给植物带来了额外的风险。正午的太阳光可以上百倍地强于清晨或黄昏时的光照,产生的光合激子如果不能及时用于光合反应,则会造成蛋白的光损伤,严重时会导致植物直接死亡。围绕着对大跨度光强变化的适应和光损伤的规避,植物在捕光和电荷分离层面具有多重调控机制。
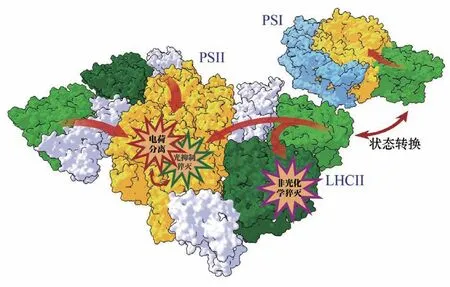
图3 光合捕光调控示意图。注意图中捕光复合物之间的距离不代表真实情况。LHCII (light-harvesting complex Ⅱ),捕光复合物II;PSI/II (photosystem I/Ⅱ),光系统I/II。蛋白图像参考已有的结构数据(PDB: 5L8R, 5MDX)
1.1 捕光调控
如上所述,由于太阳光强的变化跨度较大,植物一方面需要尽快收集充足的光子来氧化水分子,另一方面还需要避免强光导致的光损伤。当光强过强时,被激发的叶绿素弛豫到三重态,与三线态氧分子相互作用的概率大大增强,生成的单线态氧会造成光合蛋白,特别是光系统II蛋白的损伤[4]。捕光过程调控通过及时地将过剩的光合激子转化为无害的热能的方式实现光保护功能。在表现上,这一过程往往伴随着叶绿素荧光的猝灭,直接表明在这些过程中是某种猝灭分子(quencher)与光化学猝灭(光合电荷分离)竞争,因此被统称为非光化学猝灭(nonphotochemical quenching, NPQ)。各种组分也分别被冠以“猝灭”之名(q),像能量猝灭qE、状态转换猝灭qT、qH以及光抑制qI等。高等植物的非光化学保护一直是光合作用研究领域的热点之一。
1.1.1 能量猝灭(qE)
在高等植物中,q E 是指由光保护蛋白(PsbS)和紫黄素(violaxanthin, Vio)脱环氧作用(violaxanthin de-epoxidation, VDE)诱导的快速响应能量猝灭过程,是NPQ的主要成分,因而也被模糊地称为NPQ。qE一般发生在高光照射10 min之内,其中PsbS主导的过程在1~2 min之内,占qE的绝大部分。此外,较慢的能量猝灭过程取决于另一个关键因子玉米黄质(zeaxanthin)的参与,即qZ,一般发生在高光照射qE之后的10 min内。关于qE,早在20世纪60年代就观测到了[5],后来经大量研究逐步证明了其光保护的生理功能[6]。90年代,研究人员发现玉米黄质参与NPQ[7],2000年参与qE的关键因子PsbS蛋白也被成功克隆[8],当时误认为PsbS蛋白是类似于LHC的色素结合蛋白,但后来的结构证明PsbS并不结合色素[9]。目前除鉴定了直接参与NPQ的两个重要因子PsbS蛋白和玉米黄质之外,还明确了NPQ的触发信号来自强光下类囊体的酸化。在酸性条件下PsbS蛋白发生质子化,进而触发光保护,玉米黄质以未知的形式参与其中。
尽管NPQ相关研究开展多年,qE在生物活体中是如何实现的还没有一致的看法,仍然存在若干重要的问题。
(1)PsbS蛋白如何触发猝灭?玉米黄质以何种角色参与?PsbS蛋白本身不含有色素,因此它不太可能是一个猝灭分子。目前大家较为接受的观点是,PsbS像是一个“酶”分子,促进PSII天线蛋白的构象变化从而引起激子的猝灭,该过程或许伴随着LHCII蛋白的聚集,而玉米黄质起到黏合剂的作用,进一步增进猝灭的幅度。
(2)PsbS的结合位点是什么?NPQ发生的具体位点在哪里?目前有观点认为非光化学猝灭的位点位于捕光天线复合物II (LHCII),但也有人认为小天线或者反应中心天线是NPQ的作用位点,同时有人发现PSI可能也受到PsbS的保护等,似乎人们对该问题的认知还停留在原点。这个疑团可能还需要等待PsbS和PSII高分辨率的结构解析出来才能彻底解开。
(3)qE发生的分子物理猝灭机制是什么?关于qE发生的机制,迄今为止,人们对高等植物NPQ机制尚未形成统一的认识。目前主要存在4个能量猝灭模型:①叶绿素和玉米黄质间的电荷分离模型;②叶绿素和叶黄素间的能量传递模型;③叶绿素和玉米黄质激子耦合模型;④叶绿素和叶绿素间的电荷分离模型。造成这种学术争论的主因在于生物样品的制备与光谱技术交叉融合不够:首先,截至目前国际上还没有研究组能够分离具备NPQ功能的PSII-PsbS的大型蛋白复合体,因此样品采用更为复杂的叶绿体抑或LHCII人工聚合物体系;其次,当时的超快光谱技术灵敏度不足,需要的激光单脉冲能量密度很高,带来的非线性光学现象(如单重激发态-单重激发态三重激发态间湮灭)导致的信号严重扭曲和失真。随着生化技术的进步,仪器性能的提高,科学家有望近期攻克植物NPQ发生的分子物理机制这一难题。
虽然qE的分子机制尚未得到完整解析,但改良光保护以提高作物产量的潜在可能性受到了广泛关注。在特定条件下,加快光保护的响应速率,减少热耗散对光化学的竞争,被认为有可能提高植物的光能利用率。2016年,美国伊利诺斯大学S. Long院士研究组通过优化光保护机制,成功提高大田中烟草、大豆的生物质产量14%~20%[10-11]。然而,这一结论在拟南芥、番茄以及匍匐翦股颖等体系受到了部分学者的质疑[12-13]。此外,也有观点指出光保护“拖累”光合效率的程度可能被高估了,因为由LHCII介导的热耗散会特异性猝灭关闭的反应中心,而不影响正常的开放反应中心[14],从而得出光保护原本就是“经济的”(economic photoprotection)。
1.1.2 状态转换(qT)
自然光环境中除了强度的变化,光质也时刻发生变化。光系统I和光系统II对不同颜色光的吸收截面不同,前者可以吸收能量较低的光子,因此光质的变化对两个系统的选择性激发也不同。在高等植物中,状态转换是通过改变捕光天线LHCII与两个光系统的结合程度来实现的,表现为PSII和PSI激发比例的相对改变,被认为是捕光系统对光质变化的适应途径。当光质有利于激发PSI时,LHCII更多地与PSII结合,称为状态I;相应地,有利于PSII的光环境则促使状态II的形成,LHCII结合到PSI上。状态转换的首次报道是在1969年,分别在紫球藻和小球藻中被发现[15-16]。之所以在藻类中率先报道,是因为部分藻类的状态转换对应的叶绿素荧光表型非常明显,而在高等植物中,状态转换表型变化较小。
调控光合qT机制的分子元件包括STN7激酶和TAP38(也称PPH1)去磷酸化酶。人们首先发现的是STN7在衣藻中的同源蛋白STT7[17],两年后克隆到STN7[18]和STN8[19],前者在质体醌(plastoquinone, PQ)池氧化还原态的控制下通过磷酸化天线蛋白参与状态转换,后者主要磷酸化PSII核蛋白,有可能参与PSII的修复过程[20]。TAP38负责LHCII的去磷酸化过程,推动植物从状态II到状态I的恢复过程[21]。
类似于qE,实现qT的分子物理机制也不是很清晰。虽然相关激酶已经被克隆,但是其启动与作用机制目前还没有得到合理的解释。除了触发机制,能量的分配机制也存在疑惑。已知LHCII会在PSI和PSII间移动,PSI-LHCII复合物的结构已经被解析,但是形成PSI-LHCII超级复合物是否是状态转换的充分必要条件,目前还没有定论。也有报道称在拟南芥以及松树的类囊体膜中存在大量(含有超过一半的PSII)的PSI-PSII超级复合物[22],荧光动力学分析表明确实存在PSII到PSI的能量溢出(spillover)[23],这向传统的观点,即高等植物中PSII和PSI分处不同区域从而两者间发生直接能量传递的可能性小,提出挑战。果真如此的话,基于LHCII转移的状态转换模型需要重新审视。从能量分配的角度来看qT,大部分文献报道中将qT归为非光化学猝灭NPQ的一种,但是qT是否是光合激子的激发态猝灭目前仍然没有定论。如果qT过程是植物在光质变化的时候通过快速地调控PSI/PSII有效天线吸收截面来实现的,那么这中间并不涉及能量的非光化学猝灭过程,因此不应该被归为NPQ。但是2016年荷兰瓦格宁根大学学者发现qT的不同机制,他们发现部分LHCII脱离PSII复合物后没有结合到PSI蛋白复合物,而是自身形成猝灭体,这种情况下,qT确实应该属于一种NPQ类型[24]。
1.1.3 光抑制(qI)
光抑制泛指光保护中弛豫时间更长的组分,时间尺度从数小时到数天。有关光抑制的最早报道在1956年,但是相比qE和qT,qI机制是目前了解最为匮乏的。由于反应中心存在各种各样降低光合量子效率的因素,光抑制涉及的分子机制更为复杂,光抑制、光损伤以及慢的光保护三者间缺乏明确的界限。例如,Ruban[25]就指出在一般环境下大部分光抑制可归于光保护的慢弛豫组分。目前光抑制仍缺乏确切的定义,一般粗略地代表短时间内可修复的PSII光损伤。光抑制从诱因上可以简单划分为两种:一种是由蓝光-紫外光引起的放氧复合体(oxygen-evolving complex,OEC)的破坏,导致PSII电子供体侧出现损伤,它的发生与光反应没有直接关系,高能光子的直接破坏对象是OEC复合体[26];另一种是由强光引起的,与PSII光反应-电荷分离有直接的关系,是由活性氧分子ROS介导的D1蛋白的损伤[27]。强光如何引起光系统II的光损伤,以及降解因子、修复因子和修复过程的PSII组装仍是领域内的热门研究方向,但由于缺乏定论,故不在此详述。
关于光抑制,一个长期令人费解的问题是为什么处于光抑制状态下的PSII的荧光不升反降。一般情况下如果反应中心被损伤、降解,残留的天线蛋白由于缺少光化学猝灭,荧光应该显著上升,但是事实是荧光在下降。这种下降不是因为叶绿素总量的减少,而是来自叶绿素荧光的猝灭,并伴随着荧光寿命的降低。有学者指出猝灭的位点为氧化态PSII[28],但是这种观点还需要进一步验证。另外,有学者提出qI在PSII破坏修复的过程中起到非常好的光保护作用,显著降低了ROS的生成[29]。
捕光过程中的光调控,如qE、qT、qI等,组成了光合生物适应光环境的第一道防线,具有重要的生理意义,相关研究尤其是围绕qI机制的研究还有待加强。PSII的光损伤直接关系到作物的耐逆性和产量。近期,我国学者通过遗传工程手段在拟南芥、烟草和水稻中创建了一条由高温响应启动子驱动的细胞核表达的D1蛋白合成途径,与天然的叶绿体合成途径一起形成D1蛋白合成的“双途径”机制,显著增强了植物的高温抗性、光合效率以及生物量和产量[30]。
1.2 电荷分离调控
电荷分离方面的调控泛指围绕光反应中心进行的与电荷分离和重组相关的调控,并非特指对原初反应电荷分离对的调控。图4展示了光系统II/I反应中心的结构和组成。
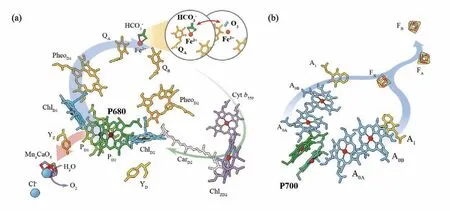
图4 光系统II(a)和光系统I(b)原初反应示意图。A0A、A0B,PSI初级电子受体(两对特殊叶绿素a(Chla)分子);A1,一对叶绿醌(维生素K)分子;Car (β-carotene),β-胡萝卜素;Cyt b559 (Cytochrome b559),细胞色素b559;FX、FA、FB,PSI结合的铁硫簇;Mn4CaO5,放氧复合物锰-钙-氧核心;Pheo (pheophytin),脱镁叶绿素,其中PheoD1是光系统II的初级电子受体;P680,光系统II初级电子供体(包括4个叶绿素a (Chla)分子PD1、PD2、ChlD1和ChlD2);QA和QB,初级和次级质体醌(plastoquinone)电子受体;YZ/ YD,氧化还原活性酪氨酸残基Z/D。分子图像参考已有的蛋白结构数据(PDB: 3wu2, 5L8R)
由于电荷分离提供电子传递的驱动力,是电子传递链的有机组成部分,相关的调控机制和前面所述qI的机制以及下文将要论述的电子传递调控密不可分,部分是重叠的。本文单独列出电荷分离调控:一是凸显其重要性;二是反应中心发生电荷分离的过程中的确存在若干直接的调控机制,与qI以及电子传递并无直接关联,像细胞色素b559(cytb559)和非血红素铁酶(non-heme iron enzyme)介导的电荷重组调控,以及P680+和P700+的能量猝灭作用等,值得特别关注。
1.2.1 电荷重组调控
光合反应中心进行电荷分离后产生的正负离子会不可避免地发生一定程度的电荷重组,起到能量湮灭的作用,显著降低了光合激子的能量利用效率。自然界通过质子-电子耦合的方式以及各种氧化还原电位的调控,已经有效地抑制了电荷复合现象。其中细胞色素b559是一种重要的氧化还原活性蛋白,因其还原态的吸收主峰在559 nm而得名,是光系统II的关键组成部分。它的存在形式是异二聚体,含有一个血红素,目前其具体生理功能还不是特别明确。由于它距离反应中心色素、初级质体醌电子受体(QA)以及OEC较远,不太可能直接参与原初电荷分离过程,但有证据表明它有可能参与PSII免受光损伤的二次传输途径,即PSII环式电子传递(图4),提供一个从PQH2到P680+的电荷重组支路,有望起到光保护作用[31]。此外,细胞色素b559的生理功能更多地体现在其对氧气以及ROS相关的生化反应。
此外,位于PSII结构中QA和QB之间的非血红素亚铁酶也参与PSII电荷重组的调控,非血红素亚铁酶可以与碳酸氢根离子和氧气分子结合[32-34]。无论结合O2还是碳酸氢根离子,QA-到QB的电子传递都是受阻的。还原态的QA-分子会推动碳酸氢根与非血红素亚铁酶脱离,使QA还原电势升高从而促进电荷重组,降低PSII受体侧ROS的生产,从而起到保护作用。当有O2分子存在的时候,碳酸氢根脱离后,O2分子会结合Fe2+,氧化QA-分子,生成超氧化物一方面参与信号传导,另一方面破坏蛋白引起光损伤(图4)。这一方面的研究目前还在快速的发展中,相关结论还需要进一步验证。
1.2.2 ChlZ+、P680+和P700+等叶绿素阳离子的荧光猝灭功能
光反应中心在电荷分离过程中形成的叶绿素阳离子ChlZ+、P680+(PSII)和P700+(PSI)是天然的荧光猝灭分子,这是由它们的物理分子特性决定的[35-37]。处于氧化态的ChlZ+是一个强有力的荧光猝灭分子,据报道15%的ChlZ+就可以导致PSII叶绿素荧光70%以上的猝灭[37],这在PSII电子供体侧受限的时候可以起到很好的保护作用。同时,P680+作为迄今发现的最强的生物氧化剂,足以氧化水分子[38],其本身也是非常出色的荧光猝灭分子[39],乃至有早期研究误以为P680+阳离子就是qE的猝灭分子[40]。P700+对PSI的荧光猝灭作用是研究相对较多的,P700+的荧光猝灭效果也最为明显。不同光系统内叶绿素阳离子能量猝灭程度出现较大差异,而造成这种差异的结构基础与物理机制目前还不是特别清晰。P700+通过能量猝灭基本维持了PSI光化学猝灭所能达到的荧光衰减寿命,这也是PSI不会像PSII一样在不同氧化还原态之间出现巨大荧光产率变化的原因[41]。正是由于P700+强的能量猝灭作用,PSI复合物高度稳定,在植物活体体系中正常生长条件下几乎不出现光损伤[42]。
2 光合电子传递链的调控
光合电子传递链是指多个电子供体和受体在两个光系统的光驱动下运行的电子传递通道(图5),最早由希尔提出,形似“Z”字形,后来按照氧化还原电位排列,呈现侧写的“Z”字[43]。
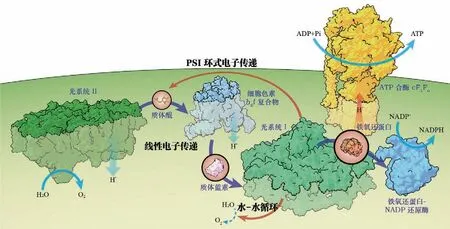
图5 光合电子调控示意图。注意图中蛋白之间的距离、数量比例不代表真实情况。ADP (adenosine diphosphate),二磷酸腺苷;ATP (adenosine triphosphate),三磷酸腺苷;NADP+/NADPH (nicotinamide adenine dinucleotide phosphate),烟酰胺腺嘌呤二核苷酸磷酸(氧化/还原态)。蛋白图像参考已有的结构数据(PDB: 1SM4, 2GIM, 3wu2, 5L8R, 6FKF, 6RQF)
2.1 线式电子传递链及其调控
光合膜上三大复合物PSII、Cytb6f、PSI串联组成线式电子传递链(linear electron flow,L E F)的框架,沿着电子链,电子从最初的供体水分子传递到最终的N A D P H 分子:H2O→PSII→PQ→Cytb6f→Pc→PSI→NADP+。在正常生长条件下, LEF电子流占据主导地位。LEF的调控与类囊体的酸化以及质体醌PQ库的氧化还原态息息相关。当类囊体发生过度酸化的时候,OEC可能会发生降解,类似于前文中的qI,使PSII不再氧化水提供电子,同时酸化还会触发Cytb6f的调控作用。Cytb6f 是当之无愧的电子调控中枢,是电子链反馈调控的核心,其Q循环有两个关键反应,其中Q0侧PQH2的氧化受到pH的严格调控[44]。当pH过低时,PQH2受铁硫簇氧化的速率会显著变慢,从而降低质体蓝素向PSI的电子传递。另外,一个很重要的调控作用就是上文所述的qE,它与OEC受损(qI的一部分)一起从源头上控制电子的注入。
2.2 环式电子传递及其调控
PSI环式电子传递(cyclic electron transport around photosystem I, CEF-I)指PSI下游的电子通过特定通路重新回到PSI上游,在此期间电子的氧化还原电位降低,能量转化为跨膜质子动力势(proton motive force, pmf)。环式电子传递在不产生额外还原力的情况下产出ATP,提高了ATP/NADPH的比例。拟南芥体系CEF缺陷株生长严重受限,充分体现了CEF对植物适应光环境具有重要作用[45]。已发现高等植物中有两种CEF-I途径[46],分别由PGR5 (proton gradient regulation 5)和NDH (nucleotide dehydrogenase)复合物介导。这两条电子途径的功能分化目前还不是很清楚。
PGR5为基质可溶性蛋白,最初在筛选拟南芥qE缺陷突变体时被发现[47],不久后发现了PGR5的类囊体膜定位分子伴侣PGRL1 (PGR5-like)[48]。NDH复合物与线粒体呼吸复合物I高度同源,最早在蓝藻中被报道[49]。高等植物也具有NDH复合物,被命名为NDH-1。虽然PGR5/PGRL1和NDH途径都参与CEF-I,但两者的表型有明显的区别,是两条独立的途径。PGR5/PGRL1途径被抗霉素A (一种线粒体复合物III抑制剂)专一性抑制[50],为两种途径的区别研究提供了便利。已知PGR5/PGRL1途径在植物光-暗转换、波动光适应中有重要作用,其主要功能之一可能是缓解PSI上下游压力,而NDH途径似乎不参与短期光适应。在C4植物中,NDH-1细胞特异性上调,是C4途径所需的额外ATP的主要来源[51],这可能预示着NDH途径在稳态光合中的重要性。此外,NDH-1将电子回流至PQ库,同时将质子泵入囊腔侧[52],而PGRL1可能无法驱动质子跨膜,其是否直接调节PQ库也仍为未知。
关于CEF-I最早的实验证据来自分离叶绿体中由铁氧还蛋白(Fd)介导的光依赖性ATP合成[53]。研究人员根据此现象提出类囊体膜中存在一种Fd-PQ氧化还原酶(FQR)[54],该酶将电子从PSI受体侧重新注入电子传递链。如今PGR5/PGRL1和NDH复合物的发现为指认FQR的真实身份提供了方向。一方面高等植物的NDH-1可能与最初命名时的假设不同,以Fd而非NADPH为电子供体,另一方面PGRL1被报道在体外具有FQR活性,但其体内活性仍有争议。随着细胞色素b6f复合物结构的解析,在该复合物中也发现了可能行使FQR活性的潜在催化位点[55]。随着更多PSI上下游电子路径的解析,CEF-I所涵盖的调控机制或许将远远超过最初FQR酶的概念。
2.3 (类)水-水循环反应
PSII裂解水产生的电子可以在电子传递链上经过各种氧化酶传递至O2并重新产生水,这形成了多种水-水循环(或伪环式电子传递)[56]。由于O2的直接还原往往伴随着活性氧的产生,所以维持水-水循环需要消耗抗坏血酸等抗氧化分子,潜在的能量代价很高。另一方面,活性氧是重要的叶绿体信号分子,所以水-水循环在光合调控中可能具有特殊信号的功能。
质体末端过氧化物酶(plastid terminal oxidase, PTOX)是由immutans基因编码的,PTOX缺失后的植株出现明显的斑叶表型。PTOX将PQ库中的电子转移至O2而形成水-水循环,同时控制PQ库的氧化还原态[57]。PTOX直接从PSII受体侧移出电子的特性使人推测其具有在高光下缓解PSII激发压力的安全阀的功能[58]。不过这一观点受到了挑战,有研究指出在菠菜中PTOX与PSII蛋白的比例仅为1/100[59],在番茄、拟南芥中电子传递率在1 e·s-1·PSII-1以下,其作用微乎其微[60]。PTOX行使氧化功能的同时也参与类胡萝卜素合成通路,PTOX突变体的斑叶表型与此功能有关[61]。
梅勒反应源于1951年Mehler观察到的分离豌豆类囊体在光下将O2还原为过氧化氢(H2O2)的现象[62]。之后日本学者证明电子来源于PSI,其中的铁氧还蛋白将O2还原成超氧阴离子[63],后者再被超氧化物歧化酶还原成H2O2,最终H2O2被基质中的抗坏血酸过氧化物酶清除[64],形成水-水循环。最近的研究指出铁氧还蛋白可能不是还原氧气的唯一位点,在衣藻中对PSI各电子载体的突变研究表明FAFB、PhQA-也参与了电子溢出[65]。有迹象表明梅勒反应在高等植物的稳态光合电子传递中占有相当的比例(~10%),可能在高光下缓解了PSI受体侧压力,但此观点仍缺乏决定性的证据。梅勒反应的生理意义有待进一步鉴定,不排除它仅仅是PSI受体侧在有氧环境下不可避免的副反应。
3 总结与展望
全面深刻地认识光合作用光反应调控需要多学科的交叉,从光谱物理、光催化化学到分子生理、基因编辑等缺一不可。随着相关研究的多年积累,光合调控的基本框架已经建立,人们已经认识到了自然界巧夺天工的设计。它环环相扣展现出缜密性,形式多样体现出灵活性,同时就地取材极具经济性。自然界用简单的材料和巧妙的设计解决了植物适应光环境变化的难题。如上文所述,我们的认知基本在光合调控的每个环节均存在不足之处,未来还需要加强该方面的研究,解析已有调控策略中的未知机制,同时期待能发现更多的新型光合调控机制。
没有光合作用就没有生命。近些年,为了应对人类人口增长、能源危机等问题,欧洲多国发起了光合作用2.0联合会,美国的盖茨基金多年来持续支持C4水稻计划以及RIPE (Realizing Increased Photosynthetic Efficiency)计划等。由此可见,国际上对光合作用的基础研究极为重视。随着合成生物学与分子育种技术的快速发展,相信在不久的将来人类有望进一步改善天然的光合作用调控机制,甚至创制全新的调控体系,打造满足需求的“超级植物”。
