叶绿体蛋白质传送器TOC-TIC超复合物的组成和结构机理*
2024-02-29李甜刘昊柳振峰
李甜,刘昊,柳振峰†
①中国科学院大学 生命科学学院,北京 100049;②中国科学院生物物理研究所,生物大分子国家重点实验室(中国科学院),北京 100101
叶绿体作为一种常见的特化质体[1],是植物和藻类细胞进行光合作用的主要场所。它能够将太阳能转化为化学能,从而将二氧化碳和水用于合成富含能量的有机物并放出氧气。根据内共生假说,叶绿体可能起源于被真核细胞内吞后并与之共生的蓝细菌,并且在漫长进化历程中,叶绿体祖先的基因组中有超过90%的遗传信息被转移到宿主细胞的核基因组中[2-4]。因此,核基因编码的叶绿体蛋白的表达和翻译后转运是叶绿体发育中不可或缺的环节。据估计,植物叶绿体中约有2 000~3 000种由核基因编码的蛋白质最初是作为前体蛋白在胞质中被合成的,需要被运输到叶绿体中才能成熟和发挥功能[1]。大部分前体蛋白带有能够指引它们进入叶绿体的氨基端(N端)转运肽,并在分子伴侣的协助下,由分别位于外被膜(outer envelope membrane, OEM)和内被膜(inner envelope membrane, IEM)上的TOC和TIC转运体(translocon)机器进行识别和转运进入叶绿体[5]。当前体蛋白穿过TOC-TIC超复合体进入叶绿体基质,其氨基端转运肽标记便会由基质加工肽酶(stromal processing peptidase, SPP)切除,产生成熟的蛋白质[6]。在这一独特的导入过程中,包括TOC和TIC在内的一系列蛋白质复合体分子机器能够准确、高效地识别和输送前体蛋白质,以确保细胞器的生物生成、发育和生理功能的发挥得以实现(图1)。本文主要介绍叶绿体TOC-TIC超复合体结构生物学研究方面的最新进展,并探讨叶绿体前体蛋白跨双层被膜转运过程及其调控的分子机制。

图1 TOC-TIC超复合物参与转运核基因编码的前体蛋白进入叶绿体的模式图
1 TOC-TIC超复合体研究背景
在20世纪90年代初,科学家通过生物化学方法分离并鉴定了TOC和TIC复合体的一些成分,成功发现了豌豆叶绿体外被膜上的三种蛋白以及内被膜上的一种蛋白组分[7-9]。这些蛋白质最初被命名为导入中间体结合蛋白(import intermediate associated protein, IAP)与外/内被膜蛋白(outer/inner envelope protein, OEP/IEP),包括IAP34/OEP34、IAP75/OEP75、IAP86/OEP86和IAP100/IEP110[8-11]。随后,它们被重新命名为Toc34、Toc75、Toc159 (IAP86/OEP86为Toc159被蛋白酶降解的大片段产物)和Tic110[12-13]。值得注意的是,尽管最初有些研究小组发现一个86 kDa的Toc蛋白属于Toc159的一部分,后来的研究却发现其实际长度明显更长,分子量达到159 kDa。这提示Toc159可能会经历蛋白酶的切割过程,并存在不同的形态[12]。
近年来,随着研究技术的进步,一些组成TOC和TIC复合体的蛋白质晶体结构相继得到揭示。2002年,科学家使用X射线晶体学方法成功解析了豌豆Toc34水溶结构域(PDB 1H65)的晶体结构[14],并揭示了Toc34的二聚体状态和GDP/GTP结合位点。后续,Toc33的GTP结合结构域(PDB 3DEF)和Toc75的多肽转运相关的结构域(polypeptide-transport-associated domain, POTRA)(PDB 5UAY; 8DN6)的晶体结构也被成功解析出来[15-16]。尽管如此,完整TOC-TIC超复合体的结构多年来一直未知,这主要是因为其成分复杂且在溶液中的稳定性低,容易发生解体,样品难以纯化获得且难以结晶。
前人的生物化学研究结果显示TOC和TIC并不是单独存在的,而是可以通过相互作用连接形成超级复合物,二者协同工作来介导前体蛋白直接从细胞质转运进入叶绿体基质[17-19]。细胞质、膜间隙及叶绿体基质中的伴侣复合体与TOC-TIC超复合物共同发挥作用,以确保在前体蛋白穿越外被膜、膜间隙和内被膜时不会发生错误的折叠或定位[20-21]。近期,我们课题组和西湖大学闫浈课题组分别通过单颗粒冷冻电镜(single particle cryo-EM)技术解析了莱茵衣藻(Chlamydomonasreinhardtii) TOC-TIC超复合体的高分辨率结构[22-23],展示了组成该复合体的蛋白质亚基在三维空间的位置及其相互作用,为揭示其发挥功能的分子基础提供了重要线索。
莱茵衣藻的TO C-T I C 超复合物中包含位于外被膜上的TOC复合物、膜间隙复合物(intermembrane space complex, ISC)和位于内被膜上的TIC复合物,总计由13个不同的蛋白亚基组成(图2)。其中包括Toc90、Toc75和Toc34这些保守的TOC复合物组成蛋白, Tic20、Simp1(也被称为Tic12)、Simp2(也被称为Tic13)、Simp3(也被称为YlmG)等TIC复合物组成蛋白,以及穿越内外两层被膜和膜间隙的Tic214、位于膜间隙区的Tic100和Tic56蛋白。Tic214含有一个嵌入内被膜的结构域,与Tic20共同组成TIC复合物的核心区,并且在靠近外被膜的一侧与TOC复合物形成紧密相互作用[22-23]。此外,还有一些仅在莱茵衣藻中发现的组分,如Ctap3(也被称为Toc52)、Ctap4(也被称为Toc39)和Ctap5。在膜间隙区域,由Tic214和Tic100共同组成核心“脚手架”,将TOC复合物和TIC复合物连接在一起。
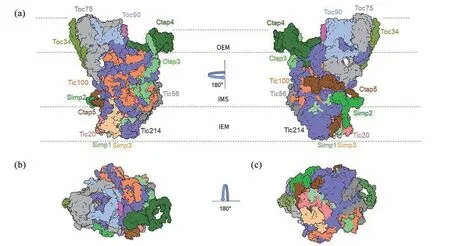
图2 莱茵衣藻TOC-TIC超复合体的冷冻电镜结构(PDB: 7XZI)。(a)TOC-TIC超复合物沿膜平面的侧视图。各蛋白质亚基显示为表面图。OEM,叶绿体的外被膜;IMS,膜间隙;IEM,叶绿体的内被膜。(b)从胞质侧看TOC-TIC超复合物的俯视图。(c)叶绿体基质侧观察TOC-TIC超复合物的底视图
2 叶绿体外被膜转运体TOC复合物
早年的研究发现从豌豆叶绿体中分离的TOC复合物的核心组件包含三种不同蛋白:Toc34、Toc75和Toc159[13]。Toc34是由GTP结合结构域(G结构域)和跨膜结构域组成,其中G结构域能够结合和水解GTP,而跨膜结构域是位于羧基末端的一个单次跨膜螺旋;Toc159是一个对蛋白酶敏感的外被膜蛋白,它可能作为叶绿体表面的初级受体参与结合前体蛋白;Toc75属于Omp85蛋白超家族(该家族在原核生物中也是保守的,在外被膜上作为特异性的蛋白质转运通道发挥功能[24])的成员,是叶绿体外被膜上的蛋白转运通道复合物的关键组成部分[25]。
在莱茵衣藻的TOC-TIC超复合物冷冻电镜结构[22-23]中,TOC复合物由Toc90(该蛋白为Toc159家族的一个成员)、Toc75和Toc34构成(图3),其摩尔剂量比为1 : 1 : 1。然而,前人对于植物TOC复合物的生物化学研究结果显示Toc159、Toc75和Toc34的摩尔剂量比可能为1 : 4 : 4~5或1 : 3 : 3[26-27]。这提示植物中可能存在更为庞大的TOC复合物,另一种可能是1 : 1 : 1比例的Toc159-Toc75-Toc34复合物与Toc75-Toc34复合物共同存在。
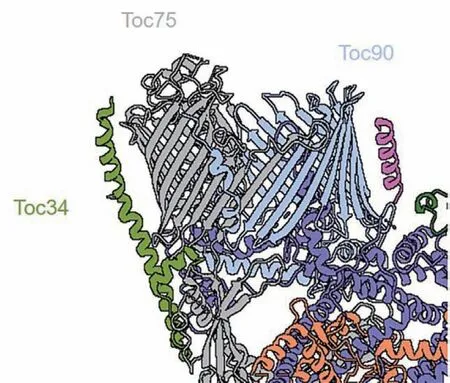
图3 TOC复合体的卡通结构模型(PDB: 7XZI)。位于外被膜上的Toc34-Toc75-Toc90复合体侧面观,其中Toc75与Toc90共同形成了杂合桶状结构
2.1 Toc34
Toc34是一个具有34 kDa分子量的跨膜蛋白,是TOC复合物的一个关键组成部分,作为前体蛋白的受体负责在叶绿体外被膜的胞质侧表面与前体蛋白识别和结合[14]。Toc34功能的发挥依赖于GTP的结合,并受到蛋白质激酶的磷酸化修饰的调控。豌豆Toc34的氨基端含有一个GTP酶结构域,而羧基端含有一段疏水的跨膜螺旋和一段短的亲水α螺旋。拟南芥含有两个同源蛋白,即AtToc34和AtToc33。值得注意的是,只有AtToc33和豌豆Toc34 (PsToc34)被检测到发生了磷酸化,而磷酸化形式的AtToc34未被检测到,AtToc34和AtToc33都能与GTP结合并水解GTP[28]。
2.2 Toc90
作为 Toc159家族的4个成员(Toc132、Toc120、Toc90 和 Toc159)之一,植物Toc90具有与Toc159相似的蛋白质输入功能并且可能更偏好光合作用相关蛋白,例如捕光蛋白[29]。Toc90作为前体蛋白的受体,与前体蛋白有显著的相互作用。根据结构分析和预测结果,Toc90蛋白主要包括三个结构域:氨基端的酸性结构域、中央的G结构域以及位于羧基端的膜锚定结构域。在莱茵衣藻Toc90中,膜锚定结构域由14个反平行β链组成,形成一个C形β桶状结构并与Toc75的β桶结构域对接和相互作用。Toc90的β桶结构域与Toc75一起在外被膜上共同形成一个异质二聚体的TOC通道。在一侧,Toc90与Toc75之间通过反平行的β链之间的氢键相互作用形成紧密的组装界面,在另一侧则主要依赖相对较弱的范德瓦尔斯力相互作用。在这种较弱的接触区域形成了一个侧向开口通道,使得TOC通道能够通过扩展来容纳和转运较大的前体蛋白[22-23]。
2.3 Toc75
Toc75是嵌在叶绿体外被膜中的一个关键通道蛋白,前人的电生理研究表明Toc75可以形成一个电压门控的具有阳离子选择性的通道[30]。拟南芥基因组中存在4个编码Toc75同源蛋白的基因:AtToc75-III、AtToc75-IV、AtToc75-I和AtToc75-V/AtOEP80。具体而言,AtToc75-III是豌豆Toc75的功能型同源蛋白[30-32]。Toc75是OMP85蛋白家族的成员,具有β桶状跨膜结构域。Toc75的氨基末端包含三个和多肽转运相关的结构域(POTRA)[16],这些结构域位于膜间隙区。POTRA结构域不仅在TOC复合物的组装中起着关键作用,并且可能在转运叶绿体前体蛋白的过程中与转运肽相互作用。此外,Toc75的第2和第3个POTRA结构域显示出分子伴侣样的活性,可能有助于防止前体蛋白在转运过程中形成不正确的折叠[16,33]。
3 叶绿体内被膜转运体TIC复合体
靶向叶绿体的前体蛋白的定位受到一系列不同TOC复合体的调控,它们在外被膜上形成的通道使得不同前体蛋白得以穿过外被膜进入膜间隙[25,34]。之后,靶向叶绿体基质和类囊体的前体蛋白会与TIC复合体结合并在其辅助下穿过叶绿体内被膜进入基质[4]。与TOC复合体相比,TIC复合体的具体组成和发挥转运前体蛋白功能的分子机制尚不十分明确,存在一些争议[35]。早期报道认为Tic110和Tic40是组成TIC复合物的关键蛋白[36]。然而,新的发现显示,Tic214、Tic100、Tic56和Tic20一起在以拟南芥为代表的一些植物和以莱茵衣藻为代表的绿藻中组成了一个总分子量达到1 MDa的超分子复合体[34,37]。近期解析的莱茵衣藻TOC-TIC超复合体的冷冻电镜结构分析结果支持了后者,直接观察到了由Tic214、Tic20、Tic100和Tic56共同构成的TIC复合物核心区,并在其内被膜结构域外周发现了4个膜蛋白小亚基[22-23]。
Tic20是TIC复合体的核心组件,与前体蛋白有相互作用且可能参与转运通道的形成[21];Tic214对于从胞质向叶绿体输入参与光合作用、氨基酸合成和核糖体生物生成的众多蛋白质起着至关重要的作用[38];Tic100和Tic56在TIC复合体的组装中也起到关键作用,它们的缺失会导致其他TIC蛋白组分大幅度减少[39]。这些组成TIC复合物的不同蛋白亚基在前体蛋白质转运过程中如何协同工作的机制尚不清楚。
3.1 Tic214
大多数高等植物的叶绿体基因组中存在两个巨大的开放阅读框,分别为ycf1和ycf2[38]。在莱茵衣藻的叶绿体基因组中,研究人员发现了一个名为orf1995的开放阅读框,与陆生植物的ycf1基因具有同源性[40]。拟南芥ycf1编码的蛋白质具有1 786个氨基酸,全长蛋白的总分子量为213 742 Da,因此将其更名为Tic214[17]。2013年,科学家在拟南芥中分离出一种新的大型TIC复合物,发现Tic214与Tic20、Tic100和Tic56共同形成了总分子量达1 MDa的复合物[17]。在莱茵衣藻中,对Tic214(TIC-TOC复合物中唯一的叶绿体基因编码亚基)的表达进行条件抑制,会损害在叶绿体核糖体生物发生和蛋白质折叠中起重要作用的叶绿体蛋白的转运过程,并诱导多效性应激反应[37-38]。冷冻电镜结构的研究结果表明:Tic214蛋白主要由大约41个α螺旋、两对短的反平行β链和许多无规则卷曲的柔性环状结构(loop)组成;在接近Tic214氨基端的区域,形成了一个紧凑的嵌入内被膜的跨膜结构域(transmembrane domain, TMD),而中间区域则折叠成一个比较松散和伸展的结构;中间结构域跨越膜间隙空间70~80 Å的距离将TMD与插入到Toc75—Toc90通道孔腔内的接近羧基端的基序连接起来。Tic214特有的伸展结构使其能够将TOC复合物与TIC复合物连接起来,并作为脚手架为其他蛋白提供一个结合和相互作用的平台。
叶绿体中还存在另一个叶绿体基因编码的大蛋白Ycf2,它在衣藻昼夜周期中与Tic20和Tic214共表达,并被发现可以与TIC-TOC超复合物相互作用[37,41]。该蛋白质之前被认为是陆地植物中ATP驱动的转运马达的一部分,与Tic214发生相互作用[41-42]。尽管如此,已报道的TOC-TIC超复合体冷冻电镜结构中暂时还没有观察到Ycf2蛋白的结合位点。
3.2 Tic20
Tic20可能在形成跨内被膜的前体蛋白转运通道中扮演着核心角色,其结构可能与线粒体中的Tim23和Tim17蛋白有一定相似性[43]。Tic20蛋白结构中包含了4个跨膜螺旋(TMHs),并与Tic214的TMD以及4种膜蛋白小亚基(Ctap5、Simp1、Simp2和Simp3)联合,组成一个位于内被膜上的转运复合体。该复合体含有一个漏斗状的中空结构,由Tic20的TMH1和TMH4、Simp1的TMH1、Tic214的TMH3和TMH6,以及Ctap5的TMH1一同形成,这与SecY蛋白内部的通道有相似之处。在与内被膜接触的侧面,TIC复合物存在一个侧向开口,并且漏斗的上部被Tic214的一个长环区(Gly328–Val380)和Tic20的α1–α2a区段所遮挡(图4)。

图4 Tic20-Tic214-Ctap5-Simp1复合物的中央漏斗状区域。视角是从膜间隙一侧观察(PDB: 7XZI)
在拟南芥中,Tic20的表达受到抑制时会导致叶片颜色变浅,并且跨越内被膜的蛋白质转运功能受损[44]。值得注意的是,拟南芥中存在4个编码Tic20蛋白的基因,即AtTic20-I、AtTic20-Ⅱ、AtTic20-IV和AtTic20-Ⅴ[45]。其中,AtTic20-I蛋白与豌豆中的Tic20具有较高的相似性。当AtTic20-I的表达在拟南芥中被降低时,可以观察到一系列的异常表型,如幼苗死亡、叶片苍白和发育受阻[46]。尤其值得注意的是,AtTic20-I在种子发芽期的表达升高,而在生长的其他阶段,其表达则相对稳定。这表明AtTic20在叶绿体的早期发育中可能发挥着至关重要的功能[46]。
3.3 Tic100
Tic100是一个定位于叶绿体外被膜和内被膜之间的膜间隙空间的水溶性蛋白质,对TIC复合物的组装很重要,并且对于光合蛋白的积累至关重要[18]。在TOC-TIC超复合物结构中,Tic100蛋白的整体形状像一个花环,有4个主要结构域,即位于氨基末端的α螺旋结构域(aminoterminal α-helical domain, NTAD)、β果冻卷结构域(β-jellyroll domain, BJD) 、中间α螺旋结构域(middle α-helical domain, MAHD)和羧基末端α螺旋结构域(carboxy-terminal α-helical domain,CTAD)[23]。Tic100与Tic214的膜间隙结构域交织在一起,形成膜间隙复合物(ISC)的核心部分。拟南芥Tic100突变体中的1 MDa TIC复合体的水平降低,并且与野生型相比,其叶绿体蛋白转运效率降低[39]。该蛋白中一个关键位点的甘氨酸残基突变为精氨酸残基(G418R)会导致Tic100蛋白部分失去功能,这种突变可能会影响Tic100和Tic214之间的组装[39],这是因为Tic100的Gly418位于它们的组装界面。因此,Tic100对TIC复合体的组装至关重要,并可能通过在TOC和TIC复合体之间建立稳定的物理桥梁来促进前体蛋白的转运。
3.4 Tic56
Tic56是一个可溶蛋白,其氨基末端区域有一个短的α螺旋(α1),通过一个长的无规则卷曲环连接到一个接近羧基末端的球形结构域[22-23]。Tic56的α1与Tic100和Ctap3的羧基末端区域相互作用,并且Tic56的球形结构域插入Tic214的TMD和Tic100的CTAD之间的裂缝,以稳定它们之间的组装。前人通过联合转录组学和蛋白质组学的综合分析发现,TIC复合物中的Tic56对于叶绿体蛋白的积累发挥着关键的作用[47]。Tic56的完全缺失会导致叶绿体前体蛋白的输入明显受损,并与多种功能异常关联。尽管前人的生物化学研究结果提示Tic56(或包含Tic56的复合物)可能与Toc159之间存在相互作用[35],冷冻电镜结构分析显示Tic56并未与Toc蛋白形成直接的相互作用,而是通过膜间隙复合物与TOC复合物相连[22-23]。
4 TOC-TIC超复合物中潜在的前体蛋白转运途径
TOC和TIC复合体负责将各种不同的核基因编码的前体蛋白转运到叶绿体内的不同微区[48-49]。由于不同的底物前体蛋白具有不同的表面性质和目标定位,它们可能通过不同的途径被转运进入叶绿体。
对于被导向到基质的水溶性蛋白,例如核酮糖1,5–二磷酸羧化/加氧酶(RuBisCO)的小亚基RbcS或铁氧还蛋白Fd[34,50],它们的前体蛋白首先需要穿过Toc75—Toc90通道的中央孔道。之后,这些蛋白质可能会沿着膜间隙复合物ISC的表面凹槽被传输到接近TIC通道的内被膜外侧表面区域,之后通过Tic20-Tic214-Ctap5-Simp1复合体内部的核心漏斗跨越内被膜(图5(a),出口3-1);或者,前体蛋白有可能避开核心漏斗,并采用与核心漏斗相连的侧门部分进入内被膜区进而穿越内被膜(图5(a),出口3-2)。对于定位于膜间隙空间的蛋白,如Tic22,它们可能会通过Toc75的POTRA1—POTRA2与Toc90的α3形成的侧门离开Toc75—Toc90通道并进入膜间隙(图5(a),出口1),或通过Toc75的POTRA2—POTRA3与Tic214—Tic100复合体之间的出口进入膜间隙(图5(a),出口2)。
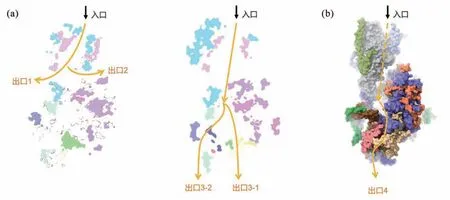
图5 TOC-TIC超复合物中潜在的介导叶绿体蛋白易位的不同途径。(a)出口1和出口2是前体蛋白从胞质侧穿过TOC复合物内部的孔道进入膜间隙空间的可能途径[23]。另外一些前体蛋白从胞质侧进入并穿过TOC复合物内部的孔道后沿着膜间隙复合物的表面沟槽到达TIC复合物上方,通过TIC复合物中Tic20与Tic214内膜结构域之间界面中央或侧面的途径进入叶绿体基质(出口3-1和3-2)。(b)出口4描绘的是前体蛋白沿着Tic20和YlmG(Simp3)之间表面沟槽转运进入叶绿体基质的另一种可能途径[22]
最近的一项功能研究表明,Tic12 (Simp1和Simp2的植物同源物)是TIC复合物的重要组成部分,并且Tic12和Tic20都与易位前体蛋白的转运肽存在相互作用[51]。与这个报道一致,我们的结构揭示了Simp1位于Tic20-Tic214-Ctap5复合物中央漏斗的一个侧面位点,而Simp2在另一侧充当Ctap5附近的外围栅栏。
同期发表的另一项TOC-TIC超复合物结构研究工作也提出了一个可能的前体蛋白转运路径[22]:前体蛋白通过Toc75—Toc120(实为Toc90)内部的孔道进入膜间隙空间,沿着膜间隙复合物表面一个宽大的亲水沟槽向下移动。这一沟槽将TOC的通道出口和TIC复合物上方的负电空腔连接起来。在接近内膜结构域区域,前体蛋白沿着Tic20和YlmG(Simp3)之间的沟槽移动并进入叶绿体基质,如图5(b)所示。该路径主要由Toc120、Toc75、Tic214、Tic100、Tic20和YlmG组成,与我们之前提出的前体蛋白转运路径(图5(a)右)最大的差别在于前体蛋白穿越内被膜的途径,而真实的途径有待进一步的研究结果来检验。
在胞质侧,前蛋白的转运肽首先会被TOC复合物的GTP结合结构域识别。TOC的GTP结合结构域的动态可能有助于捕获TOC复合物表面附近的前体蛋白并将其引导到TOC通道入口。Toc75的POTRA结构域可能协助前体蛋白从TOC通道的出口传输至膜间隙复合物下方的口袋,这个口袋指向Tic20和Tic214之间的内部孔道或指向Tic20和YlmG构成的侧边入口。
5 叶绿体前体蛋白转运过程的调控机制
生物和非生物因素胁迫,如光照、盐分、干旱及渗透胁迫,可导致叶绿体蛋白质出现显著的光氧化损伤[5]。蛋白质的周转是植物对抗这种氧化损伤的关键机制[52]。因此,光合蛋白质的转运对于光合机器的维持和修复有着至关重要的作用。AtToc33敲除突变体ppi1表现为淡黄色的表型,分子遗传学研究发现两个与TOC复合体转运相关成分的突变可抑制ppi1的表型[28]。抑制ppi1位点1(SP1)是一个E3泛素连接酶,存在于叶绿体被膜上,通过泛素–蛋白酶体系统(UPS)促进AtToc75、AtToc159和AtToc33的降解[53]。第二个成分SP2是OMP85家族的一个β桶状蛋白,被认为可能作为一个通道,用于从膜中提取泛素化的TOC蛋白。SP1和SP2与细胞周期蛋白Cdc48 AAA-ATP酶在细胞质中有结合,这可能提供了从SP2提取TOC的动力。最近的研究发现,无论是缺失或过量表达SP1或SP2的拟南芥均对盐、渗透和氧化应激表现出敏感或抗性反应,凸显了其在调控特定TOC组分水平与光合蛋白质转运之间的关系,从而最终影响光氧化和活性氧(ROS)的产生[54]。
UPS系统还与DELLA蛋白协同调控叶绿体的生物发生[54]。DELLA蛋白在种子萌发期间通过赤霉酸(GA)依赖的途径发挥其对生长的抑制效应。GA促进种子萌发和叶绿体的发育,同时通过诱导DELLA的降解来激活光合作用和叶绿体生物发生相关的基因表达[55]。在缺乏GA的情境下,DELLA会积累并中断此转录过程,从而在黑暗环境中抑制叶绿体的发育,避免由于叶绿体前体过早积累而导致的早期绿化和光氧化现象[55-56]。叶绿体生物发生相关的基因除了在转录水平会被抑制之外,在低GA条件下,叶绿体前体蛋白受体AtToc159会以DELLA依赖的方式被降解,并在GA存在时得到稳定。有趣的是,AtToc33在低GA条件下也会降解,但AtToc132和AtToc75则不会[55]。AtToc159和AtToc33在导入对叶绿体生物发生和光合复合体组装至关重要的前体蛋白中发挥功能[57-58]。
TOC复合物中的受体蛋白会发生磷酸化,其生理意义尚不完全明确[58-60]。AtToc159在脱落酸(abscisic acid, ABA)依赖的条件下被激酶SnRK2 (sucrose non-fermenting related kinase 2)磷酸化,而AtToc132和AtToc120则通过不依赖于SnRK2的途径被磷酸化[61]。叶绿体外膜的激酶KOC1也可对Toc159进行磷酸化,koc1突变体在叶绿体蛋白转运上表现出缺陷,提示该激酶介导的Toc159磷酸化可能是前体蛋白转运的重要调控机制[60]。磷酸化可能调控TOC复合物胞质侧的GTP酶结构域的二聚化,并负向调控它们与前体蛋白之间的相互作用[58-59]。尽管缺乏直接证据,这些发现暗示磷酸化在调控TOC复合体功能中可能起到重要作用,其中一种可能性是磷酸化修饰参与调节TOC复合体与膜间隙复合物之间的组装,另一种可能是磷酸化修饰与UPS介导的TOC蛋白组分的降解相关。
6 讨论与展望
近期关于TOC-TIC超复合物的研究结果为理解叶绿体蛋白输入的分子机制提供了一个初步的三维框架,其背后的动力学过程和各个组成蛋白发挥功能原理相关的科学问题仍然有待深入发掘和研究。围绕TOC-TIC超复合物开展研究不仅有助于理解叶绿体蛋白质跨双层被膜运输的过程,而且有望揭示叶绿体发育和功能形成的基本原理,该方面的研究在植物生物学和细胞生物学领域中都具有深远的意义。
6.1 高等植物TOC-TIC超复合物的组成和结构
在莱茵衣藻的TOC-TIC超复合体中的组分Ctap3、Ctap4和Ctap5,在高等植物中暂时还没有找到相应的同源蛋白。这引发了一个有趣的问题:在高等植物中,这些亚基的功能是由哪些蛋白来实现的?此外,尽管Tic214对于莱茵衣藻的TOC-TIC超复合体的组装具有重要作用,但在许多单子叶禾本科植物(如水稻、玉米和小麦等)中,该蛋白以及Tic100和Tic56似乎都缺失或被其他蛋白替代[35]。这是否意味着禾本科植物有着不同的叶绿体蛋白转运途径和机制?这些观察提出了关于植物进化过程中叶绿体蛋白转运机制如何逐步形成与发生适应性演变的重要问题。可能在高等植物的演化过程中,随着复杂性的增加和环境压力的变化,某些蛋白亚基可能发生了功能性的改变、融合或替代,以适应新的适应性需求。
为什么会出现这样的差异,是由于进化压力导致的基因丢失,还是经过长期演变形成与最初的同源蛋白相似度低的蛋白?为了深入了解这一现象背后的原因以及高等植物的TOC-TIC超复合体如何工作,科学家对不同植物来源的TOCTIC超复合体开展深入的研究,有望在这一领域获得更加全面和更加深入的认识。
6.2 TOC-TIC超复合体转运前体蛋白的中间态
目前已解析的TOC-TIC超复合物结构主要揭示了其在静息状态下的构象。这一状态为我们提供了一个该复合物在功能非活跃状态时的静态“快照”。有证据显示,叶绿体的TOC和TIC超复合体有能力导入完全折叠的蛋白,并以较高的效率传输大分子量的蛋白[62],这提示TOC-TIC超复合体可能发生较大的构象变化,以实现对大分子量前体蛋白的跨膜转运。基于目前的结构数据,我们可以对前体蛋白的转运途径进行一些初步的推测,但这些假说还需要进一步的实验来检验。TOC-TIC超复合物中的蛋白转运途径可能涉及多种蛋白-蛋白或蛋白-脂类分子之间的相互作用,以及可能发生动态的构象变化。因此,为了更深入地理解TOC-TIC超复合物的工作机制,未来的研究需要结合更多的生物化学和生物物理学分析方法,以及功能分析实验来检验不同的假说。
6.3 TOC-TIC超复合体转运前体蛋白的能量来源
在前体蛋白跨越叶绿体被膜并被转移到基质的过程中,化学能量的供应对于驱动这个过程的完成是必需的。前人的研究结果表明,在某些TIC组件(如Tic110和Tic40)被招募到内被膜后,一个或多个基质伴侣蛋白(例如cpHsp70、Hsp90C和Hsp93)可能在这一转运驱动系统中发挥作用[4,25]。最近,一个由叶绿体基因编码的Ycf2、5种FtsH型蛋白以及NAD苹果酸脱氢酶亚基组成的2 MDa AAA-ATP酶复合物被发现和鉴定[41],它与1 MDa的TIC复合物结合,并被认为可能负责提供转运前体蛋白所需的能量。因此,为了满足不同质体的多样需求,可能存在具有不同功能特性的多种参与转运前体蛋白的驱动马达系统。
未来的研究还应该深入揭示组成TOC-TIC超复合体的每一个蛋白亚基和小分子配体(如植酸分子和脂类分子)的功能和发挥作用的机理,探索其与前体蛋白之间的可能相互作用,以及这些相互作用如何促进前体蛋白进入叶绿体并正确定位。此外,揭示TOC-TIC超复合体的功能调控机制及其在植物适应性反应中的作用,也是极具挑战和有趣的研究课题。
