泊马度胺对COPD大鼠气道炎症及黏液高分泌的改善作用及其机制
2024-02-29刘淑娟李亚范正媛李高峰李素云
刘淑娟,李亚,范正媛,李高峰,李素云*
1河南中医药大学河南省中医药防治呼吸病重点实验室,河南郑州 450046;2河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,河南郑州 450046;3河南中医药大学第一附属医院中药药理(呼吸)实验室,河南郑州 450000
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是慢性炎症性呼吸系统疾病,发病率和病死率均较高[1]。COPD 以持续气流受限为特征,已成为世界三大致死原因之一[2]。中国18 岁以上人群中COPD 的患病率为8.6%,给社会带来了沉重负担[3]。吸烟被认为是COPD 的重要危险因素[4]。香烟烟雾可在小气道内募集炎性细胞,并释放大量炎 性 因 子,如 肿 瘤 坏 死 因 子(tumor necrosis factor,TNF)‐α 和白细胞介素(interleukin,IL)家族因子等[5‐6]。TNF‐α 增多可促进中性粒细胞、巨噬细胞、淋巴细胞的募集及炎性细胞因子IL‐1β、IL‐6、IL‐13的释放,加重肺部炎症[7‐9]。TNF‐α 还可促进气道上皮杯状细胞增生和黏蛋白[如黏蛋白5AC(mucin5AC,MUC5AC)、黏蛋白5B(mucin5B,MUC5B)]的过度释放,引起气道黏液分泌增多,加重气道阻塞[10]。因此,抑制TNF‐α 可能改善COPD 患者的气道炎症和黏液高分泌。
泊马度胺(pomalidomide,POM)是沙利度胺的衍生物,属于第三代免疫调节剂[11]。POM 可靶向TNF-αmRNA 的3'‐非翻译区强烈抑制TNF‐α 的产生[12]。目前,POM主要用于治疗多发性骨髓瘤,并已被证明具有抗炎作用[13‐15]。有研究显示,沙利度胺能明显改善香烟烟雾所致的小鼠肺损伤[16]。此外,POM 可抑制哮喘动物模型的呼吸道收缩和炎症反应[17]。COPD 与哮喘具有相似的临床症状,如慢性呼吸道炎症和黏液高分泌[18]。因此,POM 在COPD大鼠中是否具有类似的作用有待进一步研究。本研究观察POM对COPD大鼠呼吸道炎症和黏液分泌的影响,并探讨相关的机制,旨在为COPD 的相关治疗研究提供参考。
1 材料与方法
1.1 主要试剂与仪器 POM(S1567,美国Selleck 公司),苏木精‐伊红(HE)染色试剂盒(G1120,北京Solarbio 公司),核质蛋白提取试剂盒(PK10014,美国Proteintech公司),大鼠血清TNF‐α(E‐EL‐R2856c)、IL‐1β(E‐EL‐R0012c)、IL‐6(E‐EL‐R0015c)、IL‐13(E‐EL‐R0563c)的ELISA检测试剂盒及兔抗大鼠MUC5AC抗体(E‐AB‐40037)均购自武汉伊莱瑞特生物科技股份有限公司,兔抗MUC5B 多克隆抗体(YN0881)、鼠抗GAPDH(YM3029)、Lamin B1(YM3036)单克隆抗体均购自美国ImmunoWay Biotechnology 公司,牛血清白蛋白、HRP 标记的山羊抗兔IgG 抗体(G5001、GB23303,武汉赛维尔生物科技有限公司),鼠抗TNF‐α受体1(tumour necrosis factor recptor 1,TNFR1)多克隆抗体[21574‐1‐AP,美国Proteintech 公司],兔抗IκB 激 酶(Ikappa B kinase,IKK)、磷 酸 化IKK(p‐IKK)和P65 蛋白抗体(#8943,#2697,#8242)均购自美国Cell Signaling Technology 公司。恒温箱购自上海新苗医疗设备有限公司,BS210S 型精密电子天平购自德国Sartorius 公司,LDZ5‐2 型高速离心机购自美国赛默飞世尔科技有限公司,Fine Pointe PFT型动物肺功能检测系统购自美国BUXCO 公司,Spectra Max i3x 型酶标仪来自美国Molecular Devices 公司,BX41型倒置显微镜来自日本Olympus 公司,ChemiDocTMMP成像系统购自美国Bio‐Rad公司。
1.2 实验动物与分组 SD 大鼠36 只(SCXK 北京2019‐0010,北京斯倍福生物技术有限公司),体重(200±20) g,适应性喂养1 周后,将大鼠随机分为对照组、模型组和POM组,每组12只,雌雄各半。本研究获河南中医药大学第一附属医院实验动物伦理委员会审批(YFYDW2021002),动物实验遵循动物伦理相关规定。
1.3 细菌及香烟 肺炎克雷伯杆菌(Klebsiella pneumoniae,菌株号46114)由中国医学细菌保藏管理中心供应,配制成6×108菌落形成单位(colony forming unit,CFU)/ml后进行鼻腔滴注。红旗渠牌过滤嘴卷烟购自河南中烟工业有限责任公司。
1.4 方法
1.4.1 COPD 大鼠模型制备 采用香烟烟雾暴露联合肺炎克雷伯杆菌感染制作COPD 大鼠模型。模型组和POM 组大鼠在自制的暴露箱内进行烟雾暴露,烟 雾 浓 度 须 达 到(1000±10) mg/m3,每 次30 min,2 次/d,中间间隔3 h 以上。同时大鼠双侧鼻腔内滴入肺炎克雷伯杆菌溶液共0.1 ml (6×108CFU/ml),每5 d 1 次。对照组大鼠采用等量生理盐水滴鼻。造模过程持续8周。
1.4.2 药品配制及干预 将POM 溶于DMSO 制成50 mg/ml 的原液,再按体积比加入其他溶剂:2%原液+30% PEG 300+2%Tween 80+66% 纯水,最终工作液POM浓度为1 mg/ml。POM组大鼠腹腔注射POM 0.5 mg/kg,1 次/d,持续1 周[19]。对照组和模型组大鼠分别给予等量的除原液外的其他溶剂进行腹腔注射。末次给药后,用3%戊巴比妥钠(50 mg/kg)进行麻醉处死,获取大鼠的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、血清和肺组织。
1.4.3 肺功能测定 各组随机选择6 只大鼠分别于第0、4、8、9周采用自由全身体积描记仪测定大鼠潮 气 量(tidal volume,TV)和 每 分 钟 通 气 量(minute ventilation,MV)。取材当天大鼠麻醉气管插管后采用Fine Point 肺功能测试系统测定大鼠的用力呼气肺活量(forced expiratory vital capacity,FVC)、0.1 s 用力呼 气 容 积(forced expiratory volume in 0.1 second,FEV0.1)和0.3 s 用力呼气容积(forced expiratory volume in 0.3 second,FEV0.3)。
1.4.4 肺组织病理及AB‐PAS染色检测气道上皮杯状细胞的增生情况 各组随机选择6 只大鼠左肺组织用10%多聚甲醛溶液固定;脱水、石蜡包埋后获得切片(4 µm),并分别采用HE 染色和AB‐PAS 染色;最后,用中性树脂封片。采用ImageJ 软件对大鼠肺泡平均线性截距(mean linear intercept,MLI)和平均肺泡数(mean alveolar number,MAN)进行计量分析;采用Image Pro Plus 6.0软件检测肺组织气道上皮中杯状细胞的比例。
1.4.5 BALF沉渣细胞分类计数检测中性粒细胞、巨噬细胞、淋巴细胞的占比 抽取预冷的PBS 对各组随机选择的6只大鼠肺部进行冲洗并回收,3 ml/次,共3 次,回收率在75%左右。回收的BALF 在4 ℃,1200 r/min(离心半径124 mm)离心10 min后取细胞沉渣,3 ml PBS 重悬3 次。离心弃上清,取10 µl 的细胞沉渣,均匀涂布于载玻片上,HE染色后中性树脂封片。在光学显微镜下检测中性粒细胞、巨噬细胞、淋巴细胞的比例。
1.4.6 ELISA 法检测大鼠血清炎性因子TNF‐α、IL‐1β、IL‐6、IL‐13 的水平 大鼠腹主动脉采血,血液静置分层后在4 ℃、3000 r/min(离心半径124 mm)离心15 min,取上层部分血清,根据ELISA检测试剂盒说明书指导,依次加入样本(各组随机选择6 只)、抗体工作液、酶结合工作液、底物及终止液进行孵化,最后在酶标仪指定波长下检测OD 值,根据得到的标准品OD 值和浓度用四参数法拟合出的曲线计算各指标的含量。
1.4.7 免疫组化法检测大鼠肺组织MUC5AC、MUC5B 的分泌情况 4 µm 石蜡组织切片脱蜡至水、抗原修复后用5%牛血清白蛋白封闭。分别与抗MUC5AC(1∶400稀释,E‐AB‐40037)、抗MUC5B抗体(1∶200稀释)在4 ℃孵育过夜。另与山羊抗兔抗体在37 ℃孵育30 min。DAB 显色液处理后苏木精进行复染。最后,利用ImagePro Plus 6.0 软件进行了定量分析。
1.4.8 Western blotting 检测TNF‐α/核转录因子‐κB(nuclear factor kappa‐B,NF‐κB)信号通路相关蛋白TNFR1、IKK、p‐IKK 和P65 的表达情况 各组随机选择3 只大鼠肺组织切碎后加入预冷的RIPA 缓冲液中进行总蛋白提取。用核质蛋白提取试剂盒获得核蛋白和细胞质蛋白。变性蛋白用10%的SDS‐PAGE分离,转至PVDF 膜上。用封闭液封闭膜后,加入一抗TNFR1(1:600)、IKK(1:1000)、p‐IKK(1:1000)和P65(1:1000)、GAPDH(1:2000)和Lamin B1(1:2000)抗体4 ℃孵育过夜,随后与相应的二抗孵育1 h。采用ChemiDocTMMP成像系统观察蛋白质条带并用ImageJ软件分析条带。
1.5 统计学处理 采用SPSS 22.0 软件进行统计分析。本研究均为计量资料,以xˉ±s表示,方差齐时组间比较采用单因素方差分析,进一步两两比较采用LSD‐t检验;方差不齐则选用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结 果
2.1 POM对COPD大鼠肺功能的影响 与对照组比较,模型组及POM组大鼠第8周的TV和MV均明显降低(P<0.01);模型组大鼠第9 周的FVC(P<0.01)、FEV0.1(P<0.05)、FEV0.3(P<0.01)均明显降低。与模型组比较,POM 治疗1 周后,POM 组大鼠第9 周的TV(P<0.05)和MV(P<0.01)明显增高,FVC、FEV0.1、FEV0.3均明显改善(P<0.01,图1)。
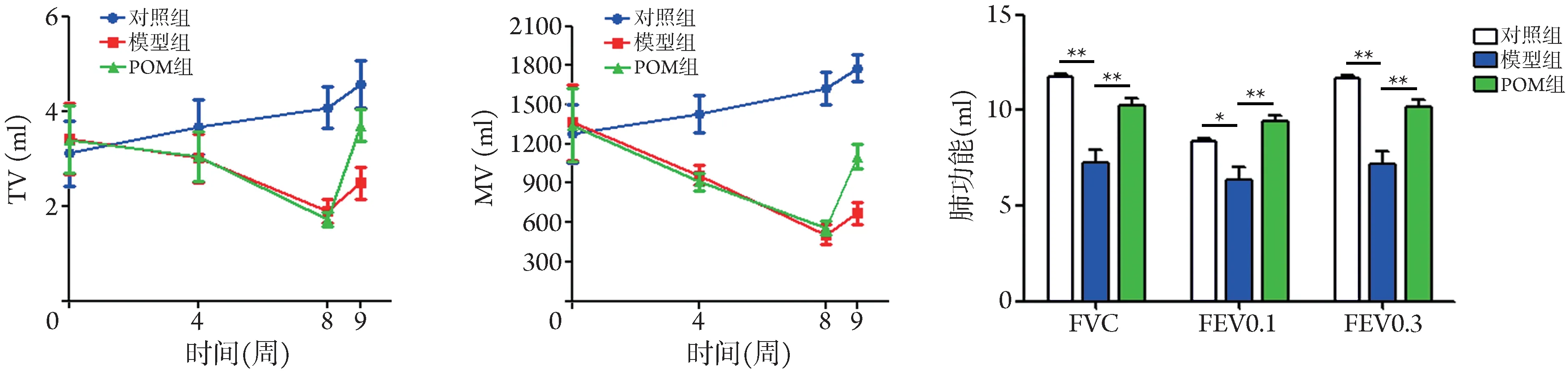
图1 POM对COPD大鼠肺功能的影响(xˉ±s,n=6)Fig.1 Effect of POM on lung function in COPD rats (xˉ±s, n=6)
2.2 POM对COPD大鼠肺组织病理损伤的影响 对照组大鼠的肺泡大小较为一致,组织和气管结构完整,周围有少量炎性细胞浸润。与对照组比较,模型组大鼠肺泡大小不一、排列紊乱,部分肺泡壁断裂融合成肺大疱,气管黏膜皱襞增多、变长,突入管腔内,气管周围有着大量炎性细胞浸润。与模型组比较,POM组肺组织病理损伤减轻,肺泡壁断裂减少,气管黏膜皱襞轻度变长、增多,周围炎性细胞浸润明显减少(图2A)。与对照组比较,模型组大鼠 肺 泡MLI 明 显 增 高(P<0.01),MAN 明 显 减 少(P<0.01);与模型组比较,POM 组大鼠肺泡MLI 和MAN均明显改善(P<0.01,图2B、C)。

图2 POM对COPD大鼠肺组织病理的影响(xˉ±s,n=6)Fig.2 Effect of POM on lung histopathology in COPD rats (xˉ±s, n=6)
2.3 POM对COPD大鼠肺炎性细胞和血清炎性因子TNF‐α、IL‐1β、IL‐13 水平的影响 与对照组比较,反复香烟烟雾刺激和细菌感染后,模型组大鼠BALF沉渣内中性粒细胞、巨噬细胞(P<0.01)和淋巴细胞(P<0.05)比例升高,血清炎性因子TNF‐α、IL‐1β、IL‐13(P<0.01)和IL‐6(P<0.05)水平升高;与模型组比较,POM组大鼠BALF中的中性粒细胞(P<0.05)和淋巴细胞(P<0.01)比例降低,巨噬细胞比例增高(P<0.01),血清中TNF‐α、IL‐6(P<0.05)和IL‐1β、IL‐13(P<0.01)水平均明显降低(图3)。

图3 POM对COPD大鼠肺炎性细胞和血清炎性因子水平的影响(xˉ±s,n=6)Fig.3 Effect of POM on lung inflammatory cell and serum levels of inflammatory factors in COPD rats (xˉ±s, n=6)
2.4 POM对COPD大鼠气道黏液分泌的影响 与对照组比较,模型组大鼠气道上皮杯状细胞比例增高(P<0.01),MUC5AC 和MUC5B 分 泌 增 多(P<0.01);与模型组比较,POM 组大鼠杯状细胞比例降低(P<0.01,图4A、C),MUC5AC、MUC5B 分泌减少(P<0.01,图4B、D)。

图4 泊马度胺对COPD大鼠气道杯状细胞和黏蛋白分泌的影响(xˉ±s,n=6)Fig.4 Effects of POM on airway goblet cell and mucin secretion in rats with COPD (xˉ±s, n=6)
2.5 POM 对COPD 大鼠肺组织TNF‐α/NF‐κB 信号通路蛋白水平的影响 Western blotting 检测结果显示,与对照组比较,模型组大鼠肺组织中TNFR1含量、p‐IKK/IKK比值升高(P<0.01,图5A),胞核中P65含量增高(P<0.01),胞质中P65含量降低(P<0.05);与模型组比较,POM 组大鼠肺组织中TNFR1 含量(P<0.01)、p‐IKK/IKK 比值(P<0.05)降低,胞质P65 含量增高(P<0.05),胞核P65含量降低(P<0.05,图5B)。
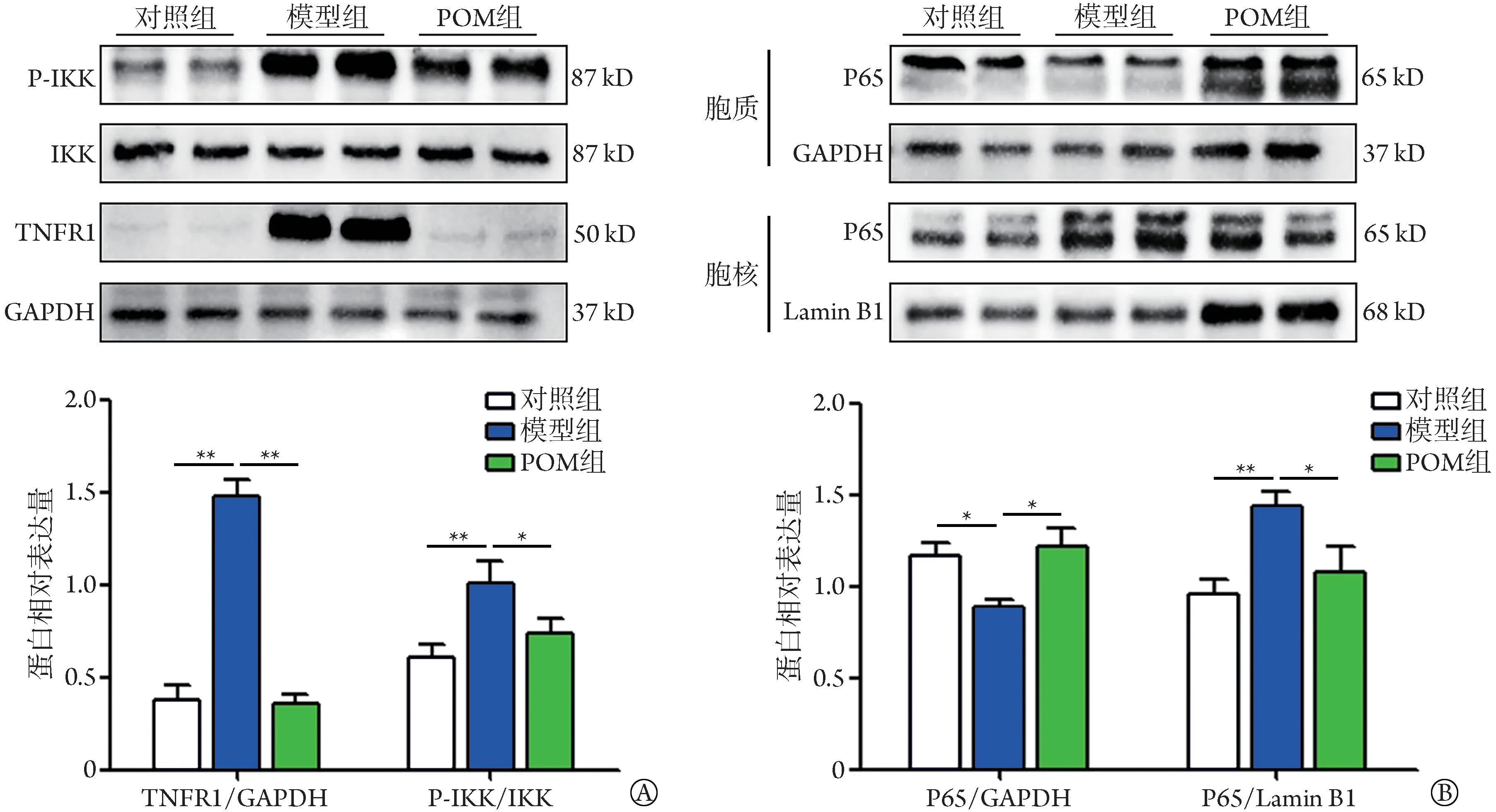
图5 POM对COPD 大鼠肺组织TNF‐α/NF‐κB信号通路蛋白TNFR1、P‐IKK/IKK、P65/GAPDH 和P65/Lamin B1表达的影响(xˉ±s,n=3)Fig.5 Effects of POM on TNFR1, P‐IKK/IKK, P65/GAPDH, and P65/Lamin B1 of TNF‐α/NF‐κB signaling pathway in lung of rats with COPD (xˉ±s, n=3)
3 讨 论
COPD 是一种慢性炎症性呼吸系统疾病。慢性气道炎症和黏液高分泌是COPD 的重要表现[20],其中气道炎症是COPD 肺组织病理生理学的核心[21]。香烟烟雾可促进肺组织促炎细胞因子如TNF‐α、IL家族等的释放,以及中性粒细胞、巨噬细胞和淋巴细胞聚集,导致肺组织损伤[22]。炎性因子可刺激呼吸道上皮杯状细胞增生,是呼吸道黏液高分泌的病理基础,可导致严重的呼吸道阻塞和呼吸道反复感染,导致高发病率和高病死率[23‐24]。研究显示,呼吸道黏液高分泌可使COPD急性加重的风险增加约2倍,死亡风险增加约3.5倍[25]。目前,COPD 的呼吸道炎症多采用糖皮质激素治疗[26],可在短期内缓解患者的临床症状,但长期使用不良反应较多,且不同个体用药效果差异较大[27]。因此,寻找新的治疗药物或方法是COPD 临床治疗的迫切需求。TNF‐α介导的信号通路具有调节呼吸道炎症和黏液分泌的重要作用[28‐30]。本研究采用POM 对COPD 大鼠进行干预,结果显示,经POM治疗后,COPD 大鼠肺功能指标TV、MV、FVC、FEV0.1、FEV0.3均有不同程度提高;同时,POM 还能使MLI 降低,MAN 升高,从而明显缓解COPD 大鼠肺组织的病理损伤,其机制可能与抑制TNF‐α的作用有关。
中性粒细胞、淋巴细胞和巨噬细胞是COPD 患者肺部炎性环境中的主要免疫细胞类型[4]。在炎性因子作用下,这些免疫细胞迅速被招募并分泌多种蛋白水解酶和炎性细胞因子,导致肺组织炎症和损伤[31‐32]。促炎细胞因子TNF‐α、IL‐1β、IL‐6 和IL‐13是COPD 炎症反应的关键指标。TNF‐α 作为促炎细胞因子,主要由活化的巨噬细胞、自然杀伤细胞和淋巴细胞分泌[6]。TNF‐α 是最早参与全身炎症反应的介质之一,可诱导其他炎性细胞因子的释放,促进炎性细胞的黏附、迁移和侵袭,扩大炎症效应,造成肺损伤[33‐34]。研究显示,COPD患者血清TNF‐α水平升高,且与肺功能呈负相关[7]。IL‐1β 可促进中性粒细胞在气道周围聚集,增强炎症反应,引起支气管黏膜水肿,腺体分泌增多,加重气道阻塞[35]。IL‐6 可预测COPD 的加重频率,诱发和维持呼吸道炎症[36]。IL‐13 在肺的表达会导致COPD 的表型伴有炎症、黏液化生及基质金属蛋白酶和组织蛋白酶依赖的肺气肿[37]。本研究发现,COPD大鼠BALF沉渣内中性粒细胞和淋巴细胞增多,巨噬细胞减少,与COPD 大鼠肺组织病理变化一致;血清TNF‐α、IL‐1β、IL‐6、IL‐13水平升高;而POM可逆转这些变化,提示POM可减轻COPD大鼠的呼吸道炎症。
呼吸道黏液高分泌是COPD的另一重要表现[20]。COPD 患者气道上皮的杯状细胞比例增加[38],而杯状细胞是呼吸道黏液的主要来源之一。MUC5AC 和MUC5B 是两种重要的呼吸道黏蛋白[39‐40]。黏蛋白过度分泌可导致呼吸道阻塞、肺功能下降和感染概率增高[41]。本研究发现,POM 可促进COPD 大鼠气道上皮杯状细胞增生,减少MUC5AC和MUC5B分泌,提示POM可抑制COPD大鼠气道黏液的分泌。
NF‐κB 作为一种核转录因子,与免疫反应、炎症反应、细胞增殖、转化和细胞凋亡等病理生理过程密切相关[42]。正常情况下,NF‐κB 存在于细胞质中,呈非活性状态;其经典激活途径是激活TNFR1,可诱导IKK 磷酸化;游离的NF‐κB 被激活并迅速转移到细胞核,与靶基因的κB序列连接,启动靶基因的表达,并促进免疫因子和炎性因子的分泌,如TNF‐α、S100蛋白家族、MUC家族、IL家族等[43‐44]。本 研 究 发 现,COPD 大 鼠 肺 组 织 中 的TNFR1、p‐IKK 和 胞 核 的P65 含 量 增 加,激 活 了TNF‐α/NF‐κB通路;经POM干预后,TNF‐α/NF‐κB通路可被抑制。
综上所述,本研究发现,POM 对COPD 大鼠的气道炎症和黏液高分泌均有一定的抑制作用,可能是通过抑制TNF‐α/NF‐κB信号通路实现的,但尚不能排除存在其他作用机制的可能。此外,长期服用POM 的有效剂量和可能的不良反应尚需进一步研究。
