食品检验用木糖赖氨酸脱氧胆盐琼脂质量差异分析
2024-02-28刘帅张捷陈怡文许苗苗李献王慧陈勃旭崔生辉周巍
刘帅,张捷,陈怡文,许苗苗,李献,王慧,陈勃旭,崔生辉*,周巍*
(1.河北省食品安全重点实验室,国家市场监管重点实验室(特殊食品监管 技术),特殊食品安全与健康河北省工程研究中心,河北省食品检验研究院,河北石家庄 050227)(2.中国食品药品检定研究院,北京 100050)
引发食品安全问题的主要原因是食源性致病菌的污染[1]。沙门氏菌和志贺氏菌是常见的致病菌,由沙门氏菌引起的病例位列世界之首,因此,对其进行准确快速的检出凸显的尤为重要[2-7]。多重聚合酶链式反应[8](Polymerase Chain Reaction,PCR)、多重荧光PCR[9]、生物传感器[10]、免疫微阵列技术[11]和DNA 微阵列杂交技术[12]等一系列新方法新技术也逐步应用于微生物检验中。但目前,其检验方法仍以分离培养为主。富集目标菌,是实现各种快速方法和共检的基础[13]。而培养基的性能直接影响微生物检验结果的准确性。目前国外关于培养基质量控制的标准主要有ISO 11133-2014,(Microbiology of Food,Animal Feed and Waterpreparation,Production,Storage and Performance Testing of Culture Media),主要用于食品、动物饲料、食品环境样品及食品相关的水质中微生物测定的培养基的质量验收;德国标准化委员会DIN 58959-10中,涉及试剂、染色剂和生物材料质控菌株使用要求;澳大利亚生物学会的Guidelines for Assuring Quality of Food and Water Microbiological culture media 中涉及食品、水中微生物测定的培养基质量控制标准;美国临床实验室标准委员会也发布了商业化培养基的质量控制标准Quality Control for Commercially Prepared Microbiological Culture Media。但这些标准并不符合我国现阶段国情,与我国现行标准不等效。
当今我国培养基行业迅速发展,由于生产原料来源广泛、生产工艺各有不同、生物制品购买受限等多种因素,国内标准的技术指标和相关依据已无法满足我国食品微生物培养基和试剂质量控制要求。根据《GB/T 27405-2008 食品质量控制规范 食品微生物检测》要求,我国从事食品微生物检测的实验室须具备检测用标准菌株,利用标准培养物来验收培养基(包括试剂盒)、验证方法和评估实验操作,从而保证检测实验过程和结果的可靠性[14,15]。培养基生产商与微生物实验室应重视标准菌株的作用[16]。培养基性能测试,应尽可能多的选取质控菌株。对生长特性典型的菌株与差异性生长的非典型菌株都应选取[17]。另外,选择性培养基需要具有抗干扰能力,既要促进目标菌生长,也应抑制非目标菌[18]。我国GB 4789 系列,沙门氏菌和志贺氏菌的检验均涉及XLD[19,20]。XLD 以指示剂变化为原理,筛检的指标是菌落产硫化氢和糖发酵能力[21,22]。为做好风险监测工作,本实验按照GB 4789.28-2013 中规定的验收方法,以鼠伤寒沙门氏菌ATCC 14028、福氏志贺氏菌CMCC 51572、金黄色葡萄球菌ATCC 6538 和大肠埃希氏菌ATCC 25922作为参照,另外选取6 株鼠伤寒沙门氏菌(CMCC 50115、CMCC 50970、CMCC 50975、CMCC 50976、CMCC 50977、CMCC 50994),1 株福氏志贺氏菌(CICC 21534)、4 株金黄色葡萄球菌(CMCC 26302、CMCC 26304、CMCC 26305、CMCC 26306)和5 株大肠埃希氏菌(CMCC 43201、CMCC 43203、CMCC 43204、CMCC 43205、CICC 24176)对4 个品牌的木糖赖氨酸脱氧胆盐培养基的外观、pH 值、水分含量等物理指标以及生长率选择性等微生物指标进行比较分析,以期为木糖赖氨酸脱氧胆盐培养基的生产以及实验室的验收提供多个补充质控菌株,为提高商品化培养基的质量提供新的思路。
1 材料与方法
1.1 材料
1.1.1 培养基
来源于4 个不同厂家生产的木糖赖氨酸脱氧胆盐琼脂:A 厂批号:20 190912;B 厂批号:191009;C 厂批号:1 084391;D 厂批号:20 190831;胰酪大豆胨琼脂(Tryptose Soya Agar,TSA):批号20190921。
1.1.2 测试菌株
本实验优先选取分离自国内相关样品,经过生化和分子方法鉴定明确至种水平的分离菌株,由国内微生物菌种保藏专门机构保存,具有自主知识产权、可溯源的优势。为增强代表性,按照来源、时间、地区等参数,选取具有稳定表型和生化性状的低致病能力的标准菌株。通过实验验证,最终确定相关特性与现行GB 4789.28-2013 中规定的质控菌株等效的测试菌株作为补充质控菌株。
7 株鼠伤寒沙门氏菌:ATCC 14028 购于美国典型菌种保藏中心;CMCC 50115、CMCC 50970、CMCC 50975、CMCC 50976、CMCC 50977、CMCC 50994 购于中国医学细菌保藏管理中心。
2 株福氏志贺菌:CMCC 51572 购于中国医学细菌保藏管理中心;CICC 21534 购于中国工业微生物菌种保藏管理中心。
5 株金黄色葡萄球菌:ATCC 6538 购于美国典型菌种保藏中心;CMCC 26302、CMCC 26304、CMCC 26305、CMCC 26306 购于中国医学细菌保藏管理中心。
6 株大肠埃希氏菌:ATCC 25922 购于美国典型菌种保藏中心;CMCC 43201、CMCC 43203、CMCC 43204、CMCC 43205 购于中国医学细菌保藏管理中心;CICC 24176 购于中国工业微生物菌种保藏管理中心。
所有菌株均采用含体积分数50%甘油的脑心浸液肉汤(水:甘油=1:1)冻存。
1.1.3 仪器与药品
ME204E 型电子天平,METTLER TOLEDO;S40K 型pH 计,METTLER TOLEDO;HVE-50 型自动高压灭菌器,HIRAYAMA;MIR-254-PC 型低温恒温培养箱,Panasonic;FED115 型热风循环烘箱,BINDER;DL91150 型游标卡尺,得力。
1.2 实验方法
1.2.1 外观
采用目测法,在自然光线明亮处,观察培养基颜色、均一度,及倾注平皿凝固后的颜色,透明度等。优质的培养基通常澄清,无杂质,具有应有的颜色。XLD 琼脂干粉外观应呈均匀粉红色粉末,加热煮沸后,溶液呈红色,凝固后为红色半透明,无杂质的琼脂培养基[23]。
1.2.2 pH值
按照产品使用说明书称取干粉培养基,加入相应量水,振荡、充分混匀,使配制容器上无可见干粉培养基残留,溶液中无可见大颗粒物。
1.2.2.1 测定溶解后pH值
应测定培养基溶液在20~25 ℃的pH 值。按照pH 测量仪器操作规程校正并测量,培养基溶液振荡充分混匀后,连续测定两次,求取平均值,即为该培养基灭菌前的pH 值[24]。
1.2.2.2 测定煮沸后pH值
将振荡充分混匀的培养基溶液煮沸灭菌,待冷却凝固后,将pH 计电极插入琼脂中,琼脂厚度应高于感应探头,待pH 计显现数值。连续测量两个位置的pH 值,求取平均数,即为煮沸后pH 值[24]。
1.2.3 水分含量
称取培养基干粉约1 g(W1,g),放置于扁形称量瓶(W2,g)中,扁形称量瓶要与待测培养基干粉在相同条件下干燥至恒重,温度设置105 ℃,干燥至恒重(W3,g)。要求称定迅速精密,根据称取培养基干粉的质量和减失的质量,计算出培养基的干燥失重。设置三个平行,求平均值,计算干燥失重[25]。水分含量见公式(1)计算:
式中:
W失——干燥失重,%;
W1——培养基称重,g;
W2——称量瓶恒重,g;
W3——称量瓶+培养基恒重,g。
1.2.4 生长特性
用目测法,在自然光线明亮处,肉眼观察并依次记录菌落形状、光泽、质地、颜色、透明程度、是否产生孢子及孢子颜色、平皿上菌落均一度。
每株菌选取适宜稀释度接种同一品牌培养基3块平皿,观察平皿菌落是否分布均匀,每一皿选取5 个较大菌落,5 个较小菌落,用游标卡尺测量其菌落直径,求取菌落直径平均值。
1.2.5 质量控制
1.2.5.1 平板的制备与保存
XLD 琼脂宜于使用前一天配置。根据不同品牌培养基的使用说明书称取用量、灭菌,待培养基冷却至45~50 ℃时,倾注平板。并按照不同品牌培养基提供的贮存条件进行保存和使用[26]。
1.2.5.2 工作菌悬液的制备
甘油冷冻菌种划线至TSA,于36 ℃,(24±2)h 条件下培养,再划线转接一次TSA,于36 ℃,(24±2)h 条件下培养。制备光密度值约1.5 的菌悬液,逐级稀释至菌数为500~2 000 CFU/mL。
1.2.5.3 目标菌生长率比较
《中国药典》2020 版在对培养基适用性检查中要求待检固体培养基上的菌落大小、形态与参照培养基的菌落一致,待检固体培养基上的菌落数与参照培养基上的菌落数的比值应在0.5~2 范围内[23]。吸取工作菌悬液100 µL,接种于待测XLD 平板和参比平板胰酪大豆胨琼脂要求所选稀释度适宜,涂布均匀。每个测试菌种涂布两个平皿,36 ℃,24 h 培养。在培养基上,目标菌呈典型生长。按下式(2)计算生长率。
式中:
PR——生长率,%;
NS——菌落总数—由待测XLD 培养基平板上得到,CFU;
N0——菌落总数—参比平板TSA 获得(该菌落总数应≥100 CFU)。
1.2.5.4 非目标菌半定量的结果比较
分别沾取不同菌株的工作菌悬液1 环(1 µL 接种环),在XLD 平板表面划六条平行直线,同时接种两个平板。将接种环伸入工作菌悬液下部,以防环上产生气泡或泡沫。取一满环接种物,接触容器边缘除去多余液体,重复3 次,接种环与琼脂表面的角度应为20°~30°。划线过程应快速连续,划线力度和划线速度前后一致。
培养后按以下方法计算生长指数G。一条划线上的菌落生长稠密记为G=1,如果一条划线上仅一半有稠密菌落生长,记为G=0.5。如果一条划线上菌落生长微弱、没有菌落生长或菌落生长少于划线的一半,则记为G=0。计算一个平板上六条划线的G 值总和,即为每个平板上的生长指数G。一个平板上G 值最大为6。两个平板的G 值平均数即为该菌在XLD 琼脂上的生长指数。非目标菌的生长指数G 一般小于或等于1,至少保证小于5。
1.2.6 数据分析
本实验所有结果采用Excel 进行统计学分析。
2 结果与分析
2.1 外观
对4 个不同品牌XLD 培养基的干粉外观,溶解过程,配制后特性进行比较,发现A 产XLD 培养基干粉、B 产干粉与D 产干粉粉色渐弱,C 产干粉颜色为土黄色。通常认为其干粉颜色为粉红色。4 个品牌配制100 mL 的添加量均不相同,但集中在5.50~5.90 g 范围内。另外,4 个品牌的干粉在溶解过程中都表现出较快速度,搅拌过程中有微小颗粒粘壁现象,但经过加热煮沸,溶液颜色呈现出黑红色和红色的差异,凝固后的平板虽然都透明,无杂质,但平板颜色表现出肉眼可见差异,有红色和桔红色的区别。具体结果见表1。本实验中,干粉颜色有肉眼可见差异,配制时的添加量也有不同。选取的4 个不同品牌的木糖赖氨酸脱氧胆盐琼脂,其配方中就有添加酵母粉、酵母浸粉、酵母浸膏的不同。事实上,这三者是不同的产品。经过高温干燥失去活性的酵母菌体是酵母粉,而酵母浸粉需要酵母经过自溶酶解、分离、真空浓缩、喷雾干燥等工序精制而成,酵母浸膏则要经过长时间浓缩制成。Dubencovs 等[27]发现不同氮源(酵母提取物、酵母氮碱有/没有氨基酸和胰蛋白胨)对甲烷氧化菌的生长速率有不同促进作用。Bazana 等[28]研究发现,微波炉可作为生产培养基和保持培养基最佳质量的有效替代方法。由此可见,培养基的生产原料会对培养基的性状产生影响。

表1 4 个品牌XLD培养基的一般性状Table 1 General properties of XLD medium produced by four manufacturers
2.2 pH值
4 个品牌XLD 琼脂溶解后的pH 值都在标签范围7.4±0.2 内,A 品牌培养基煮沸后的pH 值与溶解后的pH 值并未发生变化,均为7.26,其余3 个品牌的pH 值在煮沸后都小于溶解后。经过无重复双因素方差分析,同一品牌的pH 值溶解后与煮沸后无显著性差异(P>0.05),无论在溶解后的状态,还是煮沸后的状态,4 个品牌的pH 值无显著性差异(P>0.05),均符合GB 4789.4-2016 附录中对pH 的要求。实验结果见表2。

表2 4 个品牌XLD培养基pH值的比较Table 2 Comparison of pH of four brands of XLD medium
2.3 水分含量
YY/T 0578—2005《沙门、志贺菌属琼脂培养基》中规定,通过干燥失重方法测定水分含量,结果不超过6%[29]。结果显示,A、B、C、D 四个品牌干粉的水分含量在5.4%~5.9%内,A 品牌5.55%,B 品牌5.92%,C 品牌5.46%,D 品牌5.94%。结合水分活度来看,一般控制在5%~6%,这是有效控制培养基干粉微生物污染的重要手段。4 个品牌XLD琼脂含水量均符合标准要求。
2.4 生长特性
根据ISO 标准和GB、FDA 和BMA 方法,沙门氏菌培养24 h,大多数可形成黑色菌落,大小约为2 mm,边缘整齐,光滑,湿润。以ATCC 14028 为参照,选取6 株鼠伤寒沙门氏菌对4 个品牌XLD 琼脂进行测试,发现均可良好生长,且菌落形态一致,均为湿润黑色圆形菌落,边缘光滑整齐。同一株菌在4 个品牌上生长的较大菌落之间菌落直径无显著性差异(P>0.05),较小菌落间不存在显著性差异(P>0.05),较大菌落与较小菌落间不存在显著性差异(P>0.05);不同菌株在同一品牌培养基上,菌落直径无显著性差异(P>0.05)。结果见表3。选取2 株福氏志贺氏菌对4 个品牌XLD 进行测试,都可良好生长,且菌落形态一致,无色菌落,无黑心,边缘整齐,光滑,湿润。同一株菌在4 个品牌上生长的较大菌落之间菌落直径无显著性差异(P>0.05),较小菌落间不存在显著性差异(P>0.05),较大菌落与较小菌落间不存在显著性差异(P>0.05);不同菌株在同一品牌培养基上,菌落直径无显著性差异(P>0.05)。结果见表4。
表3 不同沙门氏菌在4个品牌XLD上的菌落直径Table 3 Colony diameters of different Salmonella on four brands of XLD (mm,±s)

表3 不同沙门氏菌在4个品牌XLD上的菌落直径Table 3 Colony diameters of different Salmonella on four brands of XLD (mm,±s)
表4 福氏志贺氏菌CMCC 51572在4个品牌XLD上的生长特性Table 4 Growth characteristics of Shigella flexi CMCC 51572 on four brands of XLD (mm,±s)
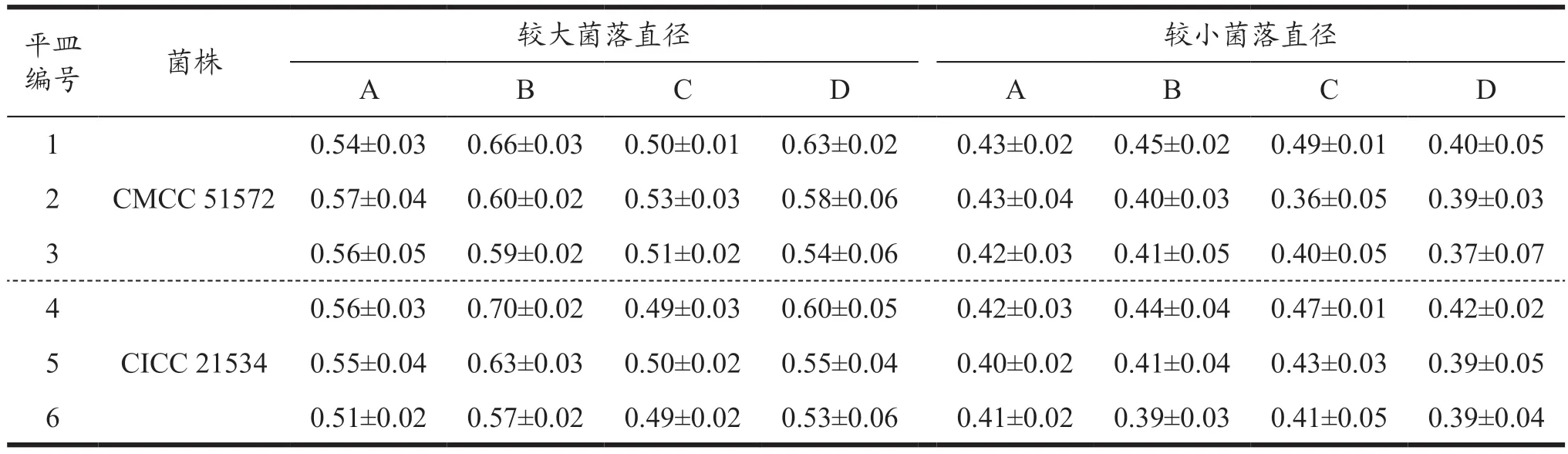
表4 福氏志贺氏菌CMCC 51572在4个品牌XLD上的生长特性Table 4 Growth characteristics of Shigella flexi CMCC 51572 on four brands of XLD (mm,±s)
2.5 质量控制
2.5.1 目标菌生长率比较
按照GB 4789.28-2013 的要求,以胰酪大豆胨平板菌落数为参比,对4 个品牌XLD 培养基的生长率PR结果进行研究,结果显示,A 品牌中,9 株菌生长率PR在0.72~1.09 内;B 品牌中,9 株菌生长率PR在0.70~1.14 内;C 品牌中,9 株菌生长率PR在0.70~1.16 内;D 品牌中,9 株菌生长率PR在0.72~1.13 内。不同菌株在不同品牌XLD 上的生长率PR均≥0.7,相同菌株在不同品牌培养基上的生长率无显著性差异(P>0.05),不同菌株在同一培养基上的生长率无显著性差异(P>0.05),符合质量控制标准。具体结果见表5。
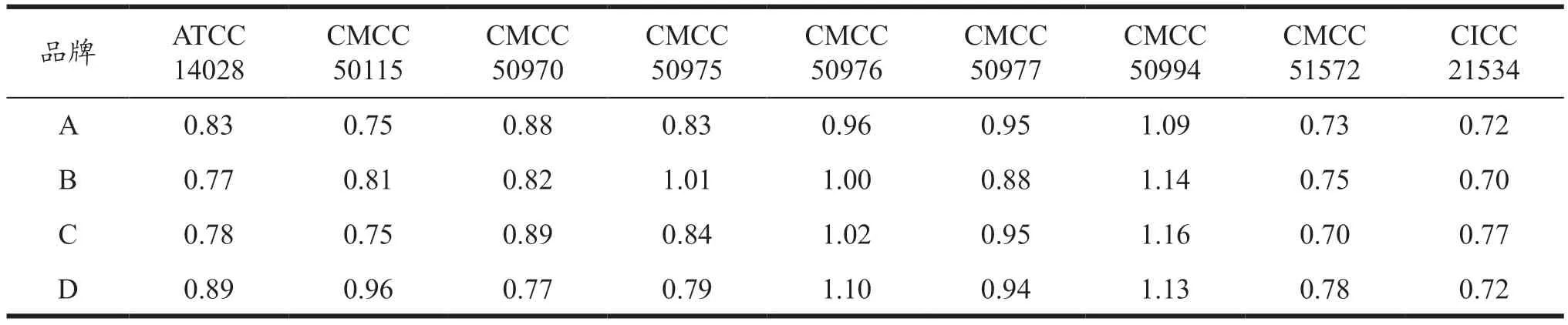
表5 不同菌种在不同XLD培养基上的生长率PRTable 5 Growth rates of different cultures on different XLD medium
2.5.2 非目标菌半定量的结果比较
按照GB 4789.28-2013 的要求,金黄色葡萄球菌在XLD 上生长指数G=0,大肠埃希氏菌在XLD上生长指数G<5,黄色菌落。5 株金黄色葡萄球菌ATCC 6538、CMCC 26302、CMCC 26304、CMCC 26305 和CMCC 26306 在4 个品牌XLD 培养基上均未生长,4 个品牌的XLD 对5 株金黄色葡萄球菌均表现出抑制反应,符合国标要求,结果见表6。6 株大肠埃希氏菌ATCC 25922、CMCC 43201、CMCC 43203、CMCC 43204、CMCC 43205 和CICC 24176 在4 个品牌XLD 上的菌落特征均为黄色菌落,生长指数G 在1~3 内,符合国标要求,结果见表7。

表6 5 株金黄色葡萄球菌在不同XLD培养基上的生长指数Table 6 Growth index of five strains of Staphylococcus aureus on different XLD media
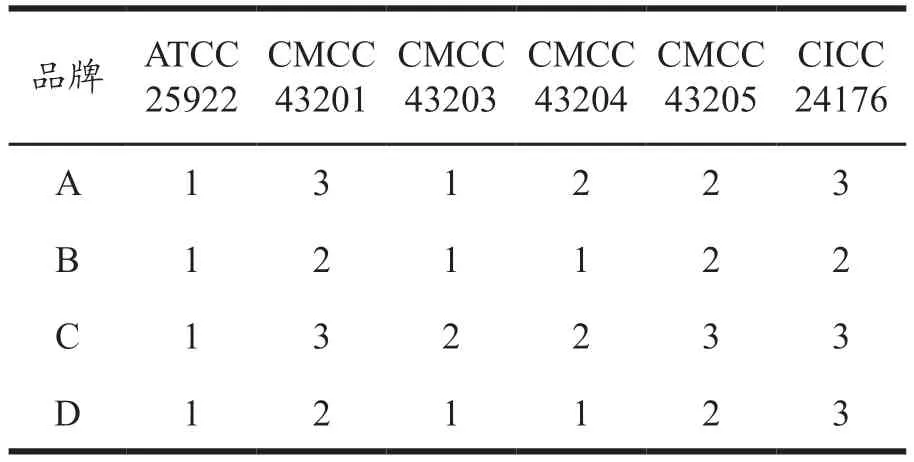
表7 6 株大肠埃希氏菌在不同XLD培养基上的生长指数Table 7 Growth index of six strains of Escherichia coli on different XLD media
3 结论
本实验得出结论:4 个品牌的木糖赖氨酸脱氧胆盐培养基的理化指标(颜色、pH 值、水分含量)和微生物指标(菌落形态、菌落直径、生长率)全部符合GB 4789.28-2013,6 株鼠伤寒沙门氏菌(CMCC 50115、CMCC 50970、CMCC 50975、CMCC 50976、CMCC 50977、CMCC 50994)、1 株福氏志贺氏菌(CICC 21534)、4 株金黄色葡萄球菌(CMCC 26302、CMCC 26304、CMCC 26305、CMCC 26306)和5 株大肠埃希氏菌(CMCC 43201、CMCC 43203、CMCC 43204、CMCC 43205、CICC 24176)可用作验收木糖赖氨酸脱氧胆盐培养基质控菌株的补充菌株。
本次实验为生产研发培养基、实验室验收培养基提供了新的思路,培养基的性能对实验结果的影响应该引起重视。现行GB 4789.28-2013《食品安全国家标准 食品微生物学检验 培养基和试剂的质量要求》中,并未对培养基的生产原料、生产工艺、配制方法进行明确规范,涉及的质控菌株大部分来自美国典型菌种保藏中心。因此,在我国培养基生产研发行业繁荣发展的今天,还需要进一步研究规范培养基的原料选用,规范培养基的生产工艺及配制方法,使我国自主的菌种保藏中心的质控菌株成为标准中的主流菌株,进一步完善质量控制方案,更好地保证检验工作的顺利进行,为食品安全领域提供更准确的服务。
