小檗碱诱导骨肉瘤细胞铁死亡的作用及机制 Δ
2024-02-28姬健钧邱文奎开封市中心医院骨科二病区河南开封475000
姬健钧,邱文奎 (开封市中心医院骨科二病区,河南 开封 475000)
骨肉瘤具有局部侵袭、快速浸润转移和组织特异性等特性,是青少年和儿童中最为常见的原发性骨恶性肿瘤,给患者生命健康和生活质量带来了严重威胁。目前,临床上针对骨肉瘤的治疗方式仍以常规的手术切除、放疗和化疗为主,但骨肉瘤患者易耐受并且其5年总体生存率较低[1]。因此,亟须寻找高效的辅助药物或者替代疗法。
小檗碱是从中药黄连以及其他小檗属植物里面分离出来的异喹啉类生物碱,能够用于多种疾病的治疗,如代谢、消化、神经和心血管系统疾病以及肿瘤[2—3]。有研究指出,小檗碱能够通过诱导骨肉瘤细胞的凋亡、自噬来抑制其增殖[4—5]。铁死亡(ferroptosis)是一种新的调节性细胞死亡方式,其特征是铁离子依赖的脂质过氧化物大量蓄积,与骨肉瘤细胞生长、耐药等密切相关[6]。本课题组前期预实验发现,小檗碱可抑制骨肉瘤细胞的增殖,但采用凋亡或自噬抑制剂并不能有效缓解小檗碱诱导的骨肉瘤细胞死亡,这提示可能存在其他的细胞死亡方式。基于此,本研究以人骨肉瘤细胞MG63为研究对象,初步探讨铁死亡在小檗碱抑制MG63细胞中的作用及其可能机制,以期为临床上骨肉瘤的防治提供新的思路和治疗靶点。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:Nanodrop 2000 型超微量分光光度计(美国Thermo Fisher Scientific 公司),Spectra Max iD型酶标仪(美国Molecular Devices公司),DM2500 型荧光倒置显微镜(德国Leica 公司),JEM-1400型透射电子显微镜(日本JEOL公司),5200型化学发光图像分析系统(上海天能科技有限公司),1658003-Mini-Protean®Tetra 小型垂直电泳装置、1703930-Mini Trans-Blot®型电泳槽(美国Bio-Rad 公司),5452 型台式高速离心机(德国Eppendorf公司)。
1.2 主要药品与试剂
小檗碱对照品(批号BWB50137,纯度≥98%)购自北京北纳创联生物技术研究院;胎牛血清和DMEM 培养基均购自美国Gibco 公司;兔源信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)、肿瘤蛋白53(tumor protein 53,p53)、磷酸化STAT3(phosphated STAT3,p-STAT3)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗和辣根过氧化物酶标记的山羊抗兔IgG二抗(货号分别为bs-20382R、bsm-33058、bs-1658R、bs-41373R、bs-80295G)均购自北京博奥森生物技术有限公司;转染试剂lipofectamine 2000(批号11668500)购自美国Invitrogen公司;过表达质粒pEGFP-N1和pEGFP-N1-STAT3(批号分别为172281、111934)均购自美国Addgene 公司;CCK-8试剂盒和细胞核增殖相关抗原Ki-67(nuclear proliferation associated-antigen Ki-67,Ki67)一抗(批号分别为G4103、GB111499)均购自武汉赛维尔生物科技有限公司;Fe2+检测荧光探针FerroOrange(批号F374)购自日本同仁化学研究所;活性氧(reactive oxygen species,ROS)探针H2DCFDA(批号HY-D0940)购自美国MCE公司;免疫染色通透液、免疫染色封闭液、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒、细胞核蛋白提取试剂盒、电泳迁移率实验(electrophoretic mobility shift assay,EMSA)试剂盒、生物素标记EMSA 探针、Alexa Fluor 647 标记的山羊抗兔荧光二抗、四甲基罗丹明乙酯(TMRE)线粒体膜电位检测试剂盒(批号分别为P0096、P0102、S0131M、S0052、P0011、P0027、GS002、GS083B、A0468、C2001S)均购自上海碧云天生物技术有限公司;p53 小干扰RNA(siRNA)和阴性对照siRNA(negative control siRNA,NC siRNA)套装(批号A10001)购自上海吉玛制药技术有限公司;兔源溶质载体家族7 成员11(solute carrier family 7 member 11,SLC7A11)一抗(批号D2M7A)购自美国Cell Signa- ling Technology公司。
1.3 细胞株
本研究所用人骨肉瘤细胞MG63 购自中国科学院上海细胞库。将MG63 细胞接种于含1%青-链霉素和10%胎牛血清的DMEM 培养基中,置于含5%CO2的37 ℃培养箱中培养。当细胞传至第5 代后用于后续实验。
2 方法
2.1 小檗碱对MG63 细胞铁死亡和STAT3/p53/SLC7A11信号通路的影响
2.1.1 细胞分组及处理
参考预实验结果,将细胞分为对照组和不同浓度(2.5、5.0、10.0 μmol/L)小檗碱处理组。除对照组不作干预外,其余各组MG63细胞分别加入含上述药物的培养基,常规培养24 h后进行以下检测。
2.1.2 MG63细胞存活率的检测
将细胞按照5×103个/孔的密度接种于96 孔板中,按“2.1.1”项下方法进行分组(每组设6 个复孔)、给药和培养。处理结束后,每孔中加入CCK-8工作液10 μL,随后继续培养30 min。以不加细胞和药物的空白培养基为空白组,采用酶标仪在450 nm波长条件下测定各孔细胞的吸光度(A),并计算细胞存活率:细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.1.3 MG63细胞中Ki67蛋白表达水平的检测
将细胞按照1×105个/孔的密度接种于12 孔板中,按照“2.1.1”项下方法进行分组(每组设3 个复孔)、给药和培养,然后用4%多聚甲醛固定细胞20 min;以免疫染色通透液透化10 min后,加入免疫染色封闭液封闭1 h;加入Ki67 一抗(稀释比例为1∶200),4 °C 孵育过夜;加入Alexa Fluor 647 标记的山羊抗兔荧光二抗(稀释比例为1∶200),室温下避光孵育2 h;DAPI 染核10 min 后用荧光倒置显微镜进行拍照观察,采用Image J 软件计算其相对荧光强度来表示蛋白表达水平。
2.1.4 MG63细胞中线粒体超微结构观察
将细胞按照1×105个/孔的密度接种于12 孔板中,按照“2.1.1”项下方法进行分组(每组设3 个复孔)、给药与处理。处理结束后,用2.5%戊二醛在4 °C 下固定过夜,之后加入1%锇酸,放置2 h 后用乙醇和丙酮进行脱水;待包埋固化后进行切片(切片厚度50 nm),用3%醋酸铀-枸橼酸铅进行双染色,最后用透射电镜观察线粒体超微结构变化。
2.1.5 MG63细胞内Fe2+水平的检测
将细胞按照1×105个/孔的密度接种于12 孔板中,按照“2.1.1”项下方法进行分组(每组设3 个复孔)、给药与处理。处理结束后,用无血清的细胞培养基将细胞洗涤3次,加入1 μmol/L的FerroOrange荧光探针工作溶液避光孵育30 min,之后用DAPI染核5 min。采用荧光倒置显微镜进行拍照,采用Image J 软件测定荧光强度来表示Fe2+水平。
2.1.6 MG63细胞内ROS水平的检测
将细胞按照1×105个/孔的密度接种于12 孔板中,按照“2.1.1”项下方法进行分组(每组设3 个复孔)、给药与处理。处理结束后加入用无血清培养基稀释的H2DCFDA 探针(10 μmol/L),继续孵育30 min。DAPI染核后用荧光显微镜拍照,采用Image J 软件测定ROS的平均荧光强度来表示ROS水平。
2.1.7 MG63细胞内MDA含量和GSH水平的检测
将细胞按照2.5×105个/孔的密度接种于6 孔板中,按照“2.1.1”项下方法进行分组(每组设3 个复孔)、给药与处理。处理结束后,收集细胞,严格按照检测试剂盒说明书方法操作,使用酶标仪分别在530、410 nm波长条件下测定A,计算MDA含量和GSH水平。
2.1.8 MG63细胞内STAT3与DNA结合活性的检测
采用EMSA试剂盒进行检测。将细胞按照2.5×105个/孔的密度接种于6孔板中,按照“2.1.1”项下方法进行分组(每组设3个复孔)、给药与处理。按照试剂盒说明书方法提取细胞核蛋白,采用BCA法测定总蛋白浓度。按照EMSA试剂盒说明书要求配制反应体系,加入生物素标记的STAT3探针,室温静置25 min。进行非变性聚丙烯酰胺凝胶电泳,最后与链霉亲和素标记辣根过氧化物酶(streptavidin-HRP)反应后经化学发光法进行成像,采用Image J软件检测STAT3与DNA的结合活性。
2.1.9 MG63 细胞内p-STAT3、p53 和SLC7A11 蛋白表达水平的检测
采用Western blot 法进行检测。将细胞按照2.5×105个/孔的密度接种于6 孔板中,按照“2.1.1”项下方法进行分组(每组设3个复孔)、给药与处理。处理结束后,收集细胞并充分裂解,提取细胞中总蛋白,采用BCA法测定蛋白浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(起始电压80 V,待样品基本平齐后将电压转为120 V,待溴酚蓝到达分离胶底部时终止电泳),转膜(恒流250 mA,转膜时间2 h),封闭(5%脱脂奶粉);加入p-STAT3、p53、SLC7A11、GAPDH一抗(除GAPDH一抗的稀释比例为1∶4 000 外其余一抗的稀释比例均为1∶1 000),4 °C 孵育过夜;漂洗结束后,加入辣根过氧化酶标记的山羊抗兔IgG二抗(稀释比例为1∶2 000),室温孵育1 h。采用化学发光图像分析系统成像后,采用Image J软件进行灰度分析,以目的蛋白和内参蛋白GAPDH条带的灰度值比值计算目的蛋白的表达水平。
2.2 p53在小檗碱诱导MG63细胞铁死亡中的作用
2.2.1 p53 siRNA转染与细胞分组
将细胞按照2×105个/孔的密度接种于6孔板中,待细胞融合度达到60%左右进行转染。按转染试剂说明书配制p53 siRNA 和NC siRNA 的转染体系,分别转染细胞6 h后更换培养液继续培养48 h。将细胞分为对照组(细胞经NC siRNA 处理)、p53 siRNA 组(细胞经p53 siRNA 处理)、小檗碱组(细胞经NC siRNA 处理后再用10 μmol/L 的小檗碱处理)、p53 siRNA+小檗碱组(细胞经p53 siRNA处理后再用10 μmol/L的小檗碱处理),每组设3个复孔,加入空白培养基/含药培养基孵育24 h。
2.2.2 p53 siRNA对细胞中p53和SLC7A11蛋白表达的影响
取细胞按照“2.2.1”项下方法进行接种、分组与处理。培养结束后,按“2.1.9”项下方法检测细胞中p53 和SLC7A11 蛋白表达水平。p53、SLC7A11 和GAPDH 一抗的稀释比例分别为1∶1 000、1∶1 000 和1∶4 000。以p53、SLC7A11 与内参蛋白GAPDH 条带的灰度值比值表示p53、SLC7A11蛋白的表达水平。
2.2.3 p53 siRNA对细胞线粒体膜电位的影响
取细胞按照“2.2.1”项下方法进行接种、分组与处理。培养结束后,加入TMRE 染色工作液,放置在培养箱中孵育30 min;采用荧光显微镜观察,采用Image J软件分析线粒体膜电位变化。
2.2.4 p53 siRNA 对细胞中MDA 含量和GSH 水平的影响
取细胞按照“2.2.1”项下方法进行接种、分组与处理。培养结束后,按“2.1.7”项下方法检测细胞中MDA含量与GSH水平。
2.3 过表达STAT3 对经小檗碱处理的MG63 细胞中p53/SLC7A11信号通路的影响
2.3.1 STAT3过表达质粒的转染与细胞分组
将MG63 细胞按照2×105个/孔的密度接种于6 孔板中,待细胞密度达到70%时,向每孔中加入800 μL完全培养基(不含抗生素),待转染。用超微量分光光度计检测质粒浓度。取pEGFP-N1和pEGFP-N1-STAT3质粒各4 μg,按照转染试剂说明书方法进行细胞转染。将细胞分为对照组(转染pEGFP-N1 质粒)、小檗碱组(转染pEGFP-N1 质粒后再用10 μmol/L 小檗碱处理)、STAT3组(转染pEGFP-N1-STAT3 质粒)、STAT3+小檗碱组(转染pEGFP-N1-STAT3 质粒后再用10 μmol/L 小檗碱处理),每组设3个复孔,加入空白培养基/含药培养基孵育24 h后进行以下检测。
2.3.2 过表达STAT3 对细胞中p-STAT3、STAT3、p53 和SLC7A11蛋白表达的影响
按照“2.3.1”项下方法进行细胞接种、分组与处理。培养结束后,按照“2.1.9”项下方法检测细胞中p-STAT3、STAT3、p53 和SLC7A11 蛋白表达水平。p-STAT3、STAT3、p53 和SLC7A11 一抗的稀释比例均为1∶1 000,GAPDH 一抗的稀释比例为1∶4 000。以各目的蛋白与内参蛋白GAPDH条带的灰度值比值表示目的蛋白的表达水平。
2.4 统计学方法
采用GraphPad Prism 5.01 软件进行统计分析。计量资料以±s表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 小檗碱对MG63 细胞铁死亡和STAT3/p53/SLC7A11信号通路的影响结果
3.1.1 小檗碱对MG63细胞存活率的影响
与对照组[(100.00±1.75)%,n=6]比较,2.5、5.0、10.0 μmol/L 小檗碱处理组细胞24 h 的存活率[分别为(81.62±1.94)%、(68.58±1.62)%、(56.96±1.80)%,n=6]均显著降低(P<0.01)。
3.1.2 小檗碱对细胞中Ki67蛋白表达水平的影响
与对照组[(100.00±2.09)%,n=3]比较,2.5、5.0、10.0 μmol/L 小檗碱处理组细胞中Ki67 蛋白表达水平[相对荧光强度分别为(71.36±2.23)%、(45.58±1.75)%、(34.92±1.44)%,n=3]均显著降低(P<0.01),且Ki67 蛋白的表达水平有随着药物浓度增加而逐渐降低的趋势。结果见图1。
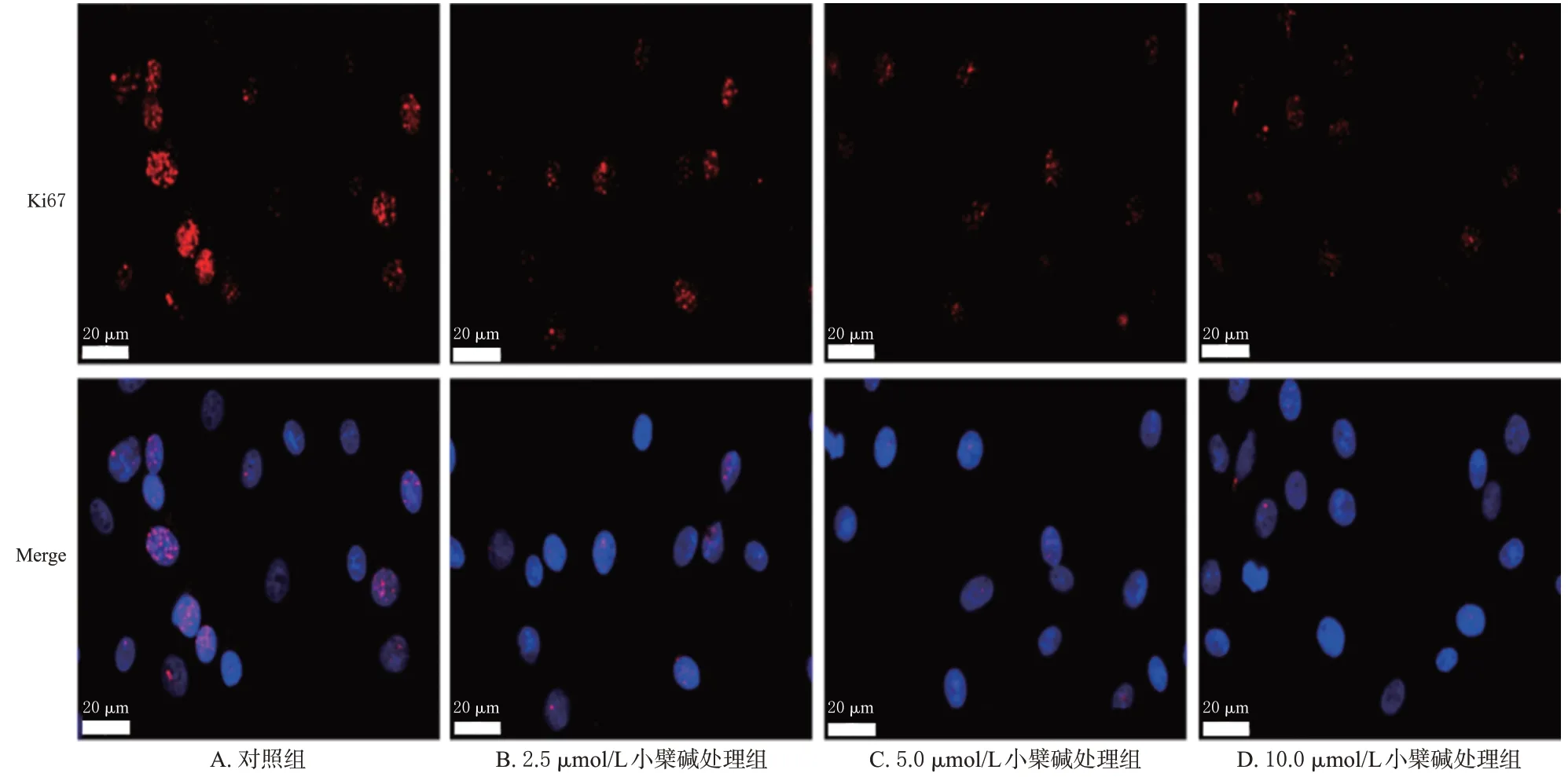
图1 小檗碱对MG63细胞内Ki67蛋白表达影响的荧光染色图
3.1.3 小檗碱对MG63细胞线粒体超微结构的影响
经不同浓度的小檗碱处理后,MG63 细胞线粒体体积逐渐变小,线粒体膜破裂,线粒体嵴减少或消失。结果见图2。
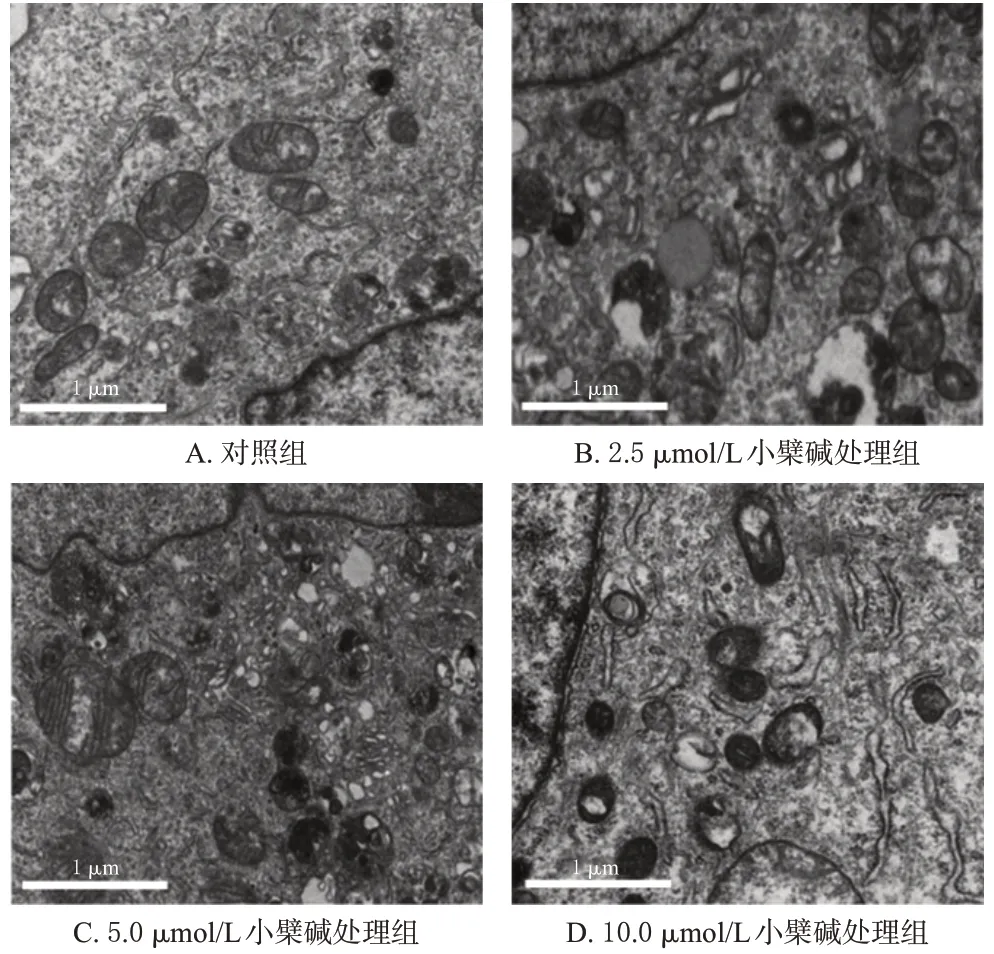
图2 小檗碱对MG63细胞线粒体超微结构影响的透射电镜图
3.1.4 小檗碱对MG63细胞内Fe2+水平的影响
与对照组比较,小檗碱各浓度处理组细胞内Fe2+水平均显著升高(P<0.01),且有随着药物浓度增加而逐渐升高的趋势。结果见图3、表1。
表1 各组细胞内Fe2+和ROS 水平的检测结果(±s,n=3)

表1 各组细胞内Fe2+和ROS 水平的检测结果(±s,n=3)
a:与对照组比较,P<0.01。
分组对照组2.5 μmol/L小檗碱处理组5.0 μmol/L小檗碱处理组10.0 μmol/L小檗碱处理组Fe2+荧光强度9.58±1.04 16.13±1.76a 30.74±2.91a 43.26±3.15a ROS荧光强度7.36±1.19 13.54±1.35a 22.41±2.07a 29.87±2.42a
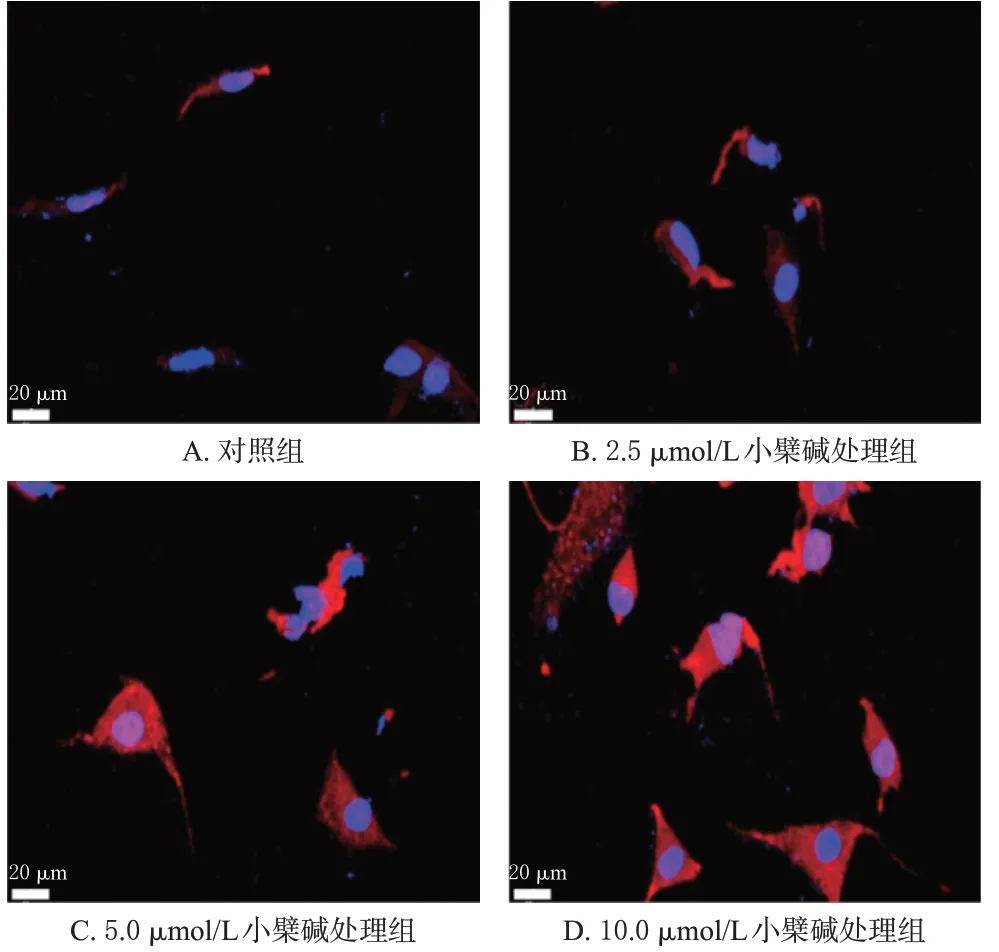
图3 小檗碱对MG63细胞内Fe2+水平影响的荧光显微图
3.1.5 小檗碱对MG63细胞内ROS水平的影响
与对照组比较,小檗碱各浓度处理组细胞内ROS水平均显著升高(P<0.01),且有随着药物浓度增加而逐渐升高的趋势。结果见表1、图4。
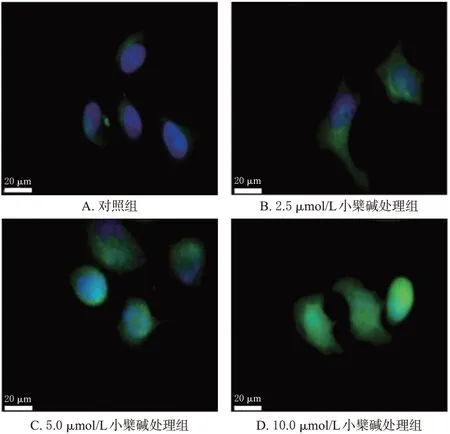
图4 小檗碱对MG63 细胞内ROS 水平影响的荧光显微图
3.1.6 小檗碱对MG63细胞内MDA含量和GSH水平的影响
与对照组比较,小檗碱各浓度处理组细胞内MDA含量均显著升高(P<0.01),GSH 水平均显著降低(P<0.01)。结果见表2。
表2 各组细胞内MDA 含量和GSH 水平的检测结果(±s,n=3)
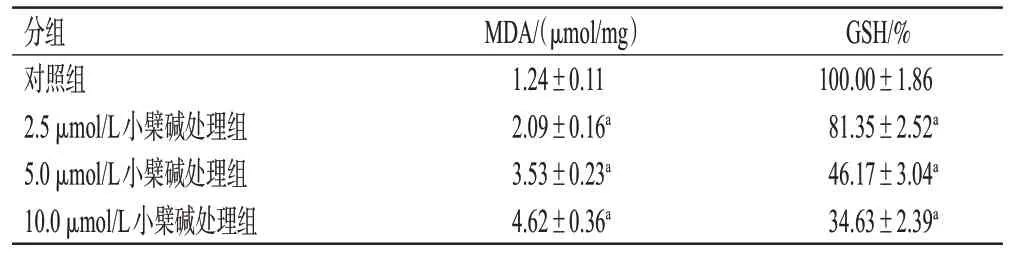
表2 各组细胞内MDA 含量和GSH 水平的检测结果(±s,n=3)
a:与对照组比较,P<0.01。
分组对照组2.5 μmol/L小檗碱处理组5.0 μmol/L小檗碱处理组10.0 μmol/L小檗碱处理组GSH/%100.00±1.86 81.35±2.52a 46.17±3.04a 34.63±2.39a MDA/(μmol/mg)1.24±0.11 2.09±0.16a 3.53±0.23a 4.62±0.36a
3.1.7 小檗碱对MG63 细胞内STAT3 与DNA 结合活性的影响
与对照组(1.00±0.08,n=3)比较,2.5、5.0、10.0 μmol/L小檗碱处理组细胞中STAT3与DNA的结合活性(分别为0.71±0.05、0.28±0.02、0.13±0.01,n=3)均显著降低(P<0.01)。结果见图5。
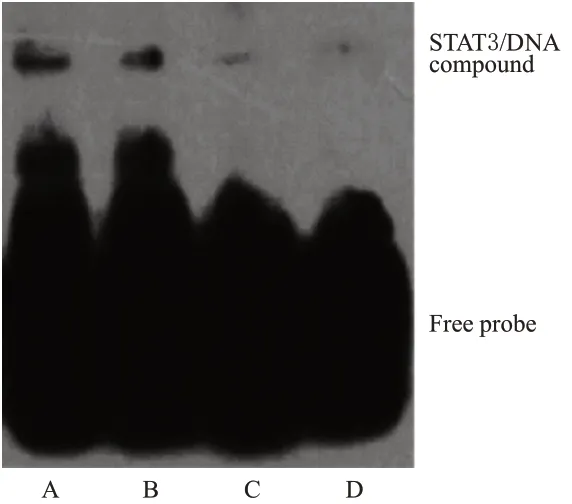
图5 各组细胞内STAT3与DNA结合活性的检测结果
3.1.8 小檗碱对MG63细胞内p-STAT3、p53和SLC7A11蛋白表达水平的影响
与对照组比较,小檗碱各浓度处理组细胞内p-STAT3 和SLC7A11 蛋白表达水平均显著降低,p53 蛋白表达水平均显著升高(P<0.05或P<0.01),且具有一定的浓度依赖性趋势。结果见图6和表3。
表3 各组细胞内p-STAT3、p53 和SLC7A11 蛋白表达水平的检测结果(±s,n=3)
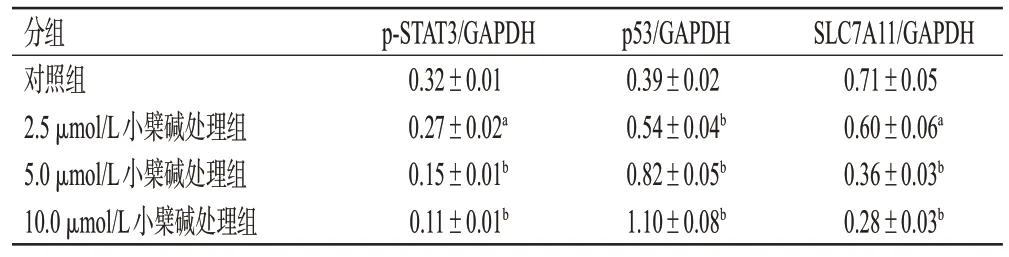
表3 各组细胞内p-STAT3、p53 和SLC7A11 蛋白表达水平的检测结果(±s,n=3)
a:与对照组比较,P<0.05;b:与对照组比较,P<0.01。
分组对照组2.5 μmol/L小檗碱处理组5.0 μmol/L小檗碱处理组10.0 μmol/L小檗碱处理组SLC7A11/GAPDH 0.71±0.05 0.60±0.06a 0.36±0.03b 0.28±0.03b p-STAT3/GAPDH 0.32±0.01 0.27±0.02a 0.15±0.01b 0.11±0.01b p53/GAPDH 0.39±0.02 0.54±0.04b 0.82±0.05b 1.10±0.08b
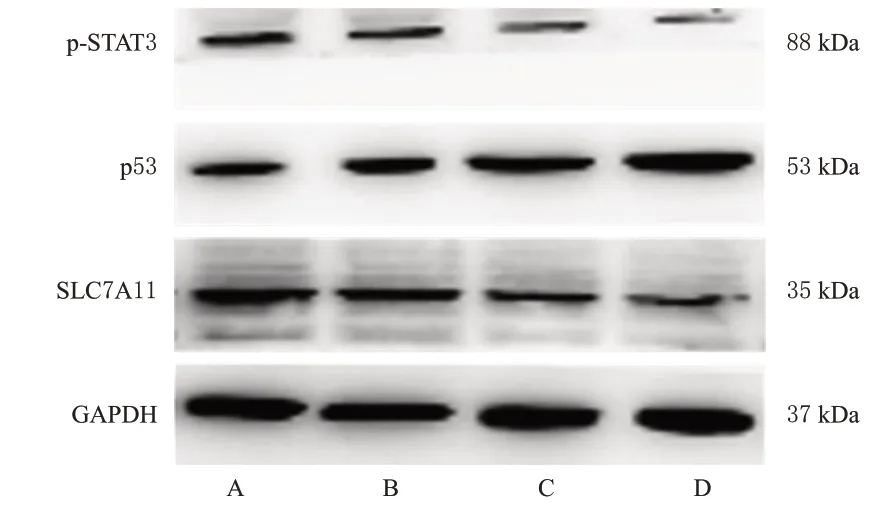
图6 各组细胞内p-STAT3、p53 和SLC7A11 蛋白表达的电泳图
3.2 p53 在小檗碱诱导MG63 细胞铁死亡中的作用考察结果
3.2.1 p53 siRNA 对各组MG63 细胞内p53 和SLC7A11蛋白表达的影响
与对照组比较,小檗碱组细胞内p53 蛋白表达水平显著升高(P<0.01),SLC7A11 蛋白表达水平显著降低(P<0.01)。与小檗碱组比较,p53 siRNA+小檗碱组细胞中p53 蛋白表达水平显著降低(P<0.01),SLC7A11 蛋白表达水平显著升高(P<0.01)。结果见图7和表4。
表4 各组细胞内p53 和SLC7A11 蛋白表达水平的检测结果(±s,n=3)
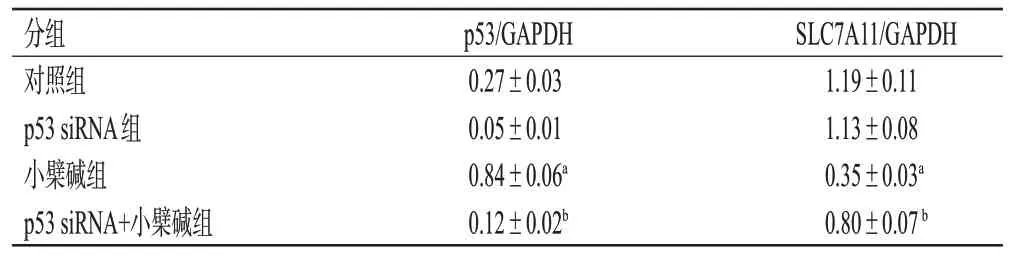
表4 各组细胞内p53 和SLC7A11 蛋白表达水平的检测结果(±s,n=3)
a:与对照组比较,P<0.01;b:与小檗碱组比较,P<0.01。
分组对照组p53 siRNA组小檗碱组p53 siRNA+小檗碱组p53/GAPDH 0.27±0.03 0.05±0.01 0.84±0.06a 0.12±0.02b SLC7A11/GAPDH 1.19±0.11 1.13±0.08 0.35±0.03a 0.80±0.07 b
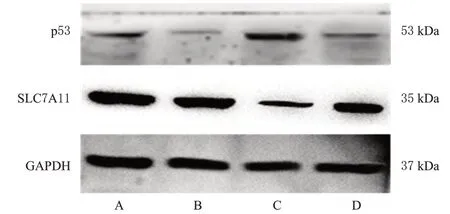
图7 各组细胞内p53和SLC7A11蛋白表达的电泳图
3.2.2 p53 siRNA对MG63细胞线粒体膜电位的影响
与对照组比较,小檗碱组细胞线粒体膜电位显著降低(P<0.01);与小檗碱组比较,p53 siRNA+小檗碱组细胞线粒体膜电位显著升高(P<0.01)。结果见图8和表5。
表5 各组细胞的线粒体膜电位和细胞内GSH 水平、MDA含量测定结果(±s,n=3)
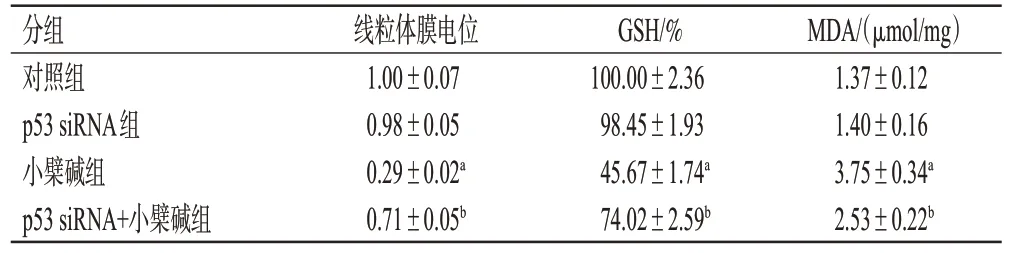
表5 各组细胞的线粒体膜电位和细胞内GSH 水平、MDA含量测定结果(±s,n=3)
a:与对照组比较,P<0.01;b:与小檗碱组比较,P<0.01。
分组对照组p53 siRNA组小檗碱组p53 siRNA+小檗碱组MDA/(μmol/mg)1.37±0.12 1.40±0.16 3.75±0.34a 2.53±0.22b线粒体膜电位1.00±0.07 0.98±0.05 0.29±0.02a 0.71±0.05b GSH/%100.00±2.36 98.45±1.93 45.67±1.74a 74.02±2.59b
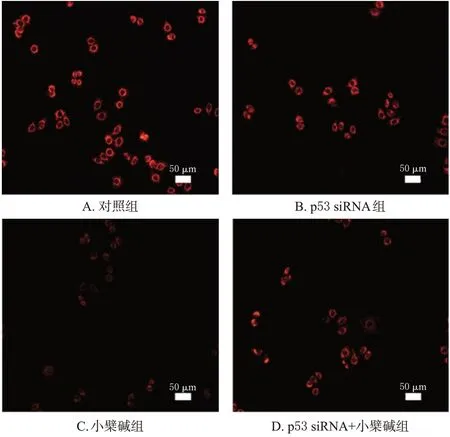
图8 各组细胞线粒体膜电位的荧光显微图
3.2.3 p53 siRNA 对MG63 细胞内GSH 水平和MDA 含量的影响
与对照组比较,小檗碱组细胞内GSH水平显著降低(P<0.01),MDA 含量显著升高(P<0.01);与小檗碱组比较,p53 siRNA+小檗碱组细胞内GSH 水平显著升高(P<0.01),MDA含量显著降低(P<0.01)。结果见表5。
3.3 过表达STAT3 对MG63 细胞内p-STAT3、STAT3、p53和SLC7A11蛋白表达水平的影响结果
与对照组比较,小檗碱组细胞内p-STAT3、STAT3和SLC7A11蛋白表达水平均显著降低(P<0.01),p53蛋白表达水平显著升高(P<0.01);与小檗碱组比较,STAT3+小檗碱组细胞内p-STAT3、STAT3和SLC7A11蛋白表达水平均显著升高(P<0.01),p53蛋白表达水平显著降低(P<0.01)。结果见图9、表6。
表6 各组细胞内p-STAT3、STAT3、p53、SLC7A11蛋白表达水平的检测结果(±s,n=3)
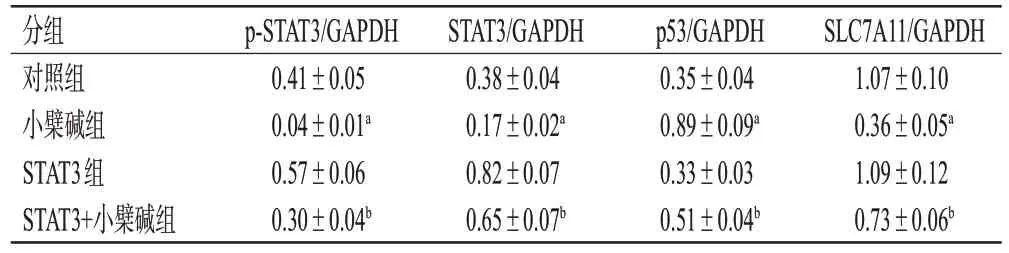
表6 各组细胞内p-STAT3、STAT3、p53、SLC7A11蛋白表达水平的检测结果(±s,n=3)
a:与对照组比较,P<0.01;b:与小檗碱组比较,P<0.01。
分组对照组小檗碱组STAT3组STAT3+小檗碱组SLC7A11/GAPDH 1.07±0.10 0.36±0.05a 1.09±0.12 0.73±0.06b p-STAT3/GAPDH 0.41±0.05 0.04±0.01a 0.57±0.06 0.30±0.04b STAT3/GAPDH 0.38±0.04 0.17±0.02a 0.82±0.07 0.65±0.07b p53/GAPDH 0.35±0.04 0.89±0.09a 0.33±0.03 0.51±0.04b
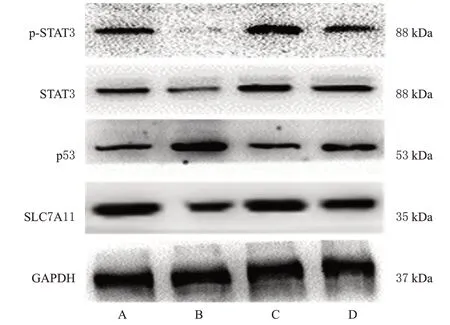
图9 各组细胞内STAT3/p53/SLC7A11 信号通路相关蛋白表达的电泳图
4 讨论
近年来,小檗碱因其低毒与抗肿瘤特性受到了广泛关注,其对多种恶性肿瘤细胞均具有良好的抑制作用。本研究结果表明,小檗碱能够降低MG63骨肉瘤细胞的存活率。Ki67是一种与细胞增殖相关的蛋白,仅在处于分裂期的细胞核内表达,是评价肿瘤细胞增殖活性、侵袭能力的重要指标。有研究指出,Ki67表达水平的升高与骨肉瘤的发生与发展呈正相关[7]。本研究结果显示,小檗碱处理后细胞中Ki67蛋白表达下调,这也进一步证实了小檗碱能抑制骨肉瘤细胞的增殖。
相关研究已证实,铁死亡在骨肉瘤的治疗、预后以及降低耐药性等方面发挥着重要作用[8]。细胞内Fe2+过载是细胞铁死亡的重要标志,ROS 和脂质过氧化物MDA的蓄积以及GSH的过度消耗则是细胞铁死亡的必要条件[9]。在本研究中,小檗碱处理MG63细胞后,细胞内Fe2+、ROS 水平和MDA 含量均升高,而GSH 水平降低。此外,透射电镜结果显示,小檗碱处理后出现了细胞线粒体体积变小、膜密度增加、线粒体嵴减少甚至消失等铁死亡特征。这些结果表明,小檗碱能够诱导MG63细胞铁死亡。
SLC7A11可以将细胞外胱氨酸转运至细胞内,在细胞内部将胱氨酸还原为半胱氨酸,进而参与细胞内重要抗氧化物GSH的合成。GSH在抑制细胞中脂质过氧化物累积方面有着重要作用,可防止细胞中铁死亡程序的启动[10]。p53 作为一种肿瘤抑制蛋白,越来越多的证据指出,p53可通过抑制SLC7A11蛋白的表达来诱导多种肿瘤细胞铁死亡[11]。本研究结果显示,小檗碱处理后MG63 细胞内p53 蛋白表达水平升高,而SLC7A11 蛋白表达水平降低;抑制p53 的表达能够提高小檗碱处理组细胞内SLC7A11 蛋白表达水平,改善GSH、MDA 和线粒体膜电位等铁死亡特异性指标。这些结果表明,小檗碱诱导MG63 细胞铁死亡的作用可能与调节p53/SLC7A11信号通路有关。
STAT3的磷酸化在STAT3信号活化中起关键作用,p-STAT3 蛋白表达水平也与细胞铁死亡有着密切关系[12]。研究指出,p53 作为铁死亡的重要调节因子,STAT3 对于p53 的表达具有负调控作用。磷酸化后的STAT3 能够转位至细胞核,通过与p53 的启动子区域结合来抑制p53 的表达[13]。有文献报道,STAT3 信号失活引起的p53表达水平上调参与了糖饥饿诱导的肾肿瘤细胞铁死亡[14]。骨肉瘤细胞中过度活化的STAT3 信号与骨肉瘤细胞增殖和耐药性的产生密切相关[15]。这提示STAT3 可能是骨肉瘤治疗的一个重要潜在靶标。本研究结果表明,小檗碱处理后,MG63 细胞中p-STAT3、STAT3 表达水平均降低,表明小檗碱抑制了MG63 细胞中STAT3 的活化;而过表达STAT3 则减弱了小檗碱对MG63 细胞p53/SLC7A11 信号通路的影响。这些研究结果表明,小檗碱可通过抑制STAT3 活化对p53/SLC7A11信号通路起调控作用。但需要注意的是,活化的STAT3能够下调促凋亡因子,同时促进抗凋亡蛋白的表达,来达到抑制肿瘤细胞凋亡的目的[16]。未来还需要进一步通过不同细胞系和体内研究,探究STAT3在小檗碱抑制骨肉瘤细胞增殖中的具体作用。
综上所述,小檗碱可诱导MG63 骨肉瘤细胞铁死亡,其作用机制可能是通过作用于STAT3/p53/SLC7A11信号通路实现的。
