1,8-桉叶油素对2型糖尿病胰岛β细胞铁死亡的干预作用及机制 Δ
2024-02-28任鹏艳陈永鑫姚喻霆甘诗泉陈婷婷沈祥春贵阳市妇幼保健院贵阳市儿童医院药学部贵阳55000贵州医科大学天然药物资源优效利用重点实验室贵阳56贵州医科大学药学院贵阳56
杨 红 ,任鹏艳 ,陈永鑫 ,姚喻霆 ,甘诗泉 ,刘 佳 陈婷婷 张 宝 沈祥春 ,李 悦 (.贵阳市妇幼保健院/贵阳市儿童医院药学部,贵阳 55000;2.贵州医科大学天然药物资源优效利用重点实验室,贵阳 56;.贵州医科大学药学院,贵阳 56)
糖尿病是严重威胁人类健康的疾病之一,在全球范围内发病率逐年上升,糖尿病及其并发症已成为21世纪全球医疗卫生的沉重负担,是目前亟待解决的重大科学及社会民生问题[1—2]。2 型糖尿病作为糖尿病两种表型之一,其发病涉及多种诱因,包括高血糖、胰岛素抵抗等,但其潜在的发病机制尚未充分阐明。很多2型糖尿病患者仍不可避免地患有微血管并发症(包括视网膜病变、肾病和神经病变)和大血管并发症(如心血管并发症)[3],这对2 型糖尿病患者的生存构成了严重威胁,给世界卫生系统带来巨大的挑战。
近年来研究表明,胰岛β细胞铁死亡是导致正常人糖代谢出现异常并进展为2型糖尿病的始动因素之一,也是2型糖尿病进展的关键环节,但其确切的发病机制尚未完全阐明[4]。铁死亡是一种铁依赖性的脂质过氧化物蓄积驱动的细胞程序性死亡,其特征在于细胞内铁的沉积以及脂质过氧化物的积累[5]。已有研究表明,抑制谷胱甘肽过氧化物酶4(glutathione peroxidase-4,GPX4)活性是诱导细胞铁死亡的关键环节,恢复GPX4 活性可明显抑制铁死亡的发生发展[6]。2 型糖尿病患者的高血糖环境可诱导胰岛β 细胞铁死亡的发生[7]。因此,探索GPX4在胰岛β细胞铁死亡过程中的具体调控作用及机制,对进一步阐明2型糖尿病的发病机制、寻求有效干预措施具有重要的社会意义。
民族药艳山姜为姜科山姜属艳山姜Alpiniazerumbet(Pers.) Burtt.et Smith的果实,具有温中燥湿、行气止痛的功效。挥发油作为艳山姜的主要活性成分,具有抗氧化[8]、改善糖尿病[9]等作用。其中,1,8-桉叶油素是艳山姜挥发油的主要效应成分。本课题组前期的研究显示,1,8-桉叶油素对高糖诱导的胰岛β 细胞凋亡具有显著的改善作用[10],但其对胰岛β 细胞铁死亡的作用及机制尚不明确。基于此,本研究探讨了1,8-桉叶油素对2型糖尿病诱导的胰岛β细胞铁死亡的干预作用及机制,旨在为治疗2型糖尿病的创新药物开发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Varioskan LUX型多功能酶标仪(美国Themo Fisher Scientific 公司),HF240 型二氧化碳培养箱(上海力申科学仪器有限公司),Chemi-DocTMXRS+型曝光仪(美国Bio-Rad 公司),Leica DMi8型荧光倒置显微镜(德国Leica公司)。
1.2 主要药品与试剂
1,8-桉叶油素(批号K1822141,纯度≥99%)购自上海阿拉丁生化科技股份有限公司;1640 基础培养基(批号8121324)购自美国Gibco 公司;D-无水葡萄糖、D-甘露醇(批号分别为405A0918、1126F038)均购自北京索莱宝科技有限公司;铁死亡诱导剂Erastin、铁死亡抑制剂Ferrostatin-1(批号分别为HY-15763、HY-100579)均购自美国MCE 公司;组织铁测定试剂盒(批号20230202)购自南京建成生物工程研究所有限公司;FerroOrange探针(批号F374)购自东仁化学科技(上海)有限公司;鼠源β-actin 单克隆抗体、鼠源环氧合酶2(cyclooxygenase-2,COX2)单克隆抗体、鼠源GPX4 单克隆抗体(批号分别为66009-1-Ig、66351-1-Ig、67763-1-Ig)均购自武汉三鹰生物技术有限公司;辣根过氧化物酶(HRP)标记的鼠免疫球蛋白G二抗(批号BS12478)购自美国Bioworld公司。
1.3 细胞
本研究所用细胞为小鼠胰岛β 细胞,购自美国ATCC细胞库。
1.4 动物
本研究所用动物为SPF级雄性C57BL/6小鼠,体重约18~22 g,6~8周龄,购自贵州医科大学动物中心,动物生产许可证号为SCXK(贵)2023-0002。小鼠于光照周期为12 h 的环境中饲养,日常自由进食和饮水,适应性喂养1周后开始实验。本实验经贵州医科大学实验动物伦理委员会批准,批准文号为2100421。
2 方法
2.1 细胞实验
2.1.1 胰岛β细胞中Fe2+水平的检测
将胰岛β 细胞接种于24 孔板,当细胞密度达70%时,分为正常对照组(只加细胞不加药)、甘露醇组(用该组作为模型组的渗透压对照,25 mmol/L)、模型组(D-无水葡萄糖,25 mmol/L)和1,8-桉叶油素低、高剂量组(0.25、0.5 μmol/L)以及维生素E 组(阳性对照组,1×10-7mmol/L),各给药组剂量参考本课题组的前期研究[10]。各组均先加入相应药物预处理1 h 后,再以25 mmol/L D-无水葡萄糖干预72 h。干预结束后,弃去上清液,用无血清培养基清洗细胞3次,然后加入终浓度为1 µmol/L 的荧光探针FerroOrange 工作液适量,再置于37 ℃培养箱中孵育30 min 后,采用荧光显微镜观察细胞,并采集图片,采用Image J 分析荧光强度,红色荧光越强表示Fe2+水平越高。实验重复3次。
2.1.2 胰岛β细胞中GPX4、COX2蛋白表达的检测
采用Western blot 法进行检测。将细胞分为正常对照组(只加细胞不加药)、模型组(D-无水葡萄糖,25 mmol/L)、1,8-桉叶油素组(0.5 μmol/L)、Erastin 组(20 μmol/L)、Ferrostatin-1 组(20 μmol/L)、1,8-桉叶油素+Erastin 组(0.5 μmol/L 1,8-桉叶油素+20 μmol/L Erastin)、1,8-桉叶油素+Ferrostatin-1 组(0.5 μmol/L 1,8-桉叶油素+20 μmol/L Ferrostatin-1),各给药组剂量参考本课题组的前期研究[10—11]。各组均先加入相应药物预处理1 h后,再以25 mmol/L D-无水葡萄糖干预72 h。收集细胞,提取总蛋白,采用BCA 蛋白定量法测定蛋白浓度,蛋白经煮沸变性后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和转膜,以5%牛血清白蛋白溶液封闭后,分别加入一抗(GPX4、COX2 的稀释度均为1∶2 000,β-actin 的稀释度为1∶10 000),于4 ℃孵育过夜;加入相应二抗(稀释度为1∶10 000),室温孵育2 h;洗膜后,以ECL 化学发光试剂进行显色,置于凝胶成像系统成像,再以Image-Lab 软件进行分析,以目的蛋白与β-actin 的灰度值比值表示目的蛋白的表达水平。
2.2 动物实验
2.2.1 分组、造模与给药
小鼠适应性饲养1 周后,随机选取20 只,分为正常对照组和1,8-桉叶油素毒性研究组(200 mg/kg),每组10 只,然后给予普通饲料饲养。另取40 只小鼠给予高糖高脂饲料饲养2个月,形成胰岛素抵抗后,采用小剂量多次注射的方式,对小鼠腹腔注射链脲佐菌素(35 mg/kg),隔天注射1次,一共注射4次。第4次注射结束1周后检测小鼠空腹血糖,当小鼠空腹血糖≥11.1 mmol/L时,表明2 型糖尿病模型小鼠造模成功[12]。将造模成功的小鼠随机分为模型组,1,8-桉叶油素低、高剂量组(50、200 mg/kg,剂量参考文献[13]设置)、维生素E 组(17.5 mg/kg,根据人与动物的等效剂量换算而得),每组10只。正常对照组和模型组小鼠灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,每天1次,连续8周。
2.2.2 小鼠空腹血糖检测及取材
末次给药后,小鼠禁食不禁水12 h后检测各组小鼠空腹血糖;然后处死小鼠,分离其胰腺组织,部分置于4%多聚甲醛溶液中固定,另一部分置于液氮中冻存备用。
2.2.3 小鼠胰腺组织病理形态学观察
取“2.2.2”项下固定于4%多聚甲醛的小鼠胰腺组织适量,经石蜡包埋、切片、梯度脱水等处理后,进行苏木精-伊红(HE)染色以及糖原沉积染色,采用显微镜进行观察,并拍照。
2.2.4 小鼠胰腺组织中铁含量的检测
取“2.2.2”项下冻存的小鼠胰腺组织(约10 mg),加入适量生理盐水置于冰上剪碎并匀浆,以2 500 r/min离心 10 min,取上清液,根据相应试剂盒说明书方法操作,检测小鼠胰腺组织中铁含量。
2.2.5 小鼠胰腺组织中GPX4、COX2蛋白表达的检测
采用Western blot 法进行检测。取“2.2.2”项下冻存的胰腺组织(约10 mg),添加预冷的蛋白裂解液(含1%PMSF)于冰上剪碎,裂解30 min,超声处理2 s×5次;于4 ℃条件下以12 000 r/min 离心20 min,取上清液,然后按“2.1.2”项下方法检测小鼠胰腺组织中GPX4、COX2蛋白表达水平。
2.3 统计学方法
采用GraphPad Prism 8.0 软件进行统计分析,数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t。检验水准α=0.05。
3 结果
3.1 细胞实验结果
3.1.1 1,8-桉叶油素对胰岛β细胞中Fe2+水平的影响
与正常对照组(21.12±3.60)比较,模型组(50.07±0.49)细胞中Fe2+水平显著升高(P<0.05),甘露醇组(24.43±2.92)细胞中Fe2+水平变化差异无统计学意义(P>0.05)。与模型组比较,1,8-桉叶油素低、高剂量组(分别为30.04±2.97、16.51±1.70)以及维生素E 组(22.56±3.52)细胞中Fe2+水平均显著降低(P<0.05)。结果见图1。
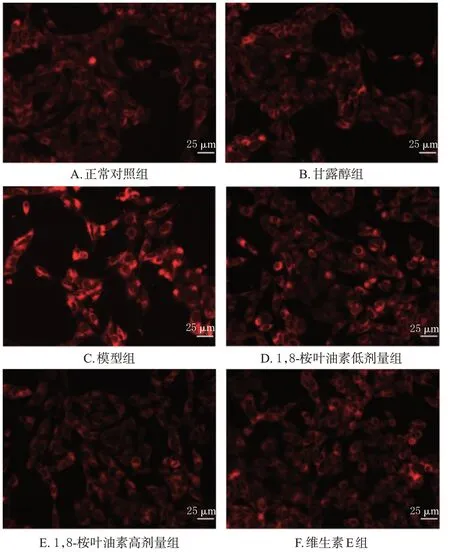
图1 各组胰岛β细胞中Fe2+的荧光显微图
3.1.2 1,8-桉叶油素对胰岛β细胞中GPX4、COX2蛋白表达的影响
与正常对照组比较,模型组胰岛β 细胞中GPX4 蛋白表达水平显著降低(P<0.05),COX2蛋白表达水平显著升高(P<0.05)。与模型组比较,1,8-桉叶油素组、Ferrostatin-1 组、1,8-桉叶油素+Ferrostatin-1 组胰岛β 细胞中上述两种蛋白表达水平均显著逆转(P<0.05);Erastin组、1,8-桉叶油素+Erastin组胰岛β细胞中上述两种蛋白表达水平差异无统计学意义。与1,8-桉叶油素组比较,1,8-桉叶油素+Erastin组胰岛β细胞中GPX4蛋白表达水平显著降低(P<0.05),COX2蛋白表达水平显著升高(P<0.05)。结果见图2、表1、表2。
表1 铁死亡诱导剂Erastin 对胰岛β 细胞中GPX4、COX2蛋白表达的影响(±s,n=3)
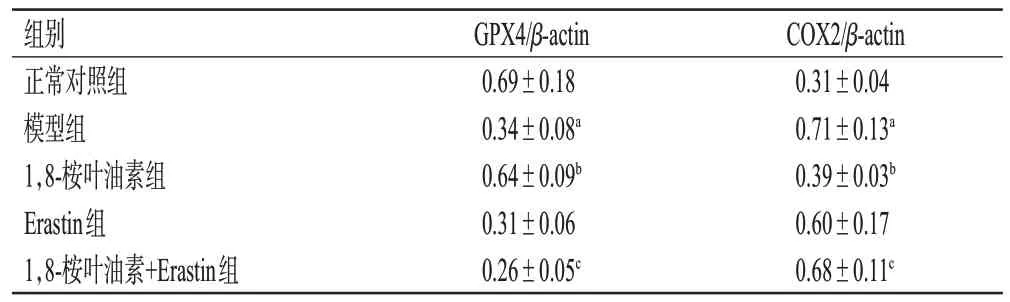
表1 铁死亡诱导剂Erastin 对胰岛β 细胞中GPX4、COX2蛋白表达的影响(±s,n=3)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与1,8-桉叶油素组比较,P<0.05。
COX2/β-actin 0.31±0.04 0.71±0.13a 0.39±0.03b 0.60±0.17 0.68±0.11c组别正常对照组模型组1,8-桉叶油素组Erastin组1,8-桉叶油素+Erastin组GPX4/β-actin 0.69±0.18 0.34±0.08a 0.64±0.09b 0.31±0.06 0.26±0.05c
表2 铁死亡抑制剂Ferrostatin-1 对胰岛β 细胞中GPX4、COX2蛋白表达的影响(±s,n=3)
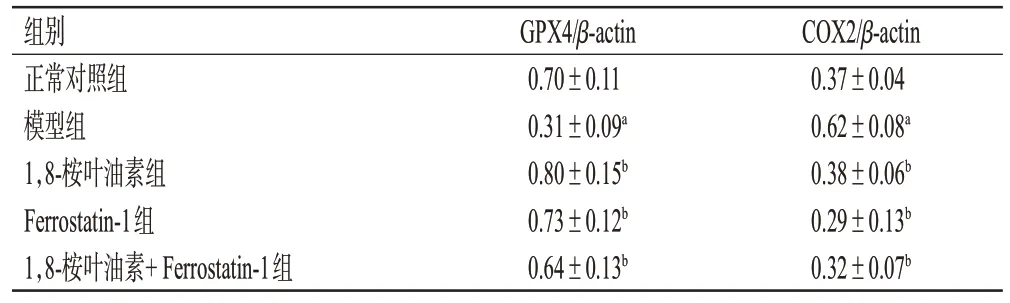
表2 铁死亡抑制剂Ferrostatin-1 对胰岛β 细胞中GPX4、COX2蛋白表达的影响(±s,n=3)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05。
组别正常对照组模型组1,8-桉叶油素组Ferrostatin-1组1,8-桉叶油素+ Ferrostatin-1组GPX4/β-actin 0.70±0.11 0.31±0.09a 0.80±0.15b 0.73±0.12b 0.64±0.13b COX2/β-actin 0.37±0.04 0.62±0.08a 0.38±0.06b 0.29±0.13b 0.32±0.07b
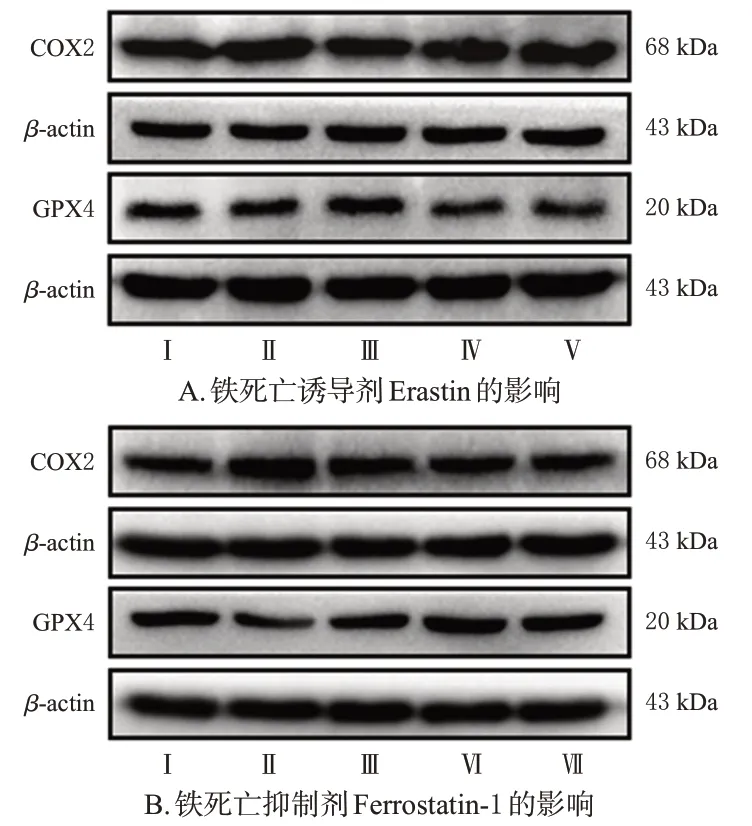
图2 各组胰岛β 细胞中GPX4、COX2 蛋白表达的电泳图
3.2 动物实验结果
3.2.1 1,8-桉叶油素对模型小鼠血糖及胰腺组织病理形态的影响
与正常对照组[(4.92±0.38) mmol/L]比较,模型组小鼠空腹血糖[(15.58±4.35) mmol/L]显著升高(P<0.05),1,8-桉叶油素毒性研究组小鼠空腹血糖[(5.38±0.84) mmol/L]差异无统计学意义(P>0.05)。与模型组比较,1,8-桉叶油素低、高剂量组[分别为(14.85±4.27)、(18.75±5.59) mmol/L]和维生素E 组[(17.75±2.58)mmol/L]小鼠空腹血糖差异无统计学意义(P>0.05)。HE 染色以及糖原染色结果显示,正常对照组和1,8-桉叶油素毒性研究组小鼠胰岛呈椭圆形,结构规整、边缘清晰、排列紧密,未发现病理变化;模型组小鼠胰岛结构不完整、边界模糊,内有空泡浸润,糖原沉积较多;1,8-桉叶油素各剂量组和维生素E 组小鼠胰岛组织结构相比模型组恢复完整,形态有所改善。结果见图3、图4。
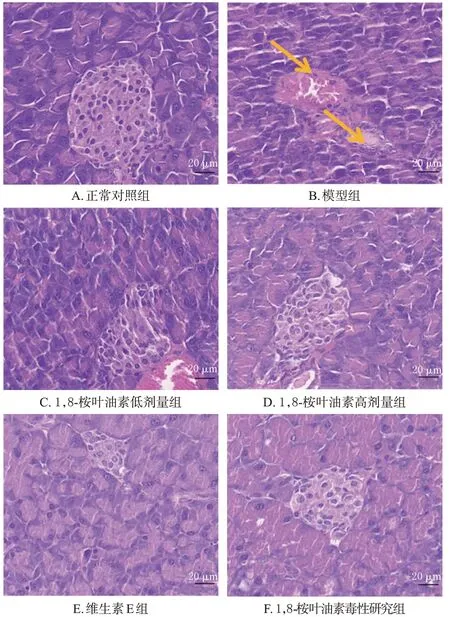
图3 各组小鼠胰腺组织HE染色显微图(HE染色)
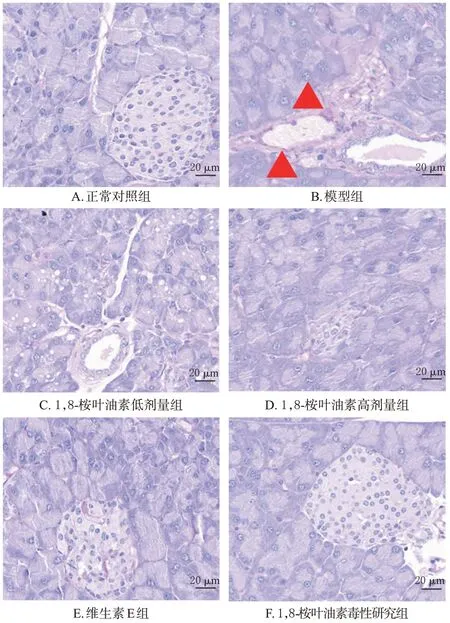
图4 各组小鼠胰腺组织糖原沉积染色显微图
3.2.2 1,8-桉叶油素对模型小鼠胰腺组织中铁含量的影响
与正常对照组[(13.97±4.85) μmol/mg pro]比较,模型组小鼠胰腺组织中铁含量[(26.04±4.83) μmol/mg pro]显著升高(P<0.05),1,8-桉叶油素毒性研究组小鼠胰腺组织中铁含量[(15.55±4.83) μmol/mg pro]差异无统计学意义(P>0.05)。与模型组比较,1,8-桉叶油素低、高剂量组[分别为(15.78±2.62)、(16.50±5.4) μmol/mg pro]和维生素E 组[(14.56±2.78) μmol/mg pro]小鼠胰腺组织中铁含量均显著降低(P<0.05)。
3.2.3 1,8-桉叶油素对模型小鼠胰腺组织中GPX4、COX2蛋白表达的影响
与正常对照组比较,模型组小鼠胰腺组织中GPX4蛋白表达水平显著降低(P<0.05),COX2蛋白表达水平显著升高(P<0.05);1,8-桉叶油素毒性研究组小鼠胰腺组织中上述蛋白表达水平差异无统计学意义(P>0.05)。与模型组比较,1,8-桉叶油素高剂量组和维生素E 组小鼠胰腺组织中上述蛋白表达水平均显著逆转(P<0.05)。结果见图5、表3。
表3 各组小鼠胰腺组织中GPX4、COX2蛋白表达水平的检测结果(±s,n=10)
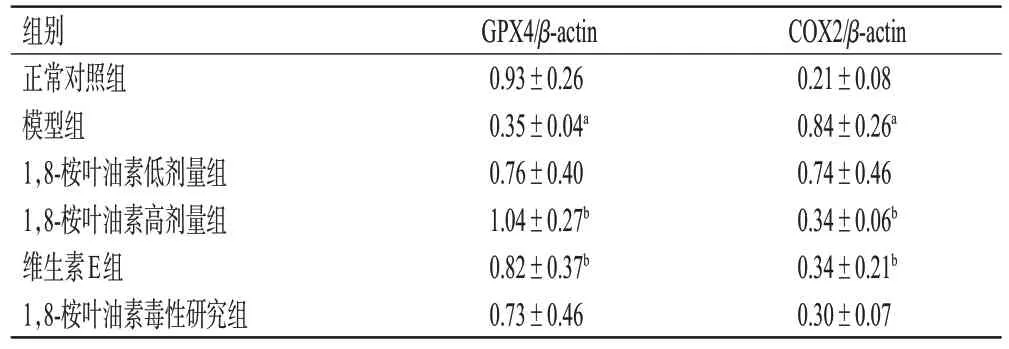
表3 各组小鼠胰腺组织中GPX4、COX2蛋白表达水平的检测结果(±s,n=10)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05。
组别正常对照组模型组1,8-桉叶油素低剂量组1,8-桉叶油素高剂量组维生素E组1,8-桉叶油素毒性研究组GPX4/β-actin 0.93±0.26 0.35±0.04a 0.76±0.40 1.04±0.27b 0.82±0.37b 0.73±0.46 COX2/β-actin 0.21±0.08 0.84±0.26a 0.74±0.46 0.34±0.06b 0.34±0.21b 0.30±0.07
4 讨论
铁死亡是一种铁依赖的脂质过氧化物累积引起的细胞程序性死亡,胰岛β 细胞铁死亡是2 型糖尿病发生发展的病理基础与恶化的始动环节[14]。保护胰岛β细胞免于损伤、恢复胰岛功能是预防与治疗2型糖尿病的关键[15]。研究显示,COX2 的过表达是铁死亡的标志[16]。GPX4 是主要的膜脂修复酶,也是铁死亡的重要负调控因子,其活性降低,可造成膜脂上活性氧的积累,驱使脂质过氧化终产物丙二醛与蛋白质和DNA 形成复合物,进一步诱导细胞铁死亡的发生[17]。本研究细胞实验结果显示,高糖环境可诱导胰岛β细胞中Fe2+水平增加,铁死亡相关蛋白GPX4 蛋白表达下调,COX2 蛋白表达上调;同样的,动物实验结果显示,模型组小鼠胰岛结构不完整,且糖原沉积较多,胰腺组织中铁含量增加,GPX4蛋白表达下调,COX2 蛋白表达上调。经1,8-桉叶油素干预后,胰岛β细胞以及小鼠胰腺组织中上述指标均有所改善,这提示1,8-桉叶油素对2 型糖尿病诱导的胰岛β细胞铁死亡具有明显的改善作用。
本研究采用铁死亡诱导剂Erastin 及铁死亡抑制剂Ferrostatin-1 进一步验证了1,8-桉叶油素对2 型糖尿病胰岛β 细胞铁死亡的抑制作用机制。结果显示,Erastin与1,8-桉叶油素联合作用胰岛β细胞后,可抑制1,8-桉叶油素的作用;相反,Ferrostatin-1 单独使用或与1,8-桉叶油素联合作用后,均能显著抑制高糖环境诱导的胰岛β 细胞铁死亡。这提示,1,8-桉叶油素可能是通过抑制铁死亡信号改善2型糖尿病诱导的胰岛β细胞损伤。
综上所述,1,8-桉叶油素对2 型糖尿病胰岛β 细胞损伤具有明显的改善作用,其作用机制可能与降低细胞内铁沉积以及调控铁死亡相关蛋白有关。
