UPLC-MS/MS法测定22种农产品中杀螺胺乙醇胺盐残留
2024-02-27蒋舒帆张新忠韩丙军
蒋舒帆,何 燕,李 备,张新忠,韩丙军*
(1.天津农学院 园艺园林学院,天津 300392;2.中国热带农业科学院分析测试中心 农业农村部亚热带果品蔬菜质量安全控制重点实验室 海南省热带果蔬产品质量安全重点实验室,海南 海口 571101;3.中国农业科学院茶叶研究所,浙江 杭州 310008;4.海南省食品检验检测中心 国家市场监管重点实验室(热带果蔬质量与安全),海南 海口 570311)
杀螺胺乙醇胺盐(Niclosamide-olamine)是一种酰胺类化合物,是世界卫生组织唯一推荐使用的杀螺药物,可有效阻止钉螺对氧的摄入从而减弱其呼吸作用,降低螺体内多种酶的活性,使其各项生理功能紊乱和丧失,最终导致钉螺死亡[1-3]。我国《食品安全国家标准 食品中农药最大残留限量》(GB 2763-2021)将杀螺胺乙醇胺盐的残留标示物定义为杀螺胺[4]。杀螺胺(Niclosamide)又名氯硝柳胺,是由5-氯水杨酸和邻氯对硝基苯胺通过酰胺键结合而成的化合物,难溶于水。为增加其在水中的溶解度,提高灭螺效果,生产中通常将氯硝柳胺和极性较大的乙醇胺反应形成杀螺胺乙醇胺盐[5]。
杀螺胺乙醇胺盐在基质中可能以杀螺胺和乙醇胺离子共轭的形式存在(图1A)。近年来,杀螺胺乙醇胺盐广泛作为除光剂、杀螺剂和农药用于农业生产中,还可与饲料混合使用,控制白蚁的侵扰[6]、治疗鱼类寄生虫病[7-8],控制蛞蝓和蜗牛等软体动物种群[9],其在各类农产品中残留容易影响人体食用健康,因此开展不同农产品中杀螺胺乙醇胺盐的残留分析具有重要意义。目前,杀螺胺乙醇胺盐的检测方法主要有滴定法[10]、紫外-可见分光光度法[11-12]、液相色谱法(HPLC)[13-15]、超高效液相色谱-质谱联用法(UPLC-MS/MS)等[16-17]。其中,UPLC-MS/MS 的检测灵敏度远高于其它3 种方法,在土壤[18]、水样[19]等复杂环境样品中杀螺胺乙醇胺盐的检测中得到良好应用。而在农产品中,由于不同基质之间差异较大,缺乏较完善的提取检测方法,例如茶叶基质成分复杂,含有丰富的咖啡碱、色素和多酚,前处理相对复杂[20],且高含水量、高含油或粉末样品基质各不相同,目前关于不同农产品中杀螺胺乙醇胺盐残留的系统分析方法尚未见报道。
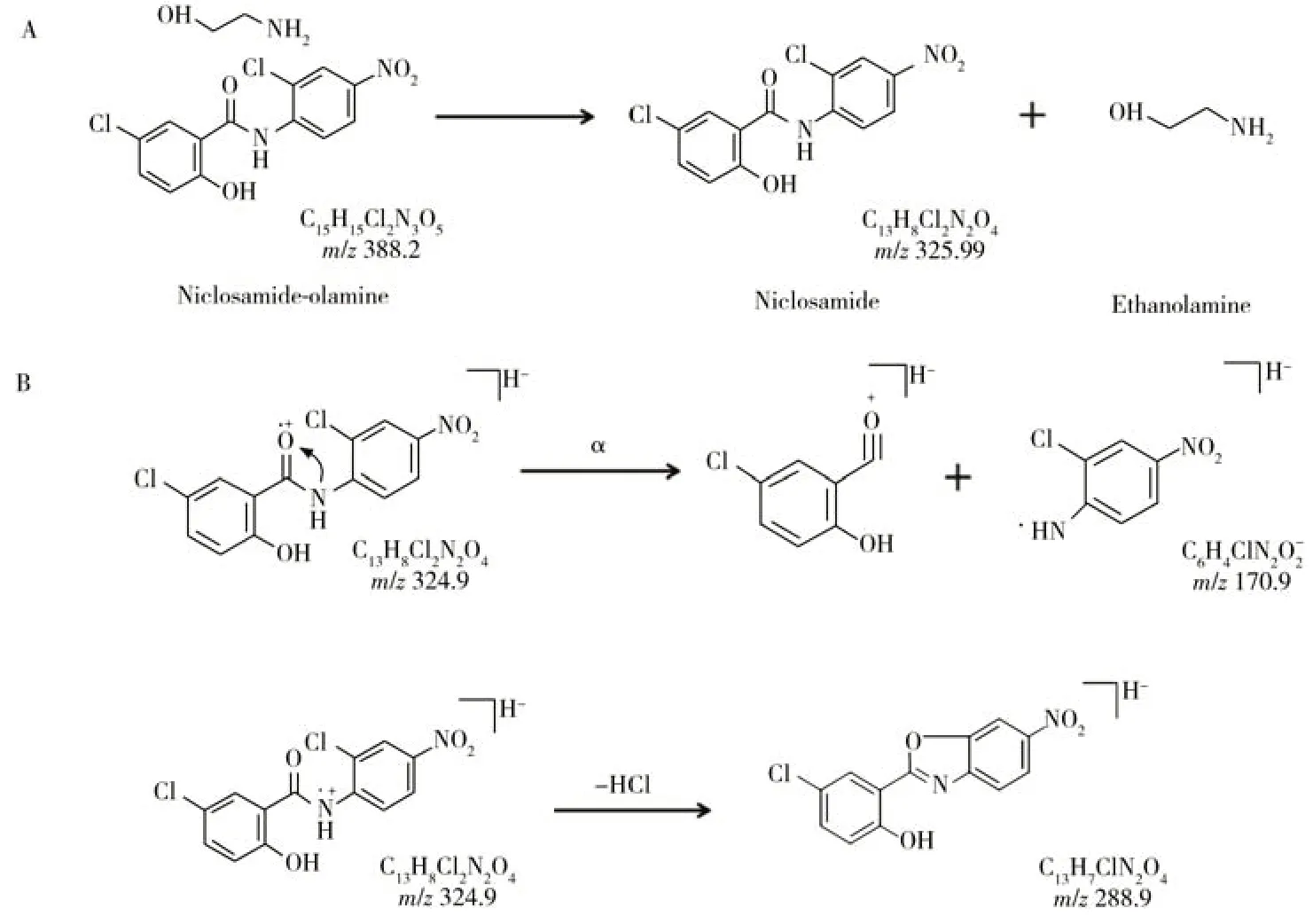
图1 杀螺胺乙醇胺盐的结构式(A)及可能的裂解途径(B)Fig.1 Structural formula(A) and possible cleavage pathway(B) of niclosamide-olamine
本研究通过对前处理方法和质谱条件进行优化,采用改进的QuEChERS 方法结合UPLC-MS/MS 建立了10大类共22种农产品中杀螺胺乙醇胺盐残留的分析方法。所建方法成功用于实际样品分析中,可为农产品中杀螺胺乙醇胺盐的残留分析提供支撑。
1 实验部分
1.1 仪器、试剂与材料
超高效液相色谱-串联质谱仪(UPLC-MS/MS),Waters 超高压液相色谱系统和AB SCIEX API4500+质谱系统;离心机(上海安亭科学仪器厂);超纯水仪(美国Millipore公司);涡旋振荡器(上海沪析实业有限公司)。
杀螺胺标准品(Dr. Ehrenstorfer GmbH,纯度97.1%,CAS 为50-65-7);杀螺胺乙醇胺盐标准品(TMstandard,纯度99.3%,CAS 为1420-04-8);甲酸(赛默飞世尔科技有限公司,99.9%);甲醇、乙腈(赛默飞世尔科技有限公司,色谱纯);弗罗里硅土(40~60 μm,上海安谱科学仪器有限公司);氯化钠(广州化学试剂厂,分析纯,99.5%);冰醋酸(广州化学试剂厂,分析纯,99.8%);GCB 吸附剂(乙二胺-N-丙基硅烷,粒径40~60 μm,ANPEL 仪器(上海)有限公司);C18吸附剂(50~120 μm,珠海艾谱瑞生物医药有限公司)。
1.2 试样制备
市场采购10 大类共22 种样品基质为试材。其中,谷物3 种(包括糙米、小麦和玉米);油料作物1种(花生);蔬菜8种(包括甘蓝、芹菜、番茄、茄子、马铃薯、胡萝卜、菜豆、韭菜);水果4种(包括苹果、桃、葡萄、柑橘);坚果1 种(核桃);食用菌1 种(平菇);植物油1 种(菜籽油);茶叶1 种(绿茶);香辛料1种(胡椒);糖料作物1种(甘蔗)。
按照GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》中附录A食品类别及测定部位的规定要求,本研究中花生和核桃去除壳,芹菜去除根,番茄、茄子、苹果、葡萄、柑橘去除柄,胡萝卜去除顶部叶及叶柄,桃去除柄和果核,甘蔗去除顶部叶及叶柄后测定,菜豆带荚测定,其余样品均整株测定。将22种基质的试样分别进行筛选和分装,其中固体样品加入干冰(1∶1)进行粉碎,液体样品直接分装,装入干净的袋子做好标签,并在-20℃下冷藏备用。
1.3 标准溶液的配制
准确称取0.010 0 g 杀螺胺乙醇胺盐标准品置于50 mL 容量瓶中,用甲醇溶解并定容,配制成质量浓度约200 mg/L的标准储备溶液。取上述标准储备溶液,用甲醇逐级稀释,配制10 mg/L和1 mg/L的混合标准中间溶液。将标准中间溶液用基质空白样品溶液稀释成质量浓度分别为0.001、0.002、0.005、0.02、0.05、0.1 mg/L 的系列基质匹配标准溶液,按参考色谱和质谱条件测定。以杀螺胺乙醇胺盐的质量浓度为横坐标,峰面积积分值为纵坐标,绘制标准曲线。基质匹配标准溶液应现配现用。
1.4 样品前处理
1.4.1 蔬菜、水果、食用菌及植物油称取10 g(精确至0.01 g)试样于50 mL 离心管中,加入20 mL 1%甲酸乙腈溶液,涡旋振荡5 min 后,加入5~7 g 氯化钠,涡旋振荡2 min,以8 000 r/min 离心5 min。取上层清液,待净化。
1.4.2 谷物、油料、坚果、香辛料及糖料称取5 g(精确至0.01 g)试样于50 mL 离心管中,加5 mL水润湿,静置30 min。加入10 mL 1%甲酸乙腈溶液,涡旋振荡5 min 后,加入5~7 g氯化钠,涡旋振荡2 min,以8 000 r/min离心5 min。取上层清液,待净化。玉米和小麦样品加入10 mL水润湿。
1.4.3 茶 叶称取2 g(精确至0.01 g)试样于50 mL 离心管中,加入5 mL 水润湿,静置30 min。加入10 mL 1%甲酸乙腈溶液,涡旋振荡5 min 后,加入5 ~7 g 氯化钠,涡旋振荡2 min,以8 000 r/min 离心5 min。取上层清液,待净化。
1.5 净化与水解
分取上层清液5 mL,加入150 mg 弗罗里硅土,涡旋振荡2 min 后,以8 000 r/min 离心5 min。取上层清液经0.22 μm微孔滤膜过滤后,供测定。
1.6 仪器分析条件
1.6.1 色谱条件色谱柱:C18柱(50 mm×2.1 mm,粒径1.7 μm);流动相:A为0.1%甲酸水,B为乙腈。梯度洗脱程序为:0.0~1.5 min,5% B;1.5~3.5 min,5% ~95% B;3.5~5 min,95% ~5% B;流速:0.25 mL/min;柱温:30 ℃;进样体积:10 μL。
1.6.2 质谱条件电喷雾离子源;负离子电离扫描;喷雾电压为-4 500 V;离子源温度为600 ℃;碰撞气(N2);气帘气压力为70 kPa,雾化气压力为350 kPa,辅助加热气压力为350 kPa;多反应监测模式(MRM)。杀螺胺乙醇胺盐的保留时间为2.24 min,母离子为m/z324.9,子离子为m/z170.9(定量离子)和m/z288.9(定性离子),碰撞能量分别为-37、-24 eV。
2 结果与讨论
2.1 质谱条件的优化
配制0.5 mg/L 的杀螺胺乙醇胺盐标准溶液,使用针泵持续直接进样的方式,对杀螺胺乙醇胺盐的质谱参数进行优化。分别在Q1MS、MS/MS模式下采集杀螺胺乙醇胺盐的母离子和子离子参数,再经基质匹配标准溶液考查,确定其定量和定性离子对。电喷雾电离时,在一级质谱中,杀螺胺乙醇胺盐产生稳定的[M-H]-离子,失去1 个电子生成分子离子峰m/z324.9。图1B 列出了杀螺胺乙醇胺盐母离子可能的质谱裂解途径及产生的二级质谱碎片离子,酰胺是蛋白质及多肽的基本组成单元,当R 小于4个碳时,在氧原子上的游离基中心诱导下,发生酰胺键断裂(α断裂),生成酰基离子C6H4ClN2O2-(m/z170.9)。另一方面,在氮原子上的游离基中心诱导下,可发生α断裂,再发生氢重排,失去中性分子HCl,形成碎片离子C13H7ClN2O4(m/z288.9)。经离子对考查,杀螺胺乙醇胺盐采用负离子源检测模式,选择[M-H]-作为母离子,m/z为324.9。进一步优化去簇电压后,对母离子碎片进行二级质谱分析,得到二级质谱碎片的全谱信息,并对碰撞能量进行优化,建立MRM采集模式。在最佳条件下,目标化合物能够进行定性与定量检测。
离子源温度对部分农药的离子化效率影响很大,不同离子源温度下的响应相差几倍甚至几十倍。因此对离子源参数进行优化,分别考察了不同温度(400、500、600、700 ℃)对杀螺胺乙醇胺盐峰面积的影响。结果显示,低温时杀螺胺乙醇胺盐的离子化程度较小,对峰面积的影响较大;600 ℃下其峰面积最大且较稳定,因此选择离子源温度为600 ℃,可保证结果的灵敏度和稳定性。
2.2 色谱条件的优化
在1 000 mL 超纯水中加入1 mL 甲酸,配制成0.1%的甲酸水溶液。分别以0.1%甲酸水-乙腈、0.1%甲酸水-甲醇为流动相,对比了杀螺胺乙醇胺盐在不同流动相下的出峰时间和峰面积。结果表明,以乙腈与0.1%甲酸水为流动相梯度洗脱时,杀螺胺乙醇胺盐与杂质的分离明显,峰面积信号响应较高,0.005 mg/L杀螺胺乙醇胺盐的峰面积达到4.0×106mAU,因此选择乙腈和0.1%甲酸水作为流动相。在最佳色谱和质谱条件下,杀螺胺乙醇胺盐22种基质标准溶液的色谱图见图2。
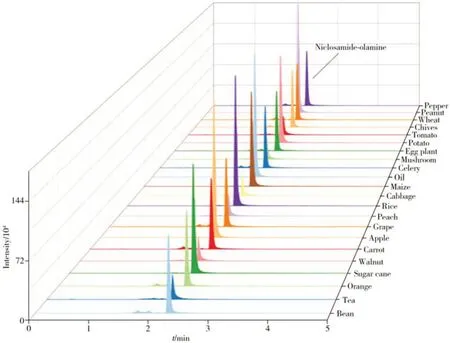
图2 杀螺胺乙醇胺盐22种基质标准溶液的色谱图(0.005 mg/L)Fig.2 Chromatograms of 22 kinds of food matrix standard solutions of niclosamide-olamine(0.005 mg/L)
2.3 前处理条件的优化
2.3.1 提取溶剂的优化以回收率为指标,对比了4种提取溶剂(甲醇、乙腈、1%甲酸甲醇、1%甲酸乙腈)对不同样品中杀螺胺乙醇胺盐的提取效果。如图3A所示,由于杀螺胺乙醇胺盐易溶于有机溶剂,在酸化乙腈条件下的回收率较好,以甲醇、乙腈、酸化甲醇为提取溶剂时的回收率均不理想。为达到更好的回收效果,考察了在乙腈溶液中分别加入0.1%、1%、5%甲酸时的回收率,如图3B 所示,加入1%甲酸后杀螺胺乙醇胺盐的回收率进一步升高,因此最终采用1%甲酸乙腈作为提取溶剂。

图3 不同提取溶剂(A)与不同酸化程度提取剂(B)对杀螺胺乙醇胺盐回收率的影响Fig.3 Effects of different extraction solvents(A) and extractants with different acidification degree(B) on recoveries of niclosamide-olamine
2.3.2 净化剂的优化目前农药残留分析的净化方法主要是固相萃取柱和QuEChERS 法,其中固相萃取柱操作较复杂,且对于复杂基质的回收率不易满足要求。本研究利用改进的QuEChERS 方法进行净化处理,发挥其快速、简捷、准确等优势。对比了C18、GCB(石墨化碳黑)、弗罗里硅土作为净化剂对样品的净化效果。如图4所示,在相同条件下,采用上述3种净化剂的回收率均能满足要求,其中弗罗里硅土的净化效果更好、回收率高且成本更低,综合考虑,最终选择弗罗里硅土作为净化剂。
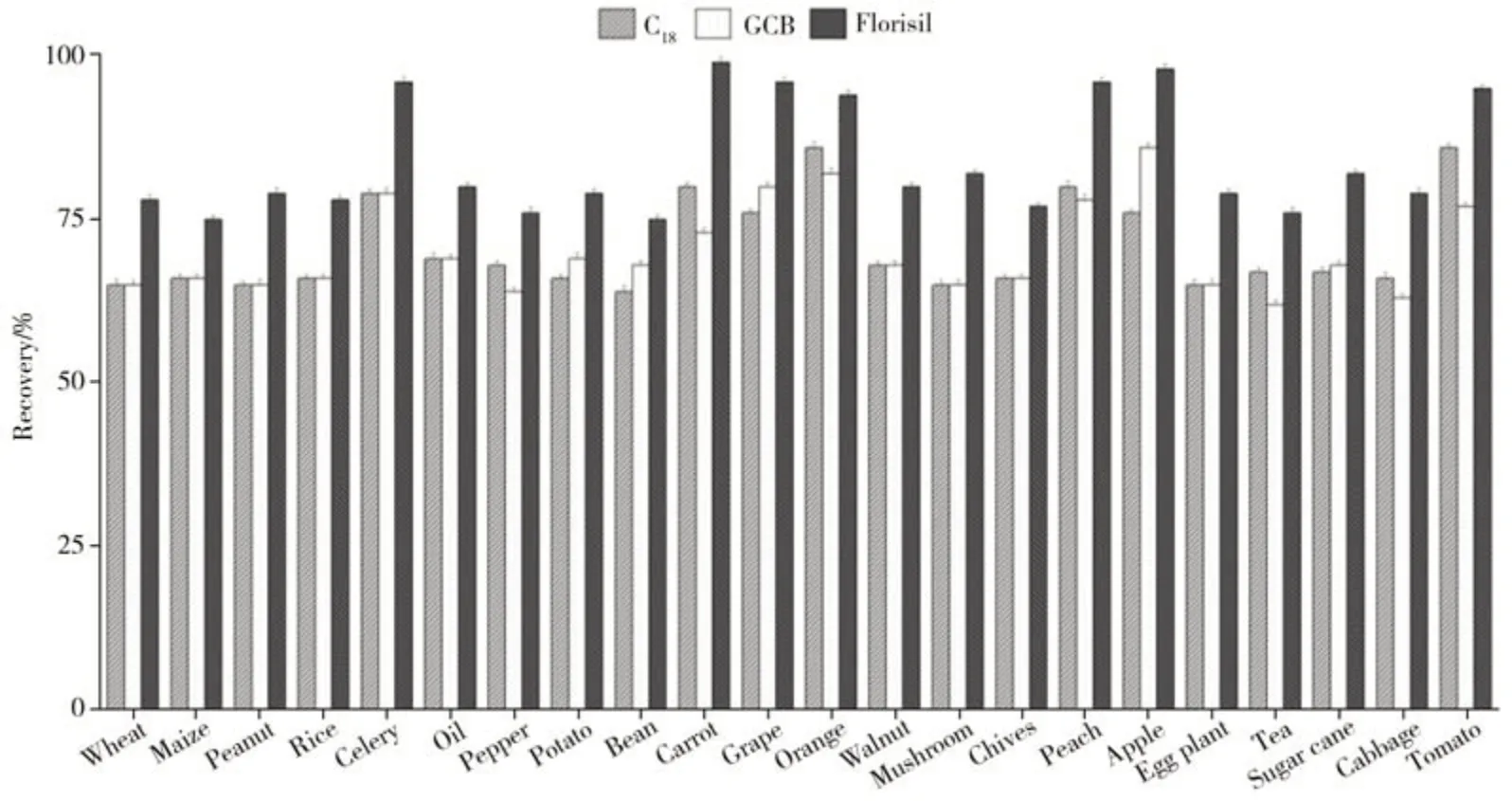
图4 不同净化剂对杀螺胺乙醇胺盐净化效果的影响Fig.4 Effects of different purificants for niclosamide-olamine
2.4 基质效应
液相色谱-串联质谱法测定农药残留易受基质效应(ME)的影响,本研究采用下式计算样品的基质效应:ME=(基质匹配标准曲线斜率/溶剂标准曲线斜率-1)×100%。当ME 值为正值,表示呈基质增强作用,负值则表示呈基质抑制作用。若|ME|≤20%,表示基质效应不显著,可忽略;若20%<|ME|≤50%或|ME|>50%,则表示存在中等或较强的基质效应。本研究中,小麦、柑橘、平菇和桃子无显著的基质效应,马铃薯、菜豆和胡萝卜存在中等基质效应,其它基质均存在较强的基质抑制或增强效应(表1)。因此,本方法采用基质匹配标准曲线进行定量测定,保证方法的准确性。
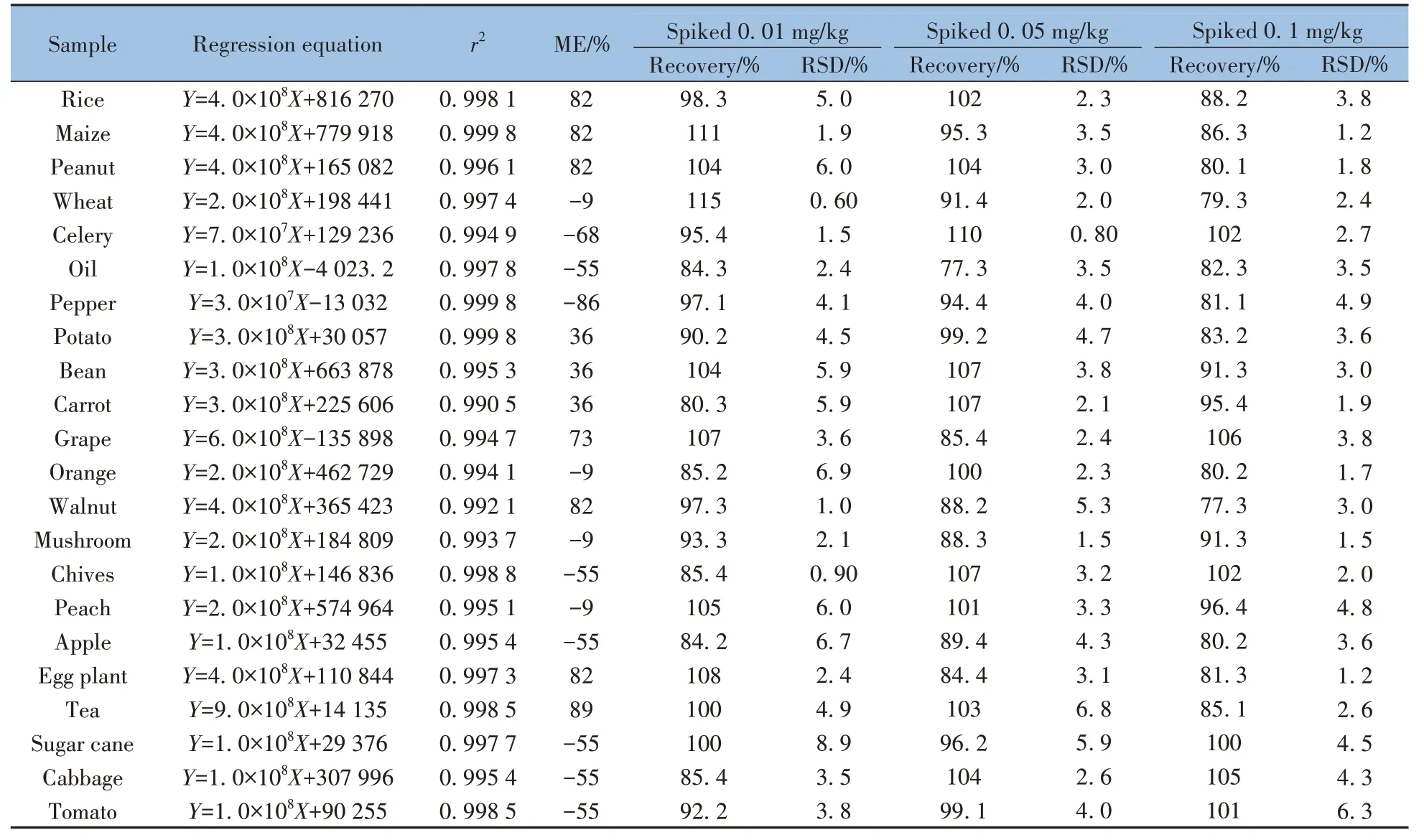
表1 不同样品基质中杀螺胺乙醇胺盐的线性关系、基质效应、回收率及相对标准偏差(n=5)Table 1 Linear relations,matrix effects,spiked recoveries and relative standard deviations of niclosamide-olamine in different sample matrixes(n=5)
2.5 线性关系、检出限与定量下限
在0.005~0.10 μg/mL范围内,以标准溶液的质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线。结果显示,标样溶液和基质标准溶液均呈现良好的线性关系,相关系数(r2)均大于0.99(见表1)。以定量离子响应的3倍信噪比(S/N=3)确定检出限,以定量离子响应的10倍信噪比(S/N=10)确定定量下限,得到杀螺胺乙醇胺盐在茶叶中的检出限为0.003 mg/kg,定量下限为0.01 mg/kg,在其它基质中的检出限为0.002 mg/kg,定量下限为0.005 mg/kg。我国GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》中规定杀螺胺乙醇胺盐在稻谷、糙米和普通白菜中的最大残留限量分别为2、0.5、2 mg/kg,美国、欧盟和日本等国家尚未制定其残留限量,本方法可满足相关限量分析的需求。
2.6 回收率与相对标准偏差
在空白基质样品中分别进行0.01、0.05、0.1 mg/kg 3 个水平的加标回收实验,重复处理5 次,测定回收率。由表1 可知,22 种基质中杀螺胺乙醇胺盐的加标回收率为77.3%~115%,相对标准偏差(RSD,n=5)小于10%,结果均满足NY/T 788-2018《农作物中农药残留试验准则》[21]的质控要求。杀螺胺乙醇胺盐在糙米基质空白、加标样品和基质标准溶液中的典型色谱图见图5。
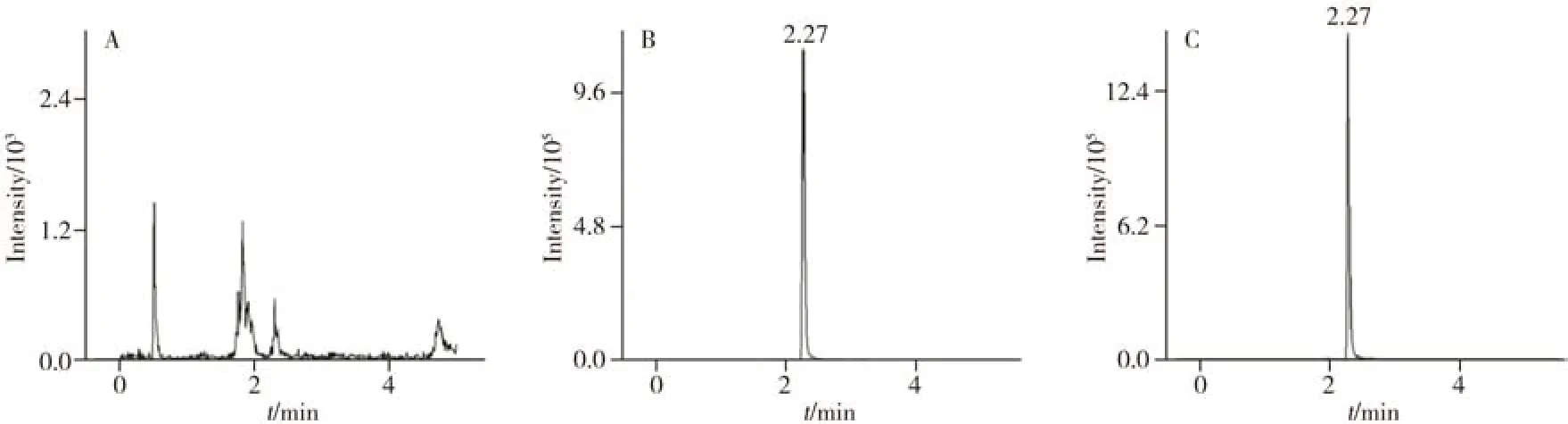
图5 杀螺胺乙醇胺盐的典型色谱图Fig.5 Typical chromatograms of niclosamide-olamine
2.7 实际样品测定
为验证方法的准确性和适用性,将该方法应用于水生蔬菜和陆生作物的样品分析。在海南省海口市农贸市场采集糙米、小麦、玉米、桃子等陆生作物样品66个,从田间种植地采集水生蔬菜茭白、水芹、豆瓣菜等样品15 个。结果在陆生作物样品中未发现杀螺胺乙醇胺盐残留,在水生蔬菜豆瓣菜的2个样品中检出杀螺胺乙醇胺盐,残留量分别为0.028 mg/kg 和0.035 mg/kg,其余样品均未检出。本方法对农产品中杀螺胺乙醇胺盐残留分析具有良好的适用性。
3 结 论
本文通过改进QuEChERS 前处理方法,建立了22 种农产品中杀螺胺乙醇胺盐的超高效液相色谱-串联质谱检测方法。该方法简单快速,耗时较短,适用于多种样品基质,回收率较好,能够满足各类农产品中杀螺胺乙醇胺盐残留的分析需求,具有广泛的适用性。
