QuEChERS/超高效液相色谱-串联质谱法同时测定大米中16种香豆素和香兰素及其衍生物
2024-02-27尹芳平陈娅娅
邓 楠,尹芳平,刘 川,汪 辉,2*,向 芬,陈娅娅
(1.长沙市食品药品检验所,湖南 长沙 410036;2.国家酒类产品质量检验检测中心(湖南),湖南 长沙 410036;3.张家界市高级技工学校,湖南 张家界 427000)
大米是中国人饮食结构中必不可缺的食材,其质量安全关乎人民的身体健康。2023 年“315”曝光的“香精大米”事件备受关注,一些不法企业通过向普通大米中添加香精的方式,使其带有“香气”,并包装成“泰国香米”售卖,以谋取高额利润。香豆素和香兰素及其衍生物常作为增香剂被非法添加在大米中,长期食用这种大米会对人体健康产生危害[1]。
香豆素和香兰素及其衍生物能散发出独特的香味[2],因此被广泛应用于食品[3]、医药[4]、化妆品[5]和烟草行业[6]的增香领域。现有研究表明,香豆素和香兰素类化合物具有一定的生理毒性,过量摄入会导致饮食失调、头晕恶心,甚至会对肝肾等器官造成损伤[7-8]。我国现行的食品添加剂使用标准GB 2760-2014[9]规定,香兰素和乙基香兰素被允许添加在较大婴儿及幼儿配方食品中,其中香兰素的最大使用量为7 mg/100 g,而在香豆素类合成衍生物中,只有二氢香豆素、6-甲基香豆素和八氢香豆素被允许添加在食品中,且大米中不得添加任何食品用香料、香精。
为加强大米质量的监督监管,保障消费者的权益和身体健康,研究大米中香豆素和香兰素及其衍生物的高通量检测方法十分必要。目前检测香豆素和香兰素及其衍生物主要采用气相色谱法[10]、高效液相色谱法[11]、红外光谱法[12]、气相色谱-质谱联用法[13]和液相色谱-串联质谱法[14-15]等,上述检测方法较为分散,覆盖不全,检测组分少,且操作繁琐。与传统的检测方法相比,高效液相色谱-串联质谱技术可将液相色谱的高效分离能力和质谱的高灵敏度结合,其多反应监测模式可以避免重叠峰引起的干扰[16],具有定性准确、灵敏度高、分析速度快和准确度高等特点,是目前食品中非法添加香精的主流检测手段。QuEChERS 法作为一种广泛应用于食品检测净化过程中的前处理技术,利用基质分散萃取机理,将吸附剂填料与干扰物结合并通过相互作用去除杂质干扰,从而达到除杂净化的目的[17-18]。其操作简单快捷,可保护仪器免受污染。本研究采用QuEChERS 结合超高效液相色谱-串联质谱(UPLC-MS/MS)技术,建立了大米中16 种香豆素和香兰素及其衍生物的测定方法,同时采用同位素内标对检测结果进行校准,有效减轻了基质效应对检测结果的影响[19]。该法简便高效,能实现大批量样品的快速检测,提高检测效率,可为大米中非法添加香精的监管提供技术支撑。
1 实验部分
1.1 材料与试剂
甲醇、乙腈(色谱纯,德国默克公司);氨水(HPLC 级,天津市光复科技发展有限公司);甲酸(HPLC 级,天津市化学试剂研究所有限公司);甲酸铵(LC-MS 级,赛默飞世尔科技(中国)有限公司);无水MgSO4(分析纯,国药集团化学试剂有限公司);十八烷基硅烷(C18,40~63 μm)和N-丙基乙二胺(PSA,40~63 μm)购于上海安谱科学仪器有限公司。
标准物质:7-甲基香豆素、香豆素、香兰素、甲基香兰素、乙基香兰素、二氢香豆素、7-乙氧基-4-甲基香豆素(纯度≥99%,北京曼哈格生物科技有限公司);环香豆素、7-甲氧基香豆素、3,3-羰基双(7-二乙胺香豆素)(纯度≥97%,上海安谱璀世标准技术服务有限公司);八氢香豆素(纯度99.9%,上海毕得医药科技股份有限公司);6-甲基香豆素、双香豆素、羟甲香豆素(纯度≥99.9%,中国食品药品检定研究院);苯丙香豆素、醋硝香豆素(纯度≥96.0%,加拿大TRC公司);4种香兰素和香豆素内标混标(100 mg/L,上海安谱璀世标准技术服务有限公司)。
大米样品:52批次监督抽查样品,样品涉及餐饮、流通、委托检验和监督检验等多个环节。
1.2 仪器与设备
AB Triple Quad 5500+液相色谱-质谱联用仪(AB SCIEX 公司);AS3120 超声波清洗器(天津奥特赛恩斯仪器有限公司);氮吹仪-34 位(N-EVAP116 型,Organomation Associates Inc.);SK-1 型快速混匀器(江苏金坛医疗仪器厂);数显型多管式旋涡混合器(EOFO 型,Talboys 公司),X1R-高速离心机(赛默飞世尔科技有限公司);超纯水仪(法国默克密理博公司);XS205DU 型十万分之一电子天平(梅特勒托利多科技(上海)有限公司);有机针头式过滤器(0.22 μm)。
1.3 实验方法
1.3.1 标准溶液配制称取适量香豆素及香兰素标准品10 mg,置于10 mL 棕色容量瓶中,用乙腈溶解定容(其中双香豆素先用二氯甲烷溶解),分别配制成质量浓度为1.0 g/L的香豆素和香兰素及其衍生物的标准储备溶液,-18 ℃避光保存。
准确吸取4 种香兰素和香豆素混合内标溶液,用乙腈配制成D4-香豆素、D3-香兰素、D3-甲基香兰素、D5-乙基香兰素质量浓度均为10 mg/L 的混合内标标准溶液。取适量标准储备溶液用乙腈稀释,配制成环香豆素、3’3-羰基双(7-二乙胺香豆素)、7-乙氧基-4-甲基香豆素、苯丙香豆素、醋硝香豆素质量浓度为0.2 mg/L,7-甲基香豆素、7-甲氧基香豆素、6-甲基香豆素、双香豆素质量浓度为0.4 mg/L,羟甲香豆素质量浓度为0.8 mg/L,八氢香豆素、香豆素、香兰素、甲基香兰素、乙基香兰素质量浓度为2.0 mg/L,二氢香豆素质量浓度为30.0 mg/L的混合标准中间液,-18 ℃避光保存。
取适量标准中间液用空白基质溶液稀释成环香豆素、3,3’-羰基双(7-二乙胺香豆素)、7-乙氧基-4-甲基香豆素、苯丙香豆素、醋硝香豆素的质量浓度分别为1、5、10、25、50、75 μg/L,7-甲基香豆素、7-甲氧基香豆素、6-甲基香豆素、双香豆素的质量浓度分别为2、10、20、50、100、150 μg/L,羟甲香豆素的质量浓度分别为4、20、40、100、200、300 μg/L,八氢香豆素、香豆素、香兰素、甲基香兰素、乙基香兰素的质量浓度分别为10、50、100、25、500、750 μg/L,二氢香豆素的质量浓度分别为150、300、750、1 500、3 000、6 000 μg/L的混合标准工作液,其中内标溶液为50 μg/L,现配现用。
1.3.2 样品前处理称取大米样品5.0 g(精确至0.001 g)于50 mL具塞离心管中,加入100 μL质量浓度为10 mg/L 的4 种香豆素和香兰素混合内标溶液,再加入20 mL 1%甲酸乙腈,振荡5 min,超声20 min,于10 000 r/min 下离心3 min。精确移取2 mL 上清液于10 mL 离心管中,加入吸附剂150 mg C18、450 mg无水MgSO4后涡旋混合提取1 min,10 000 r/min离心3 min,上清液过0.22 μm滤膜后待测定。
1.3.3 色谱条件色谱柱:Agilent SB-C18(2.1 mm×50 mm,1.8 μm);柱温:35 ℃;进样体积:2 μL;流速:0.3 mL/min;流动相:A 为0.2%甲酸水溶液(含5 mmol/L 甲酸铵),B 为乙腈;梯度洗脱程序:0~1 min,90% A;1~ 3 min,90%~60% A;3~10 min,60%~10% A;10~12 min,10% A;12~12.1 min,10%~90% A;12.1~16 min,90% A。
1.3.4 质谱条件电喷雾离子源(ESI源),正负离子同时扫描;多反应监测(MRM)模式;电喷雾电压(IS):4 500 V;离子源温度(TEM):500 ℃;雾化气压力(GS1):379 kPa;气帘气压力(CUR):207 kPa;碰撞气压力(CAD):62 kPa;辅助气压力(GS2):379 kPa。各目标化合物的保留时间、定量和定性离子、去簇电压(DP)及碰撞电压(CE)等质谱参数见表1。
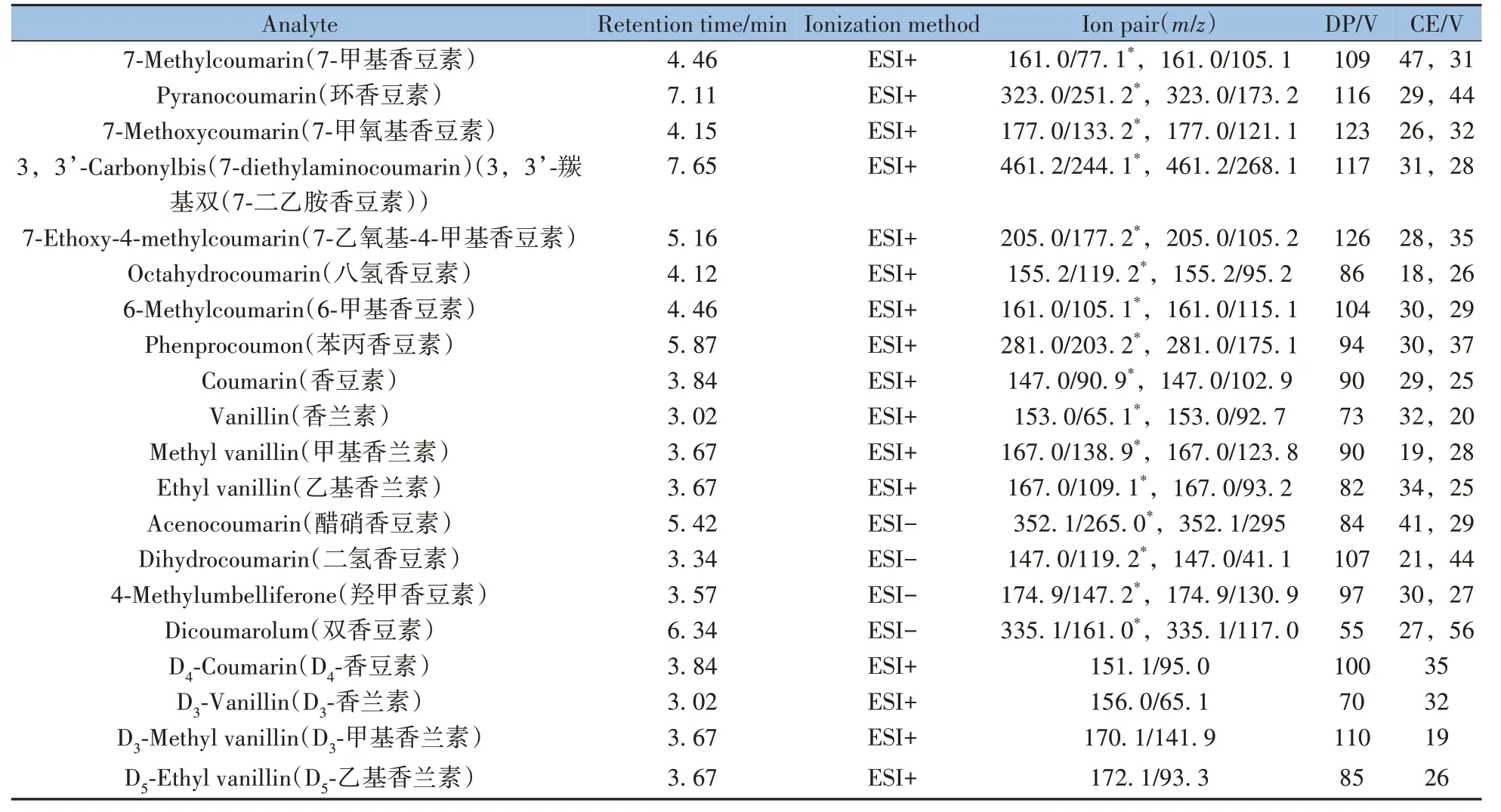
表1 16种待测组分和4种内标的保留时间及质谱参数Table 1 Retention times and MS parameters of 16 target compounds and 4 internal standards
2 结果与讨论
2.1 质谱条件的优化
根据待测物的电离特性,在ESI+和ESI-离子化模式下向质谱仪中注入各组分的单标溶液(质量浓度为10.0 mg/L)进行扫描,根据分子量和质荷比寻找到母离子,再通过子离子扫描进一步确定子离子信息,优化DP、CE 等质谱参数后获取最佳定量和定性离子信号。其中,醋硝香豆素、二氢香豆素、羟甲香豆素、双香豆素在负离子模式下的响应值最大,且双香豆素在正离子模式下无响应,这是由于上述化合物含有羧酸基(—COOH)、羧酸盐基(—COO—)、醇酸基(—OH)等强负电性基团,样品呈酸性,在负离子模式下更易质子化[20]。其余12种化合物均在正离子模式下的响应值较大。最佳质谱条件如“1.3.4”所示。
2.2 色谱条件的优化
本研究的目标物较多,需在保证分离效果和稳定保留时间的前提下,缩短分析时间。小粒径色谱柱具有更大的比表面积,柱效更好[21],因此选择Agilent SB-C18色谱柱(2.1 mm ×50 mm,1.8 μm)对16种待测组分进行分离。因乙腈洗脱能力强,对色谱柱的压力更低,选择乙腈为有机相流动相[16]。考察了0.2%甲酸水溶液、5 mmol/L甲酸铵水溶液、0.2%甲酸水溶液(含5 mmol/L甲酸铵)和水4种水相流动相对待测组分色谱峰分离效果、响应值和峰形的影响。结果表明,水作为流动相时,各待测组分的分离效果不佳,且羟甲香豆素的峰拖尾严重,峰形不对称。当流动相中加入甲酸时,可以有效改善峰形和减弱拖尾[1],同时可为正离子模式下提供必需的质子来源,提高离子化效率[22]。当流动相中同时加入甲酸铵和甲酸时,可提升正负离子的电离效果,正负离子模式下待测物的峰形较好,分离度和响应也较高。最终选择0.2%甲酸水溶液(含5 mmol/L 甲酸铵)-乙腈为流动相。在此条件下,待测组分的提取离子流色谱图(TIC)如图1所示。
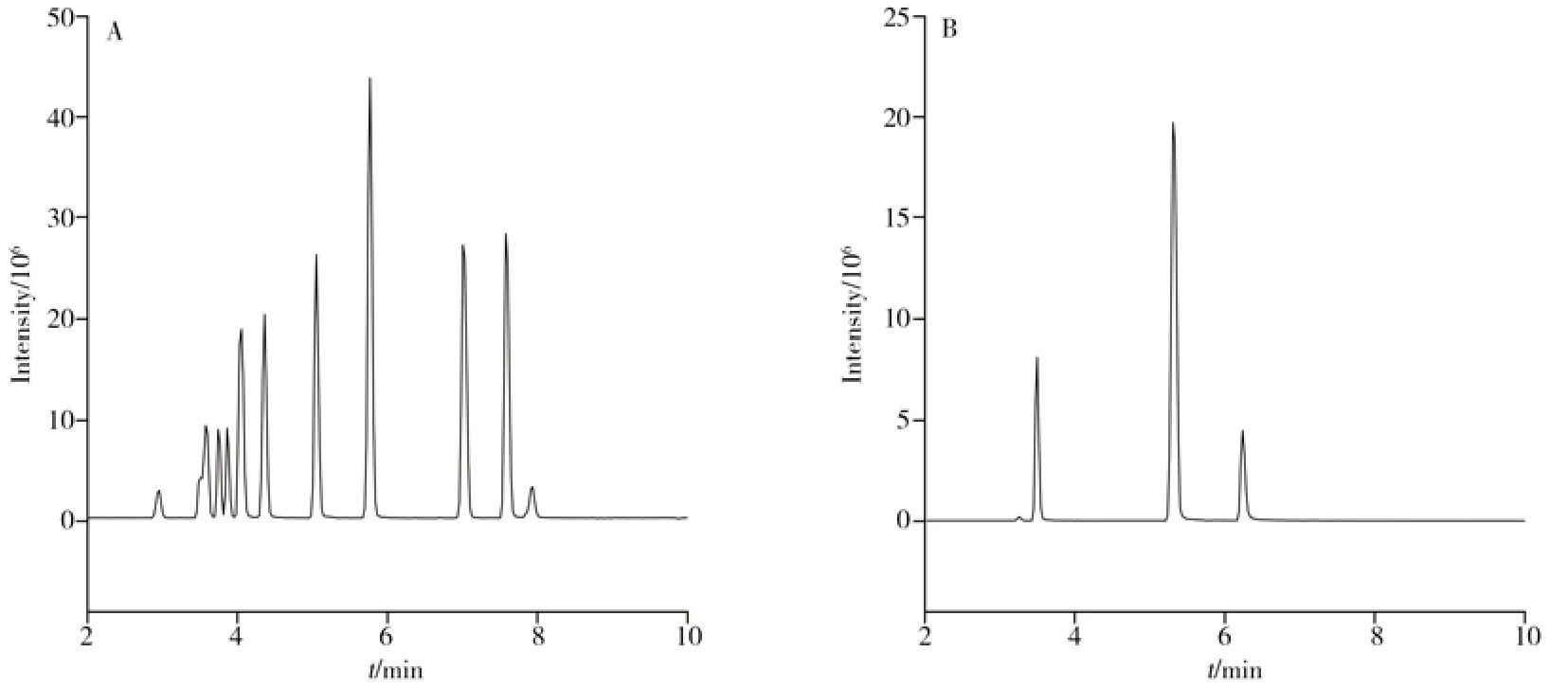
图1 正离子(A)和负离子(B)模式下的提取离子流色谱图Fig.1 TIC chromatograms in positive(A) and negative(B) ion modes
2.3 提取方法的优化
2.3.1 提取溶剂的优化提取溶剂是影响化合物提取效率的主要因素[3],根据提取溶剂的极性和待测物的溶解度等特征,分别采用乙腈、乙腈∶水(1∶1,体积比)、1%甲酸乙腈、1%盐酸乙腈、1%氨水乙腈作为提取溶剂提取待测组分,各组分的回收率如图2 所示。结果表明,乙腈∶水(1∶1)作为提取溶剂时,苯丙香豆素、羟甲香豆素、环香豆素、7-甲基香豆素、羟甲香豆素的回收率较低,这可能是由于香豆素类化合物在水中的溶解度相对较低[23]。乙腈作为提取溶剂时,羟甲香豆素和双香豆素的回收率较低。1%盐酸乙腈作为提取溶剂时,环香豆素的峰形分叉且回收率低。1%甲酸乙腈和1%氨水乙腈作为提取溶剂时,各待测组分的回收率均较高,进一步比较发现,1%甲酸乙腈提取时各待测组分的峰高略高于1%氨水乙腈。故选择1%甲酸乙腈作为提取溶剂。
2.3.2 净化方式的优化由于食品基质较为复杂[3],需进行净化以降低基质干扰,保护仪器免受污染,同时保证待测物的回收率。PLS 固相萃取柱[24]和QuEChERS 盐[25]可对样品基质进行有效净化。本研究考察了上述两种净化方式下目标化合物的提取回收率和净化效果。结果表明,经PLS 固相萃取柱净化后,杂质干扰略有降低,但16 种待测组分有一定损失,回收率不理想,特别是3,3'-羰基双(7-二乙胺香豆素)、香豆素、二氢香豆素、6-甲基香豆素、7-甲基香豆素和八氢香豆素的回收率低于30%。而经QuEChERS 盐净化后,样品的基质干扰降低,且16 种待测组分的回收率均较好,故选择QuEChERS盐进行净化。
2.3.3 吸附剂的优化QuEChERS 法的常用吸附剂主要包括PSA、C18、无水MgSO4、石墨化碳黑(GCB)、氯化钠等[26],上述吸附剂可有效吸附样品基质中的脂肪酸、有机酸、色素、水分等多种干扰物质[27]。根据16 种待测组分的特性和吸附剂特点,考察了PAS+C18+无水MgSO4、PAS+C18、PAS+无水MgSO4、C18+无水MgSO44 种不同种类净化剂的吸附情况,结果表明,当吸附剂中添加PSA 时,苯丙香豆素、醋硝香豆素、二氢香豆素和羟甲香豆素的回收率较低。故选择C18+无水MgSO4作为吸附剂,进一步考察了吸附剂中C18和无水MgSO4用量对待测组分回收率的影响。向提取溶液中分别加入C18(质量分别为50、100、150 mg)和无水MgSO4(质量分别为150、300、450 mg)两两组合的吸附剂,以回收率作为评价指标(见图3)。结果表明,C18用量在50~150 mg范围内各组分的回收率均较好,且C18用量越高,待测组分的峰高越高。无水MgSO4用量为300 mg时,各组分的平均回收率低于用量为150 mg 和450 mg 时。综合考虑待测组分的回收率和峰高,选用吸附剂为150 mg C18+450 mg无水MgSO4。
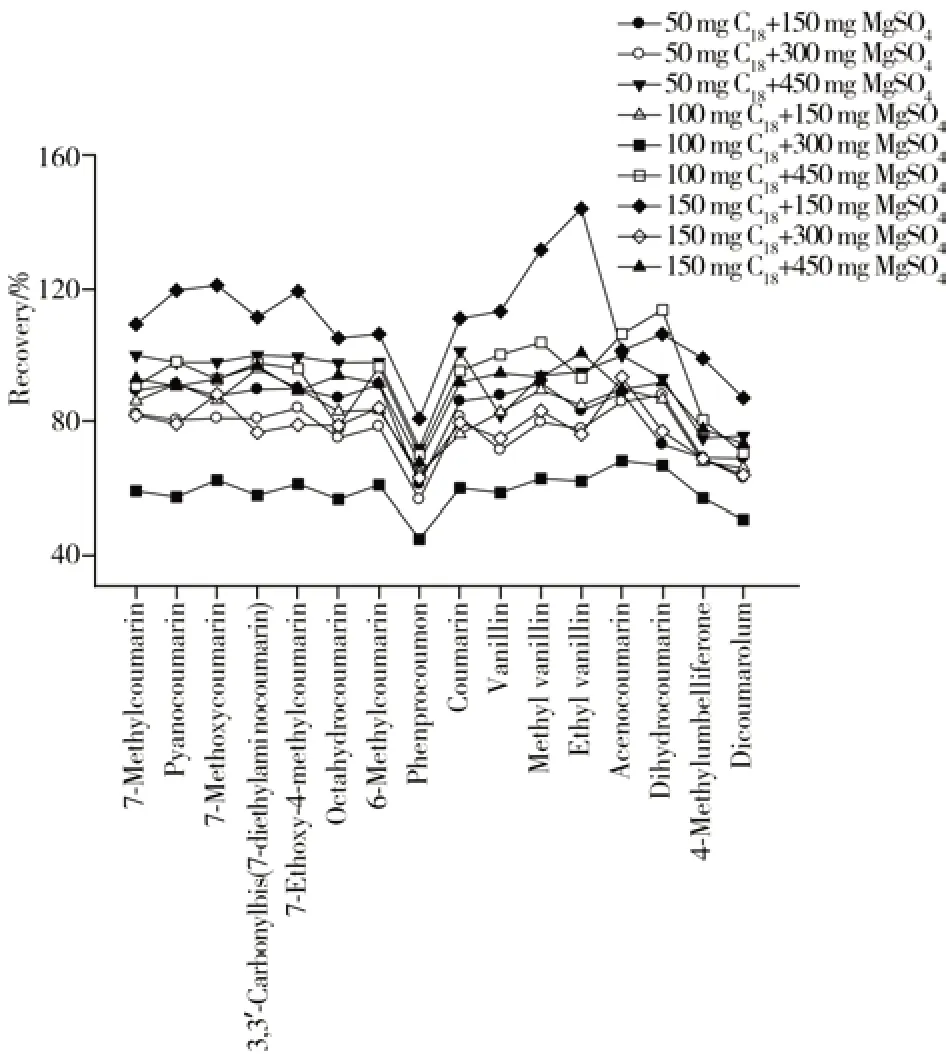
图3 吸附剂组成对16种待测组分回收率的影响Fig.3 Effects of cleaning agent components on recoveries of 16 target compounds
2.4 方法学考察
2.4.1 线性范围、检出限与定量下限按照“1.3.1”方法配制标准工作液,在“1.3.3”和“1.3.4”仪器条件下进行检测,内标法定量,其中D3-香兰素作为香兰素的内标,D3-甲基香兰素作为甲基香兰素的内标,D5-乙基香兰素作为乙基香兰素的内标,D4-香豆素作为其余13 种物质的内标。以定量离子峰面积与内标峰面积比值(y)对待测组分的质量浓度(x,μg/L)进行线性回归分析,相关系数(r)均不低于0.998,表明各待测组分的线性关系良好。取16种标准品溶液,用空白基质溶液稀释后采用本方法进行分析。以满足16种待测组分的定量离子对MRM色谱峰信噪比S/N≥3和S/N≥10 分别确定检出限(LOD)和定量下限(LOQ),得到大米样品中待测组分的LOD 为0.001~0.400 mg/kg,LOQ为0.004~0.600 mg/kg(见表2)。
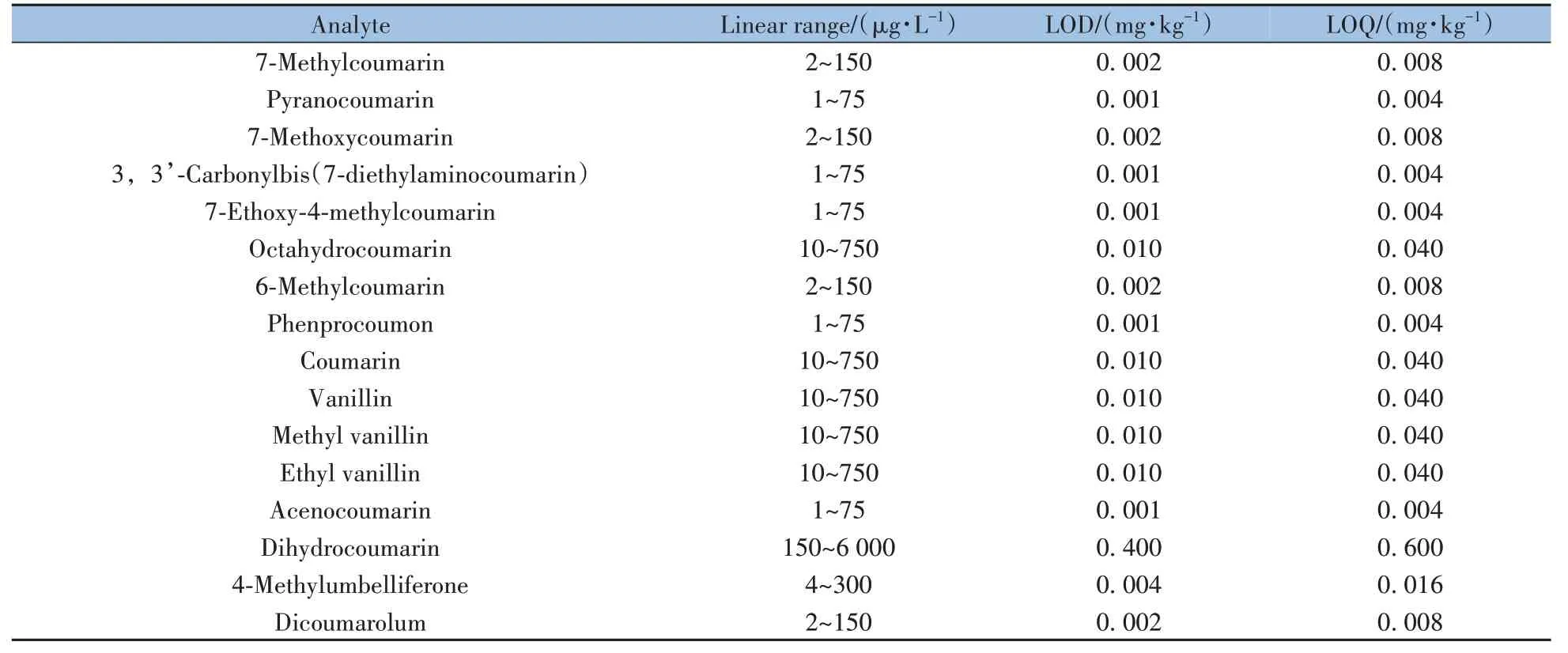
表2 16种待测组分的线性范围、检出限与定量下限Table 2 Linear ranges,LODs and LOQs of 16 target compounds
2.4.2 回收率与相对标准偏差向阴性大米中加入低、中、高3 个水平的混合标准溶液[5],每组做6个平行,进行加标回收实验以评估方法的准确度和精密度,其中环香豆素、3,3’-羰基双(7-二乙胺香豆素)、7-乙氧基-4-甲基香豆素、苯丙香豆素、醋硝香豆素的加标水平为0.020、0.040、0.200 mg/kg,7-甲基香豆素、7-甲氧基香豆素、6-甲基香豆素、双香豆素的加标水平为0.040、0.080、0.400 mg/kg,羟甲香豆素的加标水平为0.080、0.160、0.800 mg/kg,八氢香豆素、香豆素、香兰素、甲基香兰素、乙基香兰素的加标水平为0.200、0.400、2.00 mg/kg,二氢香豆素的加标水平为1.200、2.400、12.000 mg/kg。在优化的实验条件下,16 种待测组分的平均回收率为71.3%~120%,相对标准偏差(RSD,n=6)为1.6%~6.5%,表明该法的准确度和精密度较高,可用于大米样品中16 种香豆素和香兰素及其衍生物的检测。
2.5 日内精密度与日间精密度
用大米空白基质溶液配制二氢香豆素质量浓度为150、300、1 500 μg/L,其余15 种物质质量浓度为50、100、300 μg/L的混合标准溶液,分别在0、2、4、8、12、24 h进行测定,考察待测组分的日内精密度;分别在0、24、48 h 进行测定,考察待测组分的日间精密度。结果表明,16 种待测组分的日内RSD(n=6)为1.0%~8.8%,日间RSD(n=3)为0.60%~14%,表明空白基质溶液中16 种待测组分在48 h内基本保持稳定。
2.6 实际样品测定
将本方法应用于52批次随机抽取的监督抽查大米样品中待测组分的检测,包括11批次餐饮环节样品、26 批次流通环节样品、3 批次委托检验样品和12 批次监督检验样品。结果显示,所测样品中均检出香兰素,这与文献报道一致[1]。其中29 批次大米样品中香兰素的含量在检出限与定量下限之间;23批次大米样品中香兰素的含量为0.040~0.064 mg/kg,表明香兰素在大米中可能存在天然本底。其余15种待测化合物均未检出。
3 结 论
本研究建立了一种QuEChERS/超高效液相色谱-串联质谱同时测定大米中16 种香豆素与香兰素及其衍生物的方法,通过优化色谱、质谱条件和前处理方法,最终确定了合适的流动相、提取溶剂、净化方式以及QuEChERS 盐。该方法线性良好,准确度及精密度较高,前处理简单,适用于大批量的大米样品检测,为大米监管、规范大米市场及维护消费者的切身利益提供了有力的技术支持。
