纤维二糖水解酶在乳酸乳球菌中的表达
2024-02-26黄凯何启杰陈樱欧阳康黄伟坚彭昊韦祖樟李军
黄凯,何启杰,陈樱,欧阳康,黄伟坚,彭昊,韦祖樟,李军*
(1.广西兽医研究所广西兽医生物技术重点实验室,广西 南宁 530005; 2.广西大学动物科学技术学院动物传染病与分子免疫学实验室,广西 南宁 530005;3.农业农村部中国(广西)-东盟跨境动物疫病防控重点实验室,广西 南宁 530005)
乳酸菌 (Lacticacidbacteria,LAB) 是人体及动物体内天然存在的对机体有益生作用的一种重要菌种,具有多种生物学功能,如调节机体胃肠道微生态平衡、降低血液胆固醇以及控制内毒素等,因此被称为益生菌[1, 2]。乳酸乳球菌(Lactococcuslactis,L.lactis)是一种达到了食品级的乳酸菌,在乳酸菌属中最为重要[3],近年来在食品加工及保健品行业被广泛应用,主要作用是参与调节机体胃肠道正常菌群生态平衡[4]。21世纪以来分子生物学飞速发展,乳酸乳球菌的全基因组序列也逐步完成测定,对于乳酸乳球菌的研究取得了重大进展,一些外源基因已被报道在乳酸菌中成功表达。例如,Renye等[5]通过乳酸链球菌素Nisin诱导表达系统获得片球菌素;Abdullah等[6]在乳酸乳球菌NZ9000这一常用乳酸菌种中表达了大肠杆菌的热休克蛋白DnaK。
纤维素酶(Cellulase)是一种可催化纤维素分解的酶类物质,广泛存在于自然界的微生物及动植物体内。一般用于生产的纤维素酶来自木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)的真菌。纤维素酶是由内切葡萄糖苷酶(又称葡聚糖内切酶)、外切葡萄糖苷酶(又称葡聚糖外切酶、纤维二糖水解酶CBH)、 β-葡萄糖苷酶(又称纤维二糖酶)3种不同催化功能的酶组成的多组分酶系,这三种酶互相协同作用增强了降解纤维素的效率[7]。纤维素酶的获取主要来自动物和微生物,这之中真菌类的木霉属(Trichoderma)应用最为广泛,因为其产生的酶量较大、活性较高且遗传性状稳定。与此同时,康宁木霉、绿色木霉、里氏木霉等真菌也在生产中应用较广。在20世纪80年代,DNA重组技术就已经应用在纤维素酶基因的克隆及其鉴定方面了,近年来关于真核表达系统的酵母表达系统研究较多,如刘泽寰等[8]将绿色木霉CBH Ⅱ基因表达于酿酒酵母,无须诱导即可产生分泌到胞外的纤维二糖水解酶。陈士华等[9]也成功通过毕赤酵母表达康宁木霉的CBH Ⅱ基因。随后人们又将目光转向了原核表达系统,通过植物乳杆菌来表达纤维素酶[10]。如赵莹等[11]构建了重组酸性纤维素酶CBH Ⅱ基因与pW425t非抗性的穿梭表达载体的重组质粒pW425t-CBH Ⅱ,通过电转化的方法转入乳酸杆菌中,并且表达成功。孙磊等[12]将纤维素酶基因导入乳酸菌中获得了转基因乳酸菌,得到了可分解含有纤维素和半纤维素物质作物的新型青贮剂,使青贮更加方便高效。
本研究旨在将能降解纤维素酶系中的绿色木霉CBH II基因克隆到乳酸乳球菌表达载体pNZ8148,通过电转化方式将重组质粒转入具有良好益生效果的乳酸乳球菌NZ3900中,经Nisin诱导表达,获得能表达纤维素酶的重组乳酸乳球菌,为乳酸乳球菌的改造应用奠定基础。对乳酸乳球菌进行表达可分解纤维素酶基因的改造,可能获得新型的青贮饲料添加剂,增加对饲料中纤维素和半纤维素物质的分解,提高青贮效率,增加饲料的分解利用率;也可能开发出新型的生物口服制剂,增加动物体对富含纤维素和半纤维素物质作物的消化与吸收,从而提高畜牧生产的效率。
1 材料与方法
1.1 所用质粒和细胞
通过生物信息学方法按照乳酸菌的偏好性对绿色木霉(T.reesei)CBH II基因(GenBank登录号:M55080)进行密码子优化[13],进行密码子优化后的CBH II基因由北京擎科生物科技有限公司合成并克隆到克隆载体中,获得质粒pCBH II;乳酸乳球菌表达载体pNZ8148来自广西壮族自治区兽医研究所;MC1061大肠杆菌购于湖南丰晖生物科技有限公司;乳酸乳球菌NZ3900来自中国科学院上海兽医研究所。
1.2 主要试剂
高保真DNA聚合酶PrimeSTAR®MAX DNA Polymerase、DL2000 DNA Marker、DL5000 DNA Marker均购于Takara公司;高保真限制性核酸内切酶KpnI-HF和SacI-HF以及T4 DNA连接酶购于New England BioLabs公司;胶回收试剂盒、反应液回收试剂盒、质粒小提试剂盒均购于Omega公司;超级感受态细胞制备试剂盒购于上海生工生物工程股份有限公司;GM17肉汤培养基购于北京酷来博科技有限公司;乳酸链球菌素(Nisin)购于 MACKLIN公司;SDS-PAGE凝胶制备试剂盒、预染蛋白质分子质量标准购于康为世纪公司。
1.3 引物的设计与合成
根据密码子优化后的绿色木霉(T.reesei)CBH II基因序列设计一对引物,上游引物引入KpnI限制性核酸内切酶识别位点,下游引物引入SacI限制性核酸内切酶识别位点,引物由北京擎科生物科技有限公司合成。引物序列为:
CBH II-KpnI-F:5′-acgGGTACCatgaagaaaaagatcatcagtg-3′(下划线部分为KpnⅠ识别位点);CBH II-SacI-R:5′-cgtGAGCTCtaaaaatgatggattcgcatt-3′(下划线部分为SacⅠ识别位点)。
1.4 CBH II基因的扩增
将质粒pCBH II稀释1000倍后以其为模板,使用PrimeSTAR MAX高保真DNA聚合酶扩增。扩增体系为25μL体系:PrimeSTAR MAX 12.5μL,上下游引物分别0.5μL,模板DNA 3μL,ddH2O补全至25μL,配制两管共50μL。PCR 扩增条件:预变性98℃ 3min;变性98℃ 10s,退火55℃ 5s,延伸72℃ 10s,32个循环;继续延伸72℃ 10min后经1%琼脂糖凝胶电泳鉴定,目的条带使用Omega公司胶回收试剂盒纯化回收。
1.5 重组表达质粒的构建与鉴定
使用NEB公司的限制性核酸内切酶KpnI-HF和SacI-HF同时酶切pNZ8148和CBH II回收产物。分别配制50μL体系:KpnI-HF 1μL,SacI-HF 1μL,CutSmart Buffer 5μL,模板质粒pNZ8148/CBH II回收产物 15μL,ddH2O补全至50μL;37℃作用6h以上,使用Omega公司反应液回收试剂盒纯化回收。二者回收产物通过T4连接酶16℃过夜连接;使用上海生工生物工程股份有限公司购买的超级感受态细胞制备试剂盒,按说明书步骤制备MC1061感受态细胞,并将上述连接产物转化至MC1061感受态细胞中,涂布含氯霉素抗性LA平板并挑取单克隆菌落进行菌液PCR鉴定,阳性克隆大量扩繁菌液后使用Omega公司质粒小提试剂盒提取质粒经双酶切与生物测序进一步鉴定,获得质粒pNZ8148-CBH II。
1.6 乳酸乳球菌NZ3900感受态细胞的制备
取-80℃储存的NZ3900菌种加入5mL GM17液体培养基中,30℃静置厌氧培养24h进行活化,随后按1∶20的比例将上述菌液加入10mL GM17液体培养基中,在30℃静置厌氧培养24h放大培养,取10mL菌液接种于100mL GM17液体培养基,培养至OD600≈0.3时,于4℃ 4000r/min离心15min收集菌体沉淀,加入50mL 预冷的含0.5M蔗糖及10%甘油的溶液(EPB)洗涤菌体;通过4℃ 4000r/min离心15min收集沉淀,加入50mL预冷的含0.05M EDTA的EPB溶液再次洗涤菌体,4℃ 4000r/min离心15min收集沉淀,再次加入12mL预冷的EPB溶液洗涤菌体,4℃ 4000r/min离心15min,收集沉淀,最后加入适量的EPB溶液重选菌体,每管100μL 进行分装,-80℃保存备用[14]。
1.7 重组CBH II蛋白的诱导表达与可溶性分析
利用鉴定正确的重组质粒电转化NZ3900感受态细胞,条件为电压2500V、电阻200Ω,将所获菌液涂布于含有氯霉素的GM17平板,挑选单克隆菌落进行菌液PCR鉴定筛选阳性克隆。阳性菌液接种于5mL GM17液体培养基,并于30℃静置培养过夜(约16h);按 1∶25 的比例将菌液转接至 10mL GM17 液体培养基中,待OD600达到0.4时,加入乳酸链球菌素(Nisin)至终浓度20ng/mL置于30℃恒温培养箱中静置诱导5h。最后加入8mL PBS重悬菌体,超声破碎菌体(300W,破碎3 s,间歇4 s,150次),5000r/min,4℃离心15min,分别收集上清和沉淀(包涵体)进行SDS-PAGE电泳分析,同时将空载pNZ8148作为对照。
2 结果
2.1 重组表达质粒pNZ8148-CBH II的构建与鉴定
以质粒pCBH II为模板,用设计的引物CBH II-KpnI-F和CBH II-SacI-R扩增CBH II基因,将扩增的CBH II基因克隆至载体pNZ8148中,得到的重组质粒命名为pNZ8148-CBH II。对重组表达质粒进行KpnⅠ和SacⅠ 双酶切,酶切产物经电泳检出约1500bp的目的片段和pNZ8148载体片段(图1),与预期大小一致,最后通过测序结果表明重组表达质粒构建成功(图2)。
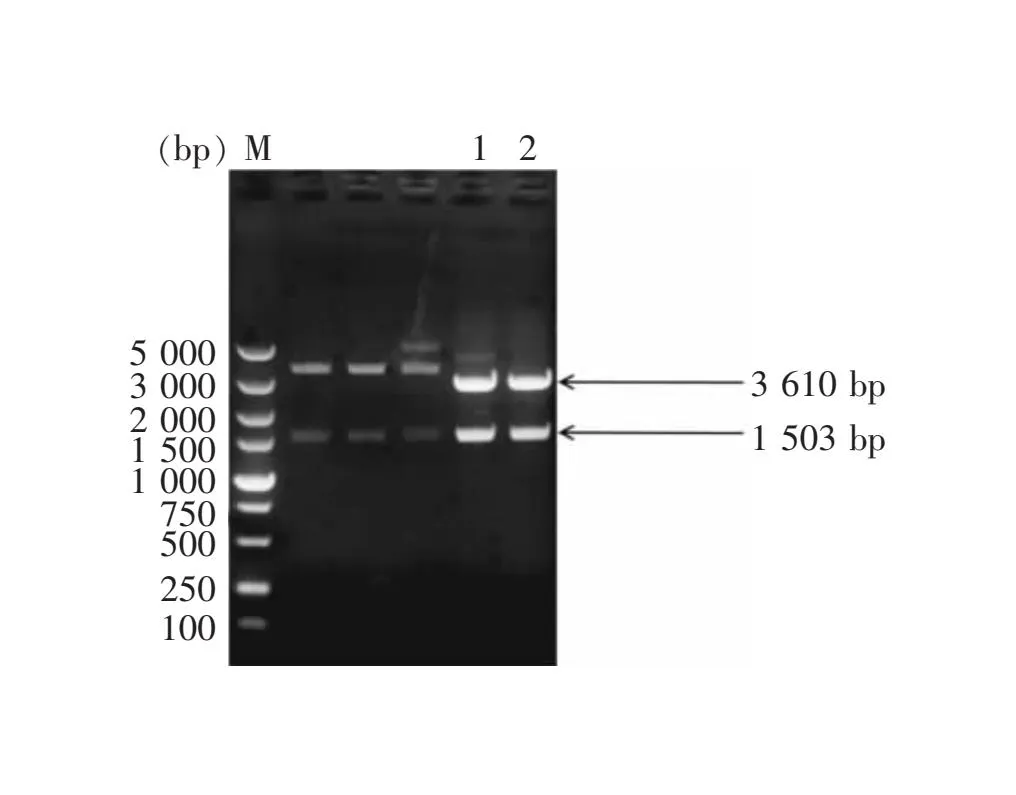
M:DNA标准DL5 000;1,2:pNZ8148-CBH II。

图2 测序结果比对
2.2 重组质粒pNZ8148-CBH II电转化NZ3900阳性克隆筛选
将鉴定正确的重组质粒pNZ8148-CBH II以电压2500V、电阻200Ω的条件电转化进入NZ3900感受态细胞,将所获菌液涂布于含有氯霉素的GM17平板,挑选单克隆菌落进行菌液PCR鉴定筛选阳性克隆(图3),结果显示在1500bp处有符合其大小的特异性条带,说明电转化成功。
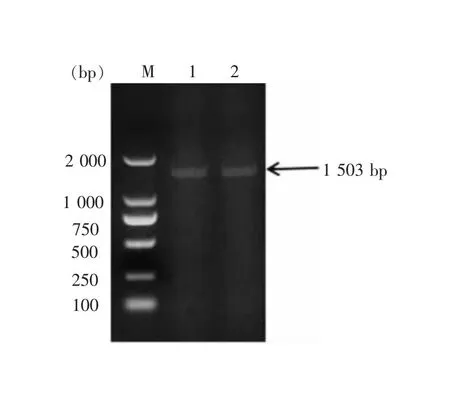
M:DNA标准DL2000;1,2: pNZ8148-CBH II。
2.3 重组蛋白CBH II的诱导表达与可溶性分析
取上述PCR鉴定正确的阳性克隆接种于5mL GM17液体培养基,并于30℃静置培养过夜(约16h);按 1∶25 的比例将菌液转接至10mL GM17 液体培养基中,待 OD600达到0.4时,加入乳酸链球菌素(Nisin)静置诱导5h。通过超声破碎菌体,收集上清和沉淀(包涵体)进行SDS-PAGE电泳分析(图4)。结果显示,Nisin诱导的pNZ8148-CBH II菌液和菌液超声沉淀经SDS-PAGE电泳分析在约53kDa处有特异性条带,符合预期大小,而pNZ8148空载、未诱导的pNZ8148-CBH II菌液以及菌液超声上清均无条带,说明重组CBH II蛋白可经Nisin诱导在NZ3900细胞中表达,且以包涵体形式表达。

M:预染蛋白质分子质量标准;1:pNZ8148空载对照;2:pNZ8148-CBH II未诱导菌液对照;3:pNZ8148-CBH II诱导菌液;4:pNZ8148-CBH II超声沉淀;5:pNZ8148-CBH II超声上清。
3 讨论
乳酸菌是一类对人体和动物体有益的、重要的益生菌,具有对整个机体的胃肠道微生态平衡、降低血液胆固醇以及控制内毒素等多种生物学功能。其中最重要的乳酸乳球菌更是食品级的安全微生物,在食品加工业、保健品行业及医药领域已被广泛研究与应用。近年来已有报道多种外源基因已成功在乳酸菌中表达[5, 6, 15],揭开了对乳酸菌的改造及应用新篇章。
纤维素酶是一种生物催化物质,作用主要是促进纤维素的分解,存在于动植物体内及微生物中。孙磊[12]、赵莹[11]等先后成功通过乳酸菌表达纤维素酶获得重组乳酸菌工程菌,为改造新型乳酸菌、研制新的生物制剂促进纤维素的分解与吸收提供了有力论证。本研究将能降解纤维素酶系中的CBH II基因克隆到乳酸乳球菌表达载体pNZ8148中,通过电转化方式将重组质粒转入乳酸乳球菌NZ3900中并进行Nisin诱导表达,经SDS-PAGE鉴定重组乳酸乳球菌成功表达了CBH II基因,其表达形式为包涵体表达。对此可对信号肽进行分泌型优化、降低诱导温度,保证蛋白有足够的时间进行折叠、添加可溶性标签进行融合表达以增加蛋白在细胞质中的可溶性,从而促进外源蛋白的可溶性表达。乳酸菌作为食品级微生物,在表达过程中,如果同时使用食品级的载体及诱导物,便可直接制成口服制剂,从而免去了一些繁琐的提取步骤及过程,大大降低了成本以及提高了安全性[16]。荷兰NIZO研究所开发的食品级诱导物Nisin诱导基因表达系统 ( The nisin controlledgene expression system,NICE ) 是目前乳酸菌最成熟的表达体系[17, 18],Nisin作为L.lactis天然分泌的一种抗菌肽,已被大部分国家认定为食品级的天然防腐剂[19]。本研究使用Nisin诱导,表达菌种及诱导物均为食品级,但所用载体pNZ8148的筛选抗性为氯霉素,这对于食品和医药保健等安全性要求较高的领域应用会有所受限。今后使用食品级选择标记如营养缺陷互补型选择标记、糖类利用选择标记、热应激抗性选择标记等[20, 21],使得表达系统所有构成均为食品级,以满足食品和医药等领域的高安全性要求。
