小熊猫槽盘吸虫的形态学鉴定及分子进化研究
2024-02-22张爱辉胡春波魏伟毛瑞峰贾斌王春仁高俊峰
张爱辉,胡春波,魏伟,毛瑞峰,贾斌,王春仁,高俊峰*
(1. 黑龙江八一农垦大学动物科技学院,黑龙江 大庆 161319;2.齐齐哈尔市龙沙动植物园有限公司,黑龙江 齐齐哈尔 161002; 3.黑龙江省农业科学院畜牧兽医分院,黑龙江 齐齐哈尔 161000)
槽盘吸虫病,是由背孔科(Notocotylidae)槽盘属(Ogmocotyle)吸虫寄生于动物小肠中所引起的一种吸虫病。槽盘吸虫感染的宿主范围较广,包括山羊、绵羊、黄牛等家畜,甚至一些野生的哺乳动物[1,2]。动物感染后会出现贫血、消瘦、腹泻、出血性肠炎等症状,严重感染可引起死亡[3]。槽盘吸虫病不仅给畜牧业带来严重的经济压力,而且对野生动物的生命健康存在着巨大的威胁。
有关研究显示,已经报道的槽盘吸虫种类有鹿槽盘吸虫(Ogmocotylesikae)、羚羊槽盘吸虫(Ogmocotylepygargi)、唐氏槽盘吸虫(Ogmocotyletangi)和小熊猫槽盘吸虫(Ogmocotyleailuri)[4-7]。不同种类的槽盘吸虫寄生的宿主也有所差异,如鹿槽盘吸虫主要寄生于麝[8]、绵羊和山羊体内,羚羊槽盘吸虫主要寄生于绵羊和山羊体内[4],唐氏槽盘吸虫寄生于小鹿体内[6],而小熊猫槽盘吸虫主要寄生于小熊猫体内[9]。传统的形态学鉴定主要依据槽盘吸虫睾丸的形态与雄茎囊的位置作为槽盘吸虫种类判定的依据。但目前有关小熊猫槽盘吸虫的报道极少,仅在北京动物园有小熊猫感染槽盘吸虫的报道[9]。
近年来,分子生物学方法已成为物种鉴定中常用的有效方法[10]。核糖体DNA(rDNA)的内转录间隔区(Internal transcribed spacer region,ITS)被报道可作为良好的遗传标记基因,已经广泛地用于寄生虫领域的虫体鉴定及遗传进化分析[11]。因此,本研究拟对齐齐哈尔某动物园小熊猫肠道内分离的吸虫通过形态学结合分子生物学方法进行鉴定,并基于rDNA ITS-2序列进行遗传进化分析,探讨该吸虫在复殖吸虫中的分类地位。本研究为小熊猫槽盘吸虫病的流行病学调查和分子鉴别诊断提供科学的参考依据。
1 材料与方法
1.1 虫体
虫体采自黑龙江省齐齐哈尔某动物园一例小熊猫死亡病例,剖检时于肠道内发现大量小型吸虫,将虫体收集后用生理盐水反复冲洗,放在70%的酒精中固定,于-20℃保存备用。
1.2 主要试剂
德式苏木素染液采购于Biosharp 公司;dNTPs、Loading Buffer、琼脂糖均采购于宝日医生物技术(北京)有限公司;DNA提取试剂盒、DNA凝胶回收试剂盒、加拿大树胶、水杨酸甲酯。
1.3 虫体装片制备及形态学鉴定
将酒精中固定的虫体取出,采用苏木素染色的方法[12]经染色,梯度酒精褪色,水杨酸甲酯透明,加拿大树胶封固后制成装片。将做好的装片放于显微镜下,先通过低倍镜观察虫体整体轮廓,再通过高倍镜观察虫体的各个器官,特别注意虫体的睾丸形态及雄茎囊的位置,参考先前文献报道[4]进行形态学鉴定。
1.4 DNA的提取及ITS序列分析
在70%酒精中取出虫体,经蒸馏水冲洗几遍放置于无菌离心管中,利用DNA提取试剂盒提取此吸虫总DNA,将提取的DNA存放于-20℃保存备用。
以所提取的DNA为模板,上游引物CPF:5′-CCCTGGAAACGGATTGT-3′,下游引物CPR:5′-ATGCTTGGGTCATAGAAA-3′,PCR扩增目的序列。反应体系为25μL;反应条件:94℃ 2min,94℃ 30s、50℃ 30s、72℃ 80s,共35个循环,72℃延伸7min。得到的PCR产物经1%琼脂糖凝胶电泳进行鉴定,将得到的目的条带使用胶回收试剂盒进行纯化回收,送往测序公司进行双向测序。将序列利用生物学软件DNAStar 5.0,将两段序列进行拼接,与NCBI中相关吸虫序列进行比对分析,利用MEGA 11软件将所得序列进行分段。
1.5 系统发生树的构建
以有尾感器亚纲的牛仰口线虫(Bunostomumphlebotomum)为外群,将本研究所获得的槽盘吸虫与复殖吸虫部分代表性吸虫ITS-2序列进行比对分析(表1)。使用MEGA 11软件系统发育选项中的最大似然估计法(ML),substitution model、rates and patterns等选用默认值,其中Bootstrap Replications改为500,来构建系统发生树,探讨小熊猫槽盘吸虫在复殖吸虫中的分类地位。
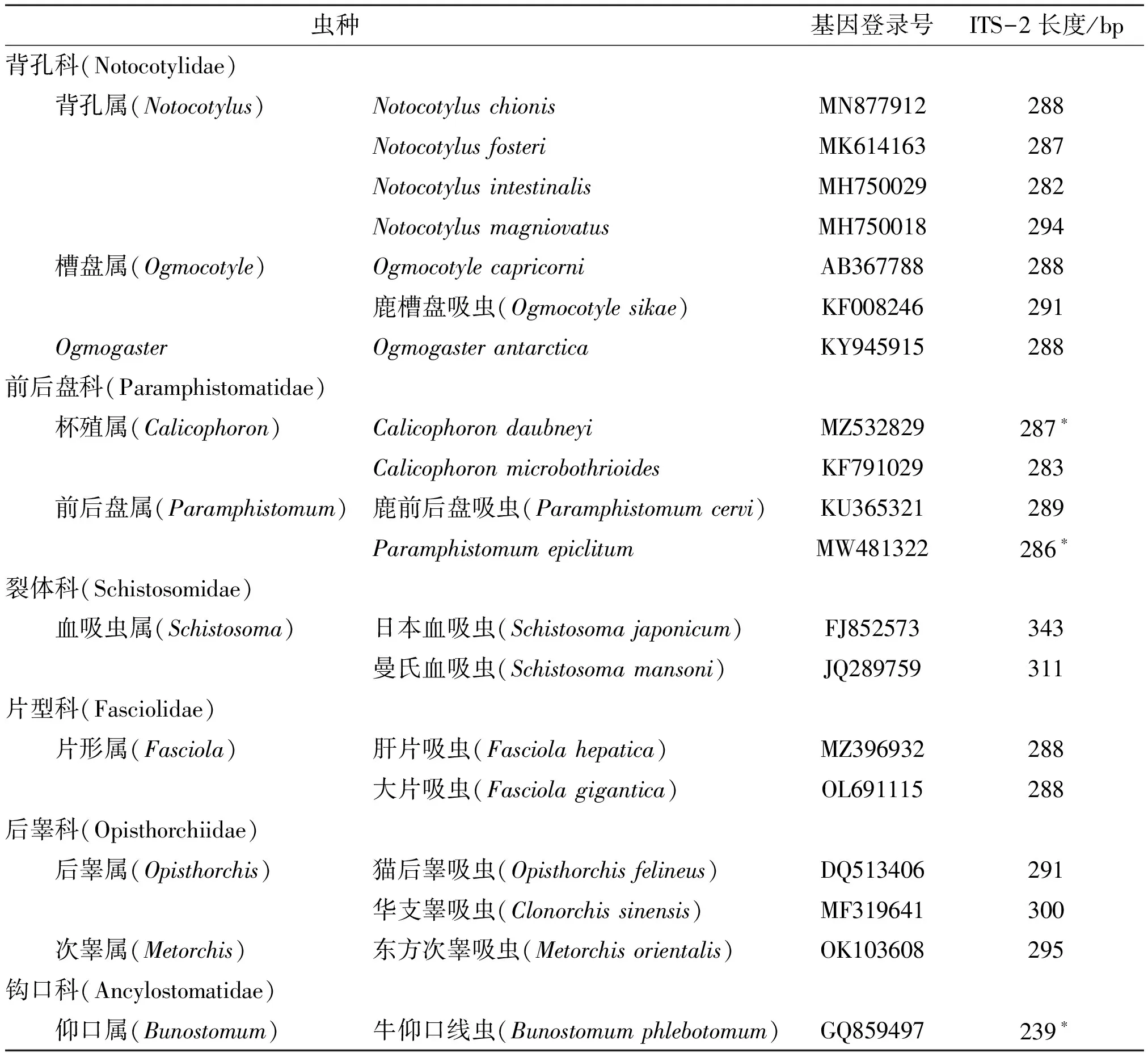
表1 本研究进化树中复殖吸虫ITS-2的序列信息
2 结果
2.1 吸虫的形态学鉴定
经德式苏木素染液染色后的虫体装片放在显微镜下进行观察,观察结果显示本研究分离的虫体形态与文献中小熊猫槽盘吸虫的描述一致。虫体小,呈卵圆形或葵花籽形,两端钝圆,口吸盘小,位于虫体前端腹侧面。无咽,食道短,两肠支沿着身体两侧向后延伸至睾丸内侧。雄茎囊粗壮,呈半圆形横卧在虫体中央。没有腹吸盘。子宫发达,在虫体的中后部,呈“S”状弯曲。睾丸位于虫体后侧,对称分布,睾丸具有大量分叶,似香肠状、不规则的卵圆形。梅氏腺位于两睾丸之间。卵巢位于虫体末端中央,分叶排布,每叶呈椭圆形(图1)。因此,根据其形态要点将本研究分离的吸虫鉴定为小熊猫槽盘吸虫。
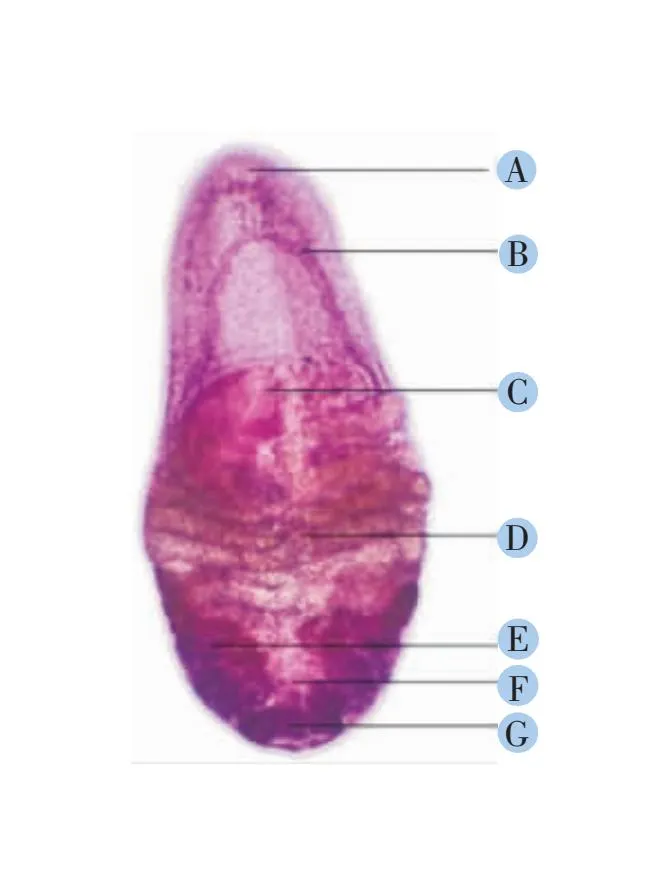
A:口吸盘;B:食道;C:雄茎囊;D:子宫;E:睾丸;F:梅氏腺;G: 卵巢。
2.2 rDNA ITS序列的扩增及分析
通过PCR扩增出小熊猫槽盘吸虫的ITS序列,PCR产物经琼脂糖凝胶电泳在950bp左右出现单一条带,与预期条带大小一致(图2)。基因片段经校正后进行拼接,基因全长为936bp,根据NCBI中相似序列进行比对分析得出ITS-1、5.8S和ITS-2序列大小分别为518bp、126bp和292bp。将获得的ITS-2序列与NCBI中Ogmocotylesikae(KF008246)的ITS-2序列进行对比分析,二者同源性为94.9%(图3),根据两段序列对比有15个碱基发生了突变,即C49-T、T56-A、C84-T、G145-A、A158-G、A195-T、A217-G、C223-T、C230-T、C246-T、C247-T、A248-G、A262-G、A267-T、C277-T。
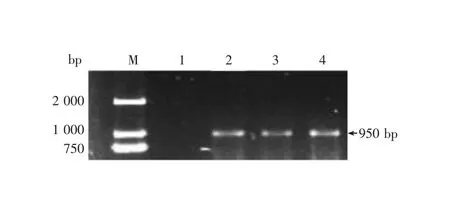
M:DL-2000标准分子量;1:阴性对照;2-4:槽盘吸虫样本。

图3 虫体ITS-2基因相似性与分歧度分析
2.3 遗传进化分析
本研究以牛仰口线虫作为外群,基于ITS-2序列采用最大似然法构建复殖吸虫系统发育进化树。在系统发生树中,本研究分离的槽盘吸虫与槽盘属的另两种吸虫O.capricorni和鹿槽盘吸虫亲缘关系最近,处于同一分支。其他背孔属吸虫与槽盘属吸虫均在背孔科分支中。背孔科、前后盘科、裂体科、后睾科、片型科形成单独分支(图4)。该结果与传统的形态学鉴定结果一致,表明ITS-2标记的基因可以用来鉴定背孔科吸虫的种间遗传关系。
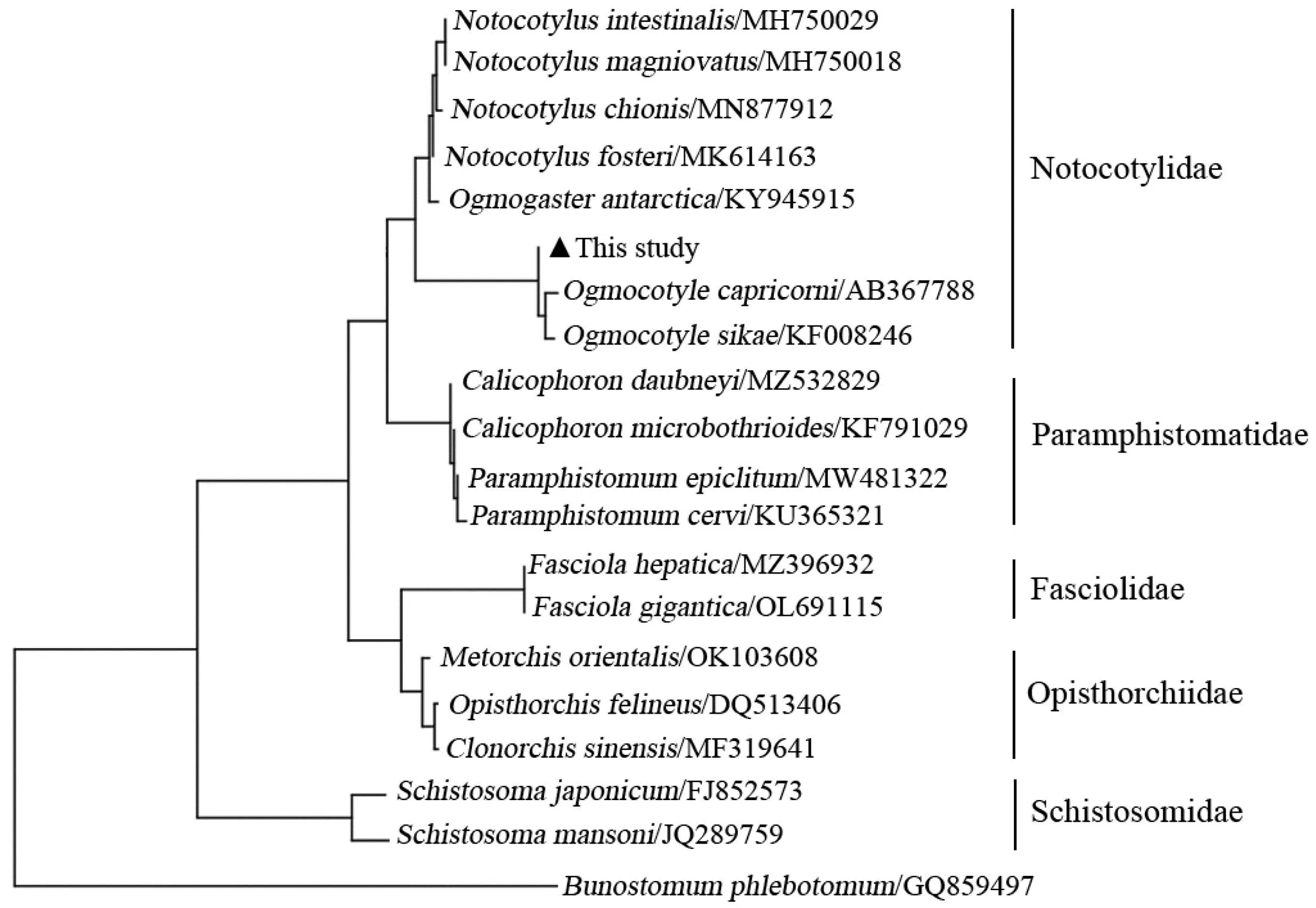
图4 ML方法构建复殖目吸虫系统进化树
3 讨论
为了清楚地观察到小熊猫槽盘吸虫的内部器官结构,本研究通过德氏苏木素染色方法对槽盘吸虫进行染色。与槽盘属已报道的鹿槽盘吸虫、唐氏槽盘吸虫和羚羊槽盘吸虫的形态学要点进行比较,发现其睾丸的形态与雄茎囊的位置在各吸虫间均有所差异,其中羚羊槽盘吸虫的睾丸呈长柱形且睾丸边缘有多数分瓣,雄茎囊纵卧于虫体前端。唐氏槽盘吸虫的睾丸呈长块状,边缘有深浅不等的缺刻,雄茎囊位于虫体前半部的右侧。鹿槽盘吸虫的睾丸呈长椭圆形,边缘有4~5个缺刻[13],雄茎囊也是纵卧于虫体前端。而小熊猫槽盘吸虫的睾丸大量分瓣且呈香肠状,雄茎囊发达且横卧于虫体前半部。通过染色结果发现从小熊猫体内分离到的虫体睾丸形态与雄茎囊位置与文献描述一致,根据形态学确定此吸虫为小熊猫槽盘吸虫。
虽然在形态上可以简单快速地对槽盘吸虫进行种属的鉴定。但是,虫体间的形态差异以及鉴定人员的水平和经验等因素影响着对虫体鉴定的准确性。所以就要借助分子生物学手段对所研究的槽盘吸虫进行进一步鉴定。ITS被广泛地应用于寄生虫虫种鉴定以及遗传进化分析中[14]。为了对槽盘吸虫进行种类鉴定及进化分析,本研究扩增其ITS基因序列并测序比对分析,发现此虫体与O.capricori和鹿槽盘吸虫的基因相似度分别为94.8%和94.9%,且在进化树中处于同一分支,由此可以表明此种吸虫属于槽盘属吸虫。另外,在槽盘属吸虫分支中,O.capricorni与鹿槽盘吸虫聚在一起,较本研究分离的小熊猫槽盘吸虫亲缘关系要近。NCBI数据库中O.capricorni与鹿槽盘吸虫序列信息显示两种吸虫的宿主分别为髭羚和山羊,宿主动物均属于偶蹄目牛科,但本研究的槽盘吸虫宿主动物为小熊猫,属于食肉目小熊猫科,这可能是出现上述进化分析结果的重要原因。
本研究通过形态学结合分子生物学方法对黑龙江省某动物园小熊猫体内分离的吸虫进行鉴定,最终确定所分离的吸虫为小熊猫槽盘吸虫。该结果填补了槽盘吸虫的分子数据,为我国小熊猫槽盘吸虫的流行病学调查及分子鉴别诊断提供科学的参考依据。
