实验室COD废水处理研究
2024-02-26罗瑜婷吴龙华
罗瑜婷,郑 丹,吴龙华,陈 都
(武汉工商学院,湖北 武汉 430065)
随着我国教育事业的发展及教学改革的深化,实验室成为高校进行教学和科研创新的重要场所,但在教学与科研过程中产生了大量的实验室废水[1]。实验室废水成分复杂,含有铅(Pb)、汞(Hg)、镉(Cd)、铬(Cr)、铜(Cu)、锑(Sb)、锰(Mn)等重金属污染物。若处置不当直接排放,不仅会对生态环境造成不利影响,还会通过食物链威胁人体健康[2-3]。实验室废水的处理方法较多,可根据废水所含成分的不同,选择不同的处理方式[4]。实验室分析水质COD时常采用重铬酸钾法,会产生大量含有Cr6+、Ag+和Hg2+的有毒废水。因此,作者以实验室COD废水为研究对象,采用氧化还原法和中和沉淀法处理COD废水中重金属离子,并通过单因素实验和正交实验优化处理条件。
1 实验
1.1 试剂与仪器
氯仿、双硫腙、二苯碳酰二肼,分析纯,国药集团药业股份有限公司;高锰酸钾、浓硫酸,分析纯,天津凯通化学试剂有限公司;氯化钠,分析纯,天津天力化学试剂有限公司。
85-2A型恒温磁力加热搅拌器,常州金坛大地自动化仪器厂;AUY120型电子天平,日本岛津;722E型可见分光光度计,上海光谱仪器有限公司;101-2DE型电热鼓风干燥箱,天津泰斯特仪器有限公司;PXSJ-216F型离子计、PAg/S-1型银硫电极,上海仪电科学仪器股份有限公司;SHB-Ⅲ型循环水式多用真空泵,郑州亚荣仪器有限公司。
1.2 COD废水中总Cr、Cr6+浓度的测定
1.2.1 Cr6+标准曲线的绘制
分别移取2 μg·mL-1Cr6+标准溶液0 mL、2 mL、4 mL、6 mL、8 mL、10 mL,置于50 mL比色管中,配制成Cr6+标准使用溶液,以试剂空白作为参比溶液,室温下测定540 nm处吸光度。以Cr6+浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得到线性回归方程:A=0.0172c+0.0105(R2=0.9990)。
1.2.2 总Cr、Cr6+浓度的测定
采用高锰酸钾氧化-二苯碳酰二肼分光光度法[5]测定总Cr、Cr6+的浓度。取一定量的COD废水于烧杯中,用氨水调节至中性,加入几粒玻璃珠,再加入9 mol·L-1硫酸1 mL、7 mol·L-1磷酸1 mL,摇匀;加入4%高锰酸钾溶液5~6滴(紫色不消失),盖上表面皿,加热煮沸,直至溶液体积约为20 mL,冷却;加入1 mL 20%尿素溶液,滴加2%亚硝酸钠溶液,边滴边充分摇动烧杯至溶液紫色消失;待烧杯中没有气泡后,将溶液移至50 mL比色管中,用蒸馏水稀释至刻度,加入2.5 mL显色剂,充分摇匀;10 min后,以试剂空白为参比溶液,测定540 nm处吸光度,根据标准曲线方程计算COD废水中总Cr浓度。
不加4%高锰酸钾溶液,同法测定COD废水中Cr6+浓度。
1.3 COD废水中Hg2+浓度的测定
1.3.1 Hg2+标准曲线的绘制
采用双硫腙分光光度法[5]测定Hg2+浓度。分别移取1 mg·L-1Hg2+标准溶液0 mL、0.5 mL、1.0 mL、2.5 mL、5.0 mL、10.0 mL,置于50 mL具塞锥形瓶中,配制成Hg2+标准使用溶液, 以氯仿试剂作为参比溶液,室温下测定485 nm处吸光度。以Hg2+浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得到线性回归方程:A=0.0525c+0.0023(R2=0.9980)。
1.3.2 Hg2+浓度的测定
取一定量的COD废水于烧杯中,加入1 mL亚硫酸钠溶液,混匀;加入10 mL双硫腙氯仿溶液,缓慢旋摇并放气,密塞振摇1 min,静置分层;将有机相转入盛有20 mL双硫腙洗脱液的60 mL分液漏斗中,振摇1 min,静置分层,直至有机相不带绿色;用滤纸吸去分液漏斗放液管内的水珠,塞入脱脂棉;将有机相置于20 mm比色皿中,以氯仿作为参比溶液,测定485 nm处吸光度,根据标准曲线方程计算COD废水中Hg2+浓度。
1.4 COD废水中Ag+浓度的测定
1.4.1 Ag+标准曲线的绘制
采用离子选择性电极法[6]测定Ag+浓度。分别移取Ag+标准溶液0 mL、20 mL、40 mL、80 mL、100 mL置于250 mL锥形瓶中,配制成Ag+标准使用溶液,利用银硫电极及硫酸钾参比电极测定Ag+标准使用溶液的电位值。以Ag+浓度(x)为横坐标、电位值(y)为纵坐标绘制标准曲线,拟合得到线性回归方程:y=-63.11x+176.97(R2=0.9993)。
1.4.2 Ag+浓度的测定
取一定量的COD废水于烧杯中,用氨水调节至中性,利用银硫电极及硫酸钾参比电极测定溶液的电位值,根据标准曲线方程计算COD废水中Ag+浓度。
2 结果与讨论
2.1 单因素实验结果
2.1.1 葡萄糖加量对Cr6+转化效果的影响
分别将4 g、6 g、8 g、10 g、12 g、14 g葡萄糖加入到50 mL COD废水(COD初始浓度为61.68 g·L-1)中,按1.2方法测定总Cr、Cr6+浓度,考察葡萄糖加量对Cr6+转化效果的影响,结果如图1所示。
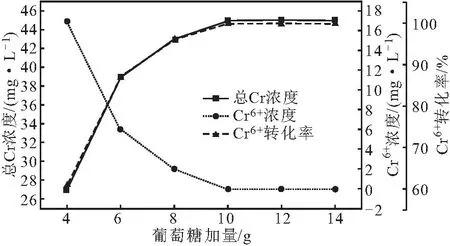
图1 葡萄糖加量对Cr6+转化效果的影响Fig.1 Effect of glucose dosage on Cr6+ conversion
在Cr6+转化过程中,添加葡萄糖作为电子供体,有利于Cr6+转化率的提高[7]。从图1可以看出,随着葡萄糖加量的增加,总Cr浓度、Cr6+转化率均迅速上升,Cr6+浓度迅速下降;当葡萄糖加量为10 g时,总Cr浓度、Cr6+转化率均达到最高,Cr6+浓度降至最低;继续增加葡萄糖加量,总Cr、Cr6+浓度及Cr6+转化率均趋于稳定,此时,Cr6+全部被去除,总Cr浓度无明显变化,认为在此过程中葡萄糖将Cr6+完全转化为Cr3+。综合考虑,后续实验选择葡萄糖加量为10 g处理COD废水。
2.1.2 氯化钠加量对Ag+去除效果的影响
分别将0.1 g、0.3 g、0.7 g、1.3 g、2.1 g、3.1 g氯化钠加入到50 mL COD废水中,过滤,将氯化银沉淀烘干,室温称重,采用氯化银沉淀法测定氯化银沉淀质量;同时采用离子选择性电极法测定Ag+去除率,考察氯化钠加量对Ag+去除效果的影响,结果如图2所示。
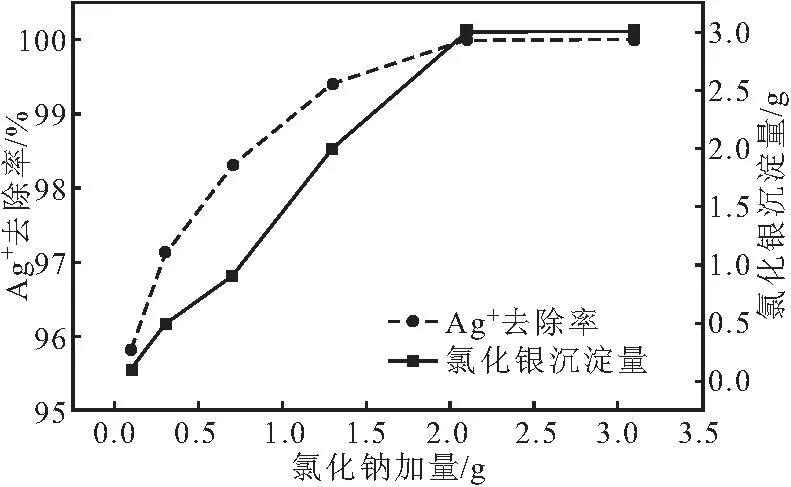
图2 氯化钠加量对Ag+去除效果的影响Fig.2 Effect of sodium chloride dosage on removal of Ag+
从图2可以看出,随着氯化钠加量的增加,氯化银沉淀量和Ag+去除率均迅速上升;当氯化钠加量为2.1 g时,Ag+去除率为100%,COD废水中的Ag+全部转化为氯化银沉淀。综合考虑,后续实验选择氯化钠加量为2.1 g沉降COD废水中的Ag+。
2.1.3 氢氧化钠加量对总Cr、Hg2+浓度的影响
分别将4.0 g、4.5 g、5.0 g、5.5 g、6.0 g氢氧化钠加入到50 mL COD废水中,20 ℃下反应20 min,分别按1.2、1.3方法测定总Cr、Hg2+浓度,考察氢氧化钠加量对总Cr、Hg2+浓度的影响,结果如图3所示。
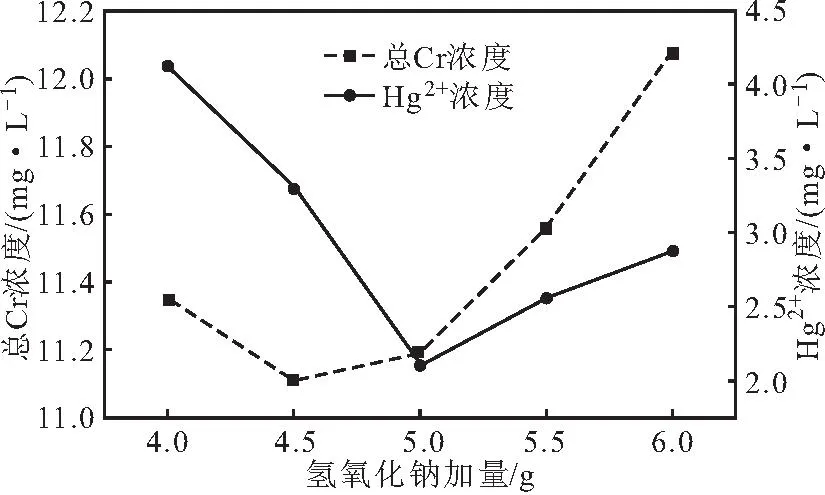
图3 氢氧化钠加量对总Cr、Hg2+浓度的影响Fig.3 Effect of sodium hydroxide dosage on concentrations of total Cr and Hg2+
从图3可以看出,随着氢氧化钠加量的增加,总Cr、Hg2+浓度均先迅速下降后上升;当氢氧化钠加量为4.5 g时,总Cr浓度最低,为11.11 mg·L-1;当氢氧化钠加量为5.0 g时,Hg2+浓度最低,为2.11 mg·L-1。
2.1.4 反应温度对总Cr、Hg2+浓度的影响
将5.0 g氢氧化钠加入到COD废水中,分别在10 ℃、20 ℃、30 ℃、40 ℃、50 ℃下反应20 min,分别按1.2、1.3方法测定总Cr、Hg2+浓度,考察反应温度对总Cr、Hg2+浓度的影响,结果如图4所示。
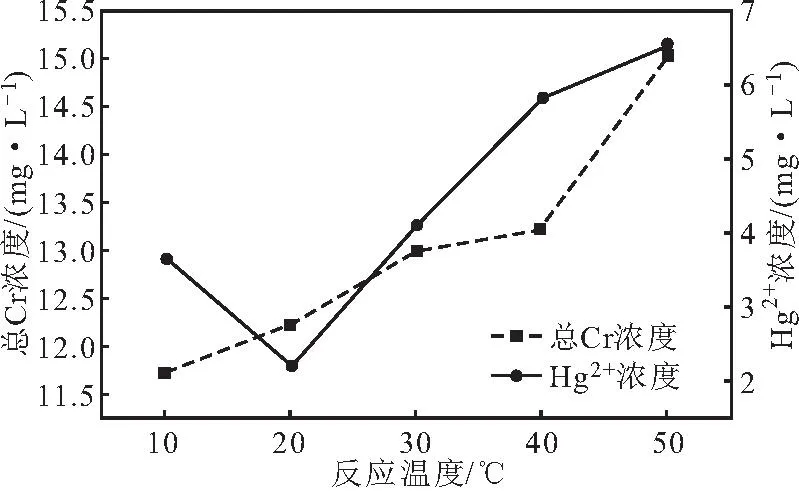
图4 反应温度对总Cr、Hg2+浓度的影响Fig.4 Effect of reaction temperature on concentrations of total Cr and Hg2+
从图4可以看出,随着反应温度的升高,氢氧化铬沉淀溶解的速率加快,总Cr浓度迅速上升,当反应温度为10 ℃时,总Cr浓度最低,为11.72 mg·L-1,此时总Cr的去除效果最佳。随着反应温度的升高,Hg2+浓度先迅速下降后逐渐上升,当反应温度为20 ℃时,Hg2+浓度最低,为2.21 mg·L-1,此时Hg2+的去除效果最佳。
2.1.5 反应时间对总Cr、Hg2+浓度的影响
将5.0 g氢氧化钠加入到COD废水中,20 ℃下分别反应5 min、10 min、15 min、20 min、25 min,分别按1.2、1.3方法测定总Cr、Hg2+浓度,考察反应时间对总Cr、Hg2+浓度的影响,结果如图5所示。

图5 反应时间对总Cr、Hg2+浓度的影响Fig.5 Effect of reaction time on concentrations of total Cr and Hg2+
从图5可以看出,随着反应时间的延长,总Cr、Hg2+浓度均先下降后上升。这是因为,氢氧化钠与废水中的Cr3+、Hg+发生反应生成氢氧化物沉淀,随着反应时间的延长,过量碱性浓度使氢氧化物沉淀重新溶解在废水中,形成可溶解的四氢氧化铬离子与亚汞酸盐离子,此时废水呈亮绿色。当反应时间为20 min时,总Cr、Hg2+浓度均最低,分别为12.18 mg·L-1和2.17 mg·L-1,COD废水处理效果最好。
2.2 正交实验结果
在单因素实验的基础上,选取氢氧化钠加量(A)、反应时间(B)、反应温度(C)为考察因素,以总Cr、Hg2+去除率为评价指标,通过L9(33)正交实验进一步优化实验室COD废水的处理条件。正交实验设计及结果见表1。
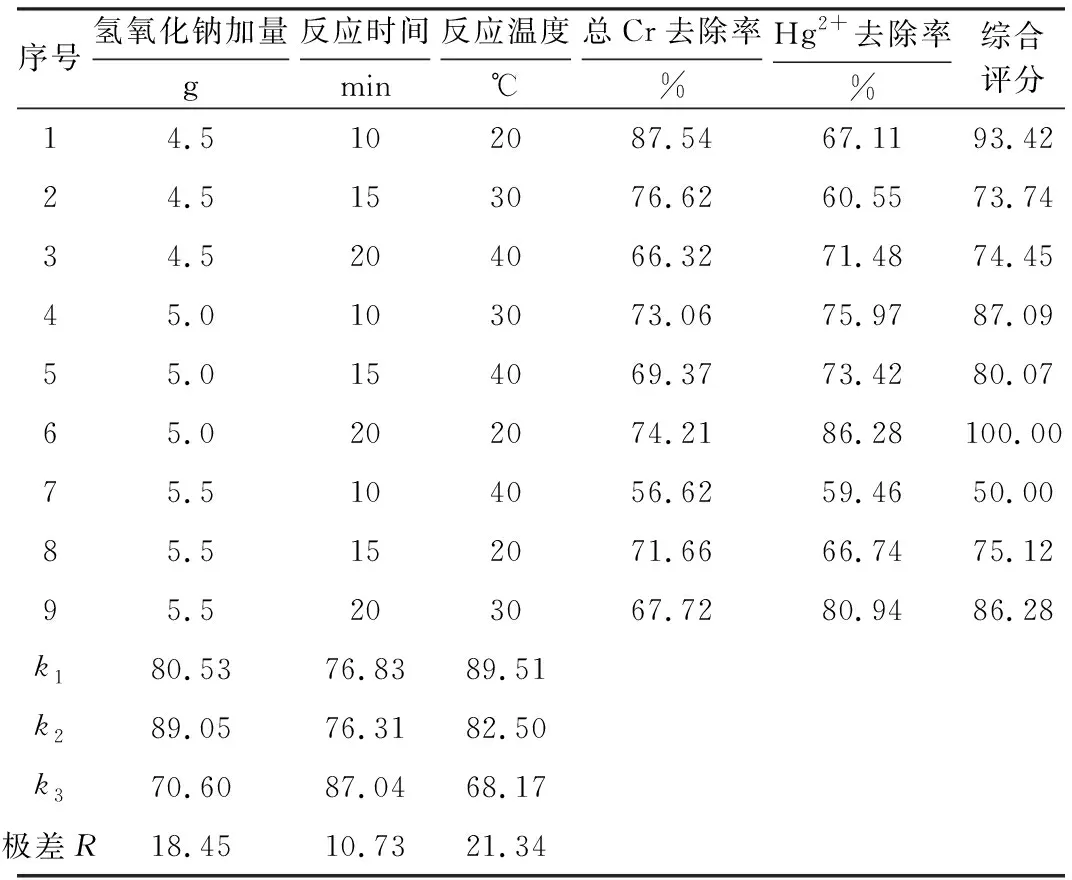
表1 正交实验设计及结果Tab.1 Design and results of orthogonal experiments
综合评分越高,表示总Cr、Hg2+去除效果越好;反之,综合评分越低,去除效果越差。由表1可知,各因素对去除过程的影响大小顺序为:反应温度(C)>氢氧化钠加量(A)>反应时间(B);最佳处理条件组合为A2B3C1,即氢氧化钠加量为5.0 g、反应时间为20 min、反应温度为20 ℃。
2.3 验证实验
在氢氧化钠加量为5.0 g、反应时间为20 min、反应温度为20 ℃的最佳条件下进行验证实验,测得总Cr去除率为75.13%,Hg2+去除率为86.51%。
3 结论
以实验室COD废水为研究对象,采用投加葡萄糖、氯化钠、氢氧化钠等对其进行处理,通过单因素实验和正交实验优化了COD废水的处理条件。结果表明,葡萄糖加量为10 g时,废水中Cr6+完全转化为Cr3+;氯化钠加量为2.1 g时,废水中Ag+去除率为100%;在氢氧化钠加量为5.0 g、反应时间为20 min、反应温度为20 ℃的最佳条件下,总Cr和Hg2+综合去除效率最佳,去除率分别为75.13%、86.51%。该研究为实验室COD废水中重金属离子的去除提供了理论依据,对改善水体生态具有重要意义。
