脐带间充质干细胞对干燥综合征患者外周血的免疫调控研究*
2024-02-26王思博庞春艳
王思博,吴 涛,庞春艳,王 慧
(包头医学院第一附属医院,内蒙古包头 014010)
干燥综合征(Sjögren's syndrome,SS)是一种自身免疫性的弥漫性结缔组织病。常见表现有泪腺和唾液腺受累、分泌物减少、组织淋巴细胞浸润、免疫系统异常等[1]。临床的典型症状是干燥性角结膜炎和口干燥症,发展严重后可累及多种脏器,甚至累及全身器官[2]。目前SS的发病原因和作用机制仍不是十分清楚。有研究发现SS是免疫介导的炎性外分泌病,以外周血T细胞减少、B细胞过度增殖为特征[3]。目前临床上针对脏器尚未受损的病患常辅以代替或对症治疗,而较为严重的患者如脏器已有损害的,可配合免疫调节治疗以减缓病情。总的来说,目前本病尚无具体根治手段。间充质干细胞(mesenchymal stem cells , MSCs)除在特定情况下具有自我更新特性和潜在分化能力外,也具备一定免疫调节的作用,被普遍认为是一种治疗各种免疫疾病的潜在药物[4]。现已有实验证实骨髓间充质干细胞(bone marrow mesenchymal stromal cells , BM-MSCs)可以用于治疗多种自身免疫性疾病,其中就包括BM-MSCs用于SS的治疗[5-6]。而脐带间充质干细胞(umbilical cord mesenchymal stem cells , UC-MSCs)具备来源丰富,且较容易获取和被大众接受的特点,将来可能成为BM-MSCs的替代物,用作自身免疫性疾病的治疗研究。但目前UC-MSCs在SS中是否发挥以及怎样发挥控制作用尚不完全清楚,故本研究将提取SS患者外周血的单核细胞与UC-MSCs进行共培养,观察其对SS治疗的作用和机制。
1 对象与方法
1.1对象 经过初筛比对2018年1月至2018年12月内蒙古科技大学包头医学院第一附属医院风湿免疫科就医患者的检查记录,选取20例疾病活动期的SS患者作为试验对象,试验对象满足:(1)对照美国风湿病学会/欧洲抗风湿病联盟(ACR/EULAR)[7]联合发起的原发性干燥综合征分类新标准(2016版)合格。未见其他免疫系统疾病,且被诊断为pSS的;(2)EULAR干燥综合征疾病活动指数(ESSDAI)评分>8分;(3)年龄在20 ~70岁;(4)能配合完成检测,临床资料记录完整有效。实验组研究对象排除标准如下:具有头颈部放射病史、PCR检测确诊丙肝病毒感染(活动性)的;患良性淋巴肉芽肿病和AIDS的;以及确诊GVHD、苔藓样和皮疹淀粉样变、IgG4相关性疾病的。征求待产妇及家属知情同意后,由包头医学院第一附属医院妇产科提供足月顺产或剖宫产的健康产妇新生儿脐带。无菌条件下取脐带15 ~20 cm。HBV、HCV、HIV及EB化验结果全部阴性。新生儿脐带离体后放置在50 mL的无菌PBS缓冲液中浸泡。
1.2材料与试剂 DMEM/F12培养基、双抗、胰蛋白酶、胎牛血清(FBS)、磷酸盐缓冲液(PBS)采购自Gibco公司(美国);人外周血淋巴细胞分离液购于灏洋华科生物科技有限责任公司(天津);CD11C-PE、CD34-PE、CD44-PE、CD45-FITC、CD90-FITC、CD105-FITC以及同型对照均购自BD公司(美国);CCK-8试剂盒购于碧云天生物科技有限公司(上海);6-color TBNK Reagent试剂盒购自BD公司(美国);PMA购自联科生物技术股份有限公司(杭州);流式细胞仪BD FACSCantoTM Ⅱ型购自BD公司(美国);酶标仪购自雷杜公司(美国)。
1.3实验方法
1.3.1UC-MSCs的分离与培养 在无菌环境下操作取出新生儿脐带组织,放置在超净台内用含有青链霉素的PBS缓冲液洗涤至无残血。剔除组织上脐动静脉,并剥离出凝胶状的华通氏胶,用组织剪将其分解成1 mm3的样块备用。将分解好的样块接种到DMEM/F12培养基(内含体积分数为10%胎牛血清和体积分数为1%双抗)的培养皿中,37 ℃的孵箱(体积分数5% CO2)中培育,培养液3~4 d置换1次。细胞培育至80%~90%,胰蛋白酶消化传代培养,取第2代UC-MSCs进行后续实验。
1.3.2流式细胞术鉴定UC-MSCs 将培养获得的第2代UC-MSCs消化制备成单细胞悬液,取鼠抗人CD11C、CD34、CD44、CD45、CD90、CD105单克隆抗体各5 μL加入细胞悬液。室温避光孵育0.5 h。PBS洗涤并重悬,之后上流式细胞仪检测UC-MSCs表面蛋白表达。
1.3.3密度梯度离心法提取SS患者的PBMCs 取全血和PBS各2 mL等体积混匀缓慢加入到淋巴细胞分离液上层,淋巴细胞分离液与被分离液体积为1∶2,2 000 r/min离心20 min,用吸管取出离心后位于中间的白膜层,加入PBS吹打至完全混合;1 500 r/min离心7 min,倒掉上层液体,加入PBS重复吹打至完全混匀;1 500 r/min离心7 min,弃去上清液,细胞沉淀备用。
1.3.4CCK-8筛选UC-MSCs与PBMC共培养的最佳比值 取2代UC-MSCs,消化计数接种96孔板,待细胞完全贴壁后弃上清,加入PBMC,UC-MSCs与PBMC的比例分别为105∶103、104∶103、103∶102、102∶102、101∶102、102∶103、103∶104、103∶105,分别加入终浓度为(1μM)的刺激因子PMA,共培养24 h后,每孔加入10 μL CCK-8试剂,37 ℃恒温下孵育2 h,450 nm处后测量吸光度(A)值,计算出细胞存活率,公式如下:存活率=(实验组A值-空白孔A值)/(对照组A值-空白孔A值)×100%。每组5个复孔。
1.3.5UC-MSCs与PBMCs共培养及淋巴细胞亚群的检测 UC-MSCs与PBMC两者的细胞浓度比为103∶102,接种6孔板。实验分为2组:PBMC+刺激因子PMA组(P+P)、PBMC+UC-MSCs+PMA组(P+P+M),共培养24 h、48 h,流式细胞术检测CD3+、CD3+CD4+、CD3+CD8+、CD19+、CD16+CD56+淋巴细胞亚群的比例。
2 结果
2.1UC-MSCs的形态以及UC-MSCs表面标志物的表达
2.1.1UC-MSCs的形态 贴壁培育法培养初代组织,细胞呈梭形或三角形,分散于整个培养皿中,平铺生长。间充质干细胞在经过2代培养后,细胞为长梭形,整体为旋涡状,显微镜下观察细胞纯净均一,数量丰富。见图1。
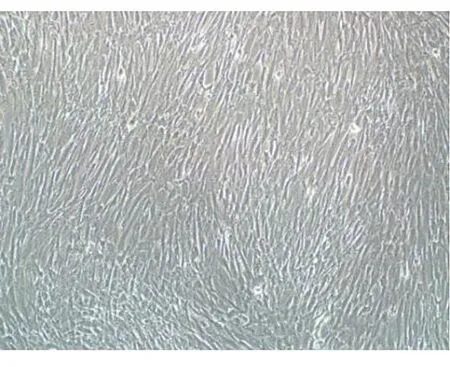
图1 UC-MSCs生物显微镜下细胞形态学观察
2.1.2UC-MSCs表面标志物的表达 标志物CD105表达率96.90%、CD90表达率99.80%、CD44表达率为91.30%;阴性标志物CD34、CD45及CD11C的表达率为0.10%、0.10%、0.00%。见图2。

图2 UC-MSCs流式细胞仪检测细胞表型结果
2.2CCK-8法检测UC-MSCs与PBMC共培养后,PBMC的增殖情况 UC-MSCs∶PBMC按比例为105∶103、104∶103、103∶102、102∶102、101∶102、102∶103、103∶104、103∶105分别共培养24 h后,细胞存活率分别为32.50%、39.59%、68.30%、24.84%、15.67%、24.26%、23.99%、68.30%。与103∶105比较,103∶102细胞存活率最高,用作后续实验培养,差异有统计学意义(P<0.01)。见图3。

图3 CCK-8法筛选UC-MSCs生长的最适浓度
2.3流式细胞术检测UC-MSCs和PBMCs共培养后淋巴细胞亚群的变化 记录流式细胞术检测UC-MSCs和PBMCs共培养后淋巴细胞亚群比例。CD3+T细胞、CD3+CD8+T细胞、CD19+B细胞的比例减少(P<0.05),CD16+CD56+NK细胞的比例、CD3+CD4+T细胞的比例、CD4+/CD8+无明显变化(P>0.05)。见图4。
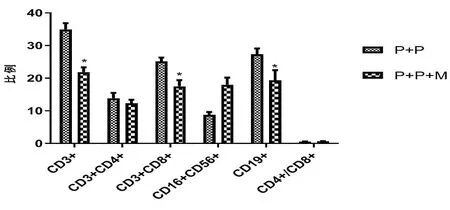
图4 流式细胞仪检测UC-MSCs和PBMCs
3 讨论
目前SS的发病机制尚不完全明确,近年来多项研究表明SS的发病与T细胞亚群相关。在SS患者的唾液腺中有大量CD4+T和B细胞浸润,早期大部分为CD4+T细胞,而B细胞的积累发生在疾病后期[8]。活化的T细胞通过产生促炎细胞因子和诱导B细胞活化介导了疾病的发生发展[9]。有研究显示,与健康人相比,SS患者CD8+T细胞比例升高,CD3+T细胞和CD4+T细胞比例降低[10]。本实验将SS患者外周血T细胞与UC-MSCs共培养后,患者外周血杀伤性T淋巴细胞和抑制性T细胞百分比降低,而辅助性T细胞变化无意义。杀伤性T细胞和抑制性T细胞可积极参与到调节SS患者的自身免疫过程中,能够改变SS患者唾液腺组织病理的表达[11]。我们的研究发现UC-MSCs细胞对SS患者免疫T细胞的作用体现于UC-MSCs能够抑制T细胞的表达,本实验结果补充证实了UC-MSCs通过调节T细胞的百分比,或可发挥缓解SS患者疾病进展的作用。
SS患者存在的B淋巴细胞过度活化情况,可作为诊断疾病的特殊标志[12]。B细胞表面抗原标记物表达量和表型产生改变,导致其作用能力发生偏倚,从而引起免疫异常反应[13]。本实验还观察到经过共培养处理的SS患者外周血CD19+表达量回归正常,这表明UC-MSCs可以抑制SS患者外周B细胞功能。后续研究可继续深入探究UC-MSCs对其它表型B细胞的激励反馈过程。
虽然MSCs的免疫抑制能力已在几种自身免疫性疾病中得到证实,如RA、SLE和EAE[14-15],但距离真正将UC-MSCs的免疫调节能力应用在临床上还有很长的路要走。本研究结果证实了人体UC-MSCs可抑制SS患者外周血杀伤性T淋巴细胞和抑制性T淋巴细胞,并降低CD19+表达量,可在强化治疗中起到应用。但是UC-MSCs在体外对SS患者的具体作用机制还不明确,也没有得到动物实验验证,UC-MSCs对不同表型的T细胞产生的抑制能力差异仍不清楚。这些疑问将在后续研究中进一步分析。
