乳腺乳头状癌病理亚型病例影像特征与常见免疫组化指标的关系
2024-02-26周成礼郭吉敏汤红平
周成礼,郭吉敏,刘 阳,汤红平
(1.汕头大学医学院,广东汕头 515041;2.南方医科大学附属深圳市妇幼保健院超声科;3.南方医科大学附属深圳市妇幼保健院放射科;4.南方医科大学附属深圳市妇幼保健院病理科)
乳腺乳头状癌是乳腺癌中较为少见的一种类型,从分子学水平看,乳头状癌细胞发生发展与正常乳腺细胞的发育存在相似性,也同样会受到诸如雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER-2)和细胞增殖核抗原(Ki-67)等生物学因子的调控[1-2]。ER、PR、HER-2及Ki-67为常见的免疫组化(IHC)指标,而超声(US)、乳房X线摄影(MG)和磁共振成像(MRI)是常见的影像学检查方法。有学者认为影像学与乳腺癌免疫组化指标变化有着密切的联系[3]。但国内外对乳头状癌病理亚型病例影像特征与免疫组化指标关系的研究却并不多,故本文将探讨乳头状癌亚型病例影像特征与ER、PR、HER-2及Ki-67等生物学因子表达的关系,为乳头状癌亚型病例的治疗和预后提供影像学参考。
1 资料与方法
1.1临床资料 回顾性分析深圳市妇幼保健院2012年1月16日至2021年12月20日病理确诊的1 802例乳腺癌病例。按以下纳/排标准进一步筛选病例。纳入标准:(1)病理诊断乳腺乳头状癌并有IHC检查结果;(2)具有乳腺US和/或MG和/或MRI影像学检查;(3)临床相关资料完整;(4)入院前未接受任何放化疗治疗。排除标准:(1)合并严重的乳腺炎;(2)合并其他严重器质性疾病或恶性肿瘤。本研究共纳入47例乳腺乳头状癌,共49个病灶,全部患者均有US检查,45例完成了MG检查,14例完成了MRI检查。根据空心针活检或真空旋切术后定位和病理结果,进行病理-影像对照:US确定乳头状癌病灶47个,MG确定乳头状癌病灶42个,MRI确定乳头状癌病灶16个。依据世界卫生组织最新的乳头状癌组织学分型[4],没有收集到伴导管原位癌的导管内乳头状瘤亚型,47例被分为4个亚型组,乳头状导管原位癌(pDCIS)、包裹性乳头状癌(EPC)、实性乳头状癌(SPC)和浸润性乳头状癌(IPC)。该研究获得本单位医学伦理委员会批准,免除受试者知情同意,记录患者相关临床资料。
1.2方法
1.2.1影像检查
1.2.1.1US检查 采用Phiipsi EPIQ5型(飞利浦,荷兰)和SiemensS2000型(西门子,德国)超声诊断仪,探头频率7~10 MHz,常规选用7 MHz检查乳腺,调节机器处于乳腺的检查条件下。检查时患者处于仰卧位,对乳腺进行横、纵、斜等常规多切面扫查,以先乳头后边缘、先放射状后上下左右的顺序进行各个象限扫查,不漏掉每个角落。对病灶部位再多切面、多角度重点扫查。依据乳腺BI-RADS评估标准记录肿块的形态大小、边缘及比邻关系、彩色多普勒血流图等相应数据。
1.2.1.2MG检查 采用飞利浦乳腺X射线机,型号为MicroDose SI。患者站立位,面对技师。常规投照体位包括头尾位和内外斜位,酌情可用侧位替代内外斜位。头尾位:患者面对乳腺机,身体外转5°~10°,调节检查台至患者乳腺下缘转角处,乳腺置于检查台中央后用压迫板压迫固定投照。内外斜位:患者面对乳腺机,稍微外转,乳腺和同侧腋前皱襞置于检查台上,检查台边缘贴近腋中线,压迫固定后投照。侧位:分为内外位和外内位,机架转角为±90°投照。投照过程中,注意压迫板边缘应贴着胸壁向下压迫,尽量包全乳腺基底部组织。投照完成后,记录肿块形态、大小、边缘、密度、钙化等。
1.2.1.3MRI检查 采用飞利浦Achieva 1.5T双梯度MR扫描仪。使用乳腺专用线圈,采用俯卧位扫描,两乳房根据重力自然下垂到乳腺线圈里,周围皮肤不要有皱褶。启动MR扫描仪对乳房进行T1WI横轴位扫描、T2WI横轴位扫描、T2WI-FS(脂肪抑制)横轴位扫描、DWI弥散横轴位扫描、DCE动态增强序列横轴位扫描等序列扫描。完成扫描后由2名高级职称技师和医师处理图片,计算ADC值,绘制增强曲线图等[5]。
1.2.2IHC检测及判断标准 (1)固定、脱水、包埋:取组织放入4%多聚甲醛固定3~4 h,取适当大小组织放入包埋盒中进行脱水,用浸蜡后的包埋盒包埋组织。(2)切片、制片:打开切片机,固定蜡块,切片,烤片30 min。(3)组织化学染色:室温脱蜡、水化,热抗原修复,免疫组化笔画圈,DAB溶液染色,苏木素复染,中性树胶封片。IHC结果依据乳腺癌诊疗指南(CSCO)和美国临床肿瘤学会(ASCO)检测指南[6],光镜观察到细胞核显示棕黄色时认定为ER、PR、Ki-67阳性表达,判断标准为:阳性细胞数>1%为阳性,1%<阳性细胞数≤10%为1+,10%<阳性细胞数≤30%为2+,阳性细胞数>30%为3+。Ki-67<14%为低表达,Ki-67≥14%为高表达。通过光镜观察到细胞膜显示棕黄色颗粒时为Her-2阳性,无着色为阴性,判断标准为:Her-2为0或1+时视为阴性,3+时视为阳性,当Her-2为2+时,需加做FISH检测来判断Her-2基因是否扩增。
1.3图像分析及解读 由2名乳腺疾病诊断经验丰富的影像专业医师独立进行图像分析,意见不一致时商讨统一。评估及记录乳腺超声、MG及MRI检查中病变的影像特征。钙化类型:良性钙化(粗大、圆形、点状、短棒状、光滑蛋壳状、光滑环状等)和可疑钙化(细小、线样、泥沙样或细分支钙化、不规整不均质钙化等)。钙化分布:良性分布(散在、弥漫、区域分布等)和非良性分布(簇状、线样、段样分布等)。结构紊乱:非对称性致密、结构扭曲、片状或团状不均密度影等。
2 结果
2.1乳头状癌病理亚型US影像特征与ER、PR、Her-2、Ki-67表达的关系 47例乳头状癌亚型病例US检查发现肿块42例、非肿块5例。在ER、PR表达中,4个亚型US影像特征比较差异无统计学意义(P>0.05),42例肿块的ER、PR阳性表达率分别达97.6%(41/42)、88.1%(37/42)。Her-2阴性表达率为88.1%(37/42)。在Her-2表达中,pDCIS组肿块后方回声改变存在统计学差异(P=0.039),其他亚型的US影像特征在Her-2表达比较中差异无统计学意义(P>0.05)。EPC肿块直径、IPC组肿块后方回声改变在Ki-67表达中存在统计学差异(P=0.037,P=0.039),其他亚型及影像特征在Ki-67表达中差异均无统计学意义(P>0.05),pDCIS、EPC、SPC、IPC亚型的Ki-67阳性表达率分别为30.8%(4/13)、55.6%(5/9)、55.6%(5/9)、54.5%(6/11)。见表1。
2.2乳头状癌病理亚型MG影像特征与ER、PR、Her-2、Ki-67表达的关系 研究人群中,MG检查有45人,发现肿块和非肿块分别为26例和16例(各亚组中,肿块和非肿块分别是pDCIS组6例和10例、EPC组6例和1例、SPC型6例和3例、IPC组8例和2例),3例MG检查正常。在ER、PR、Her-2表达中,4组亚型MG影像学特征关系比较无统计学意义(P>0.05),但各亚型ER、PR阳性表达的患者人数均多于阴性表达者,26例肿块的ER、PR阳性表达率分别为96.2%(25/26)和80.8%(21/26);Her-2阴性表达率为96.2%(25/26)。在Ki-67表达的比较中,SPC亚型在钙化分布方面存在统计学差异(P=0.048),其他亚型在Ki-67表达中差异均无统计学意义(P>0.05),26例肿块的Ki-67阳性和阴性表达率分别为53.8%(14/26)及46.2%(12/26)。见表2。
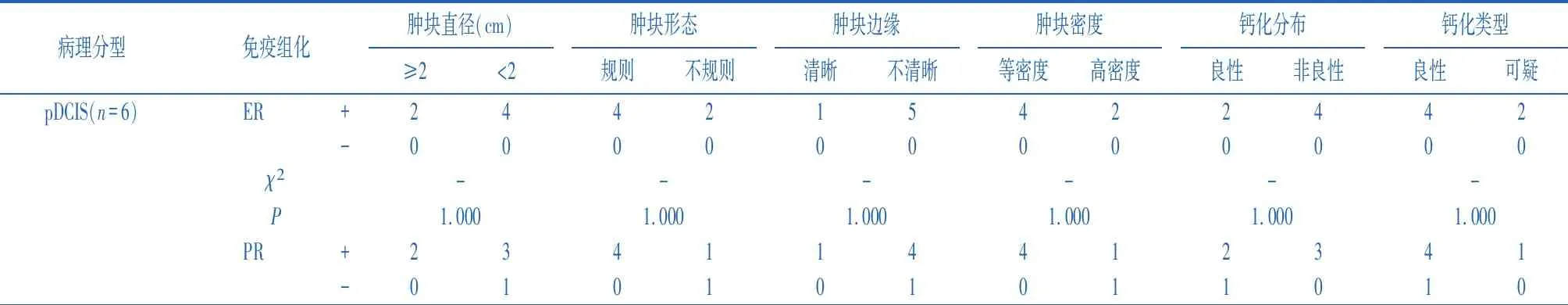
表2 乳头状癌病理亚型MG影像特征与ER、PR、Her-2、Ki-67表达的关系
2.3乳头状癌病理亚型MRI影像特征与ER、PR、Her-2、Ki-67表达的关系 14例经MRI检查的乳头状癌亚型病例中发现肿块病灶13个、非肿块病灶3个。乳头状癌病理分型及MRI影像学特征在ER、PR、Her-2及Ki-67表达中比较差异均无统计学意义(P>0.05),13例肿块的ER、PR阳性表达率分别为100%(13/13)及84.6%(11/13);Her-2阴性表达率达76.9%(10/13)。pDCIS亚型Ki-67阳性表达人数均低于阴性表达者,pDCIS亚型ADC值>1.10×10-3mm2/s居多,SPC亚型以ADC值≤1.10×10-3mm2/s为主。见表3。

表3 乳头状癌病理亚型MRI影像特征与ER、PR、Her-2、Ki-67表达的关系
3 讨论
ER和PR在乳腺腺管和腺泡细胞生长发育方面起着重要作用,同时乳腺腺管和腺泡细胞自身也可以分泌雌孕激素并促进其生长发育[7];即使腺管或腺泡细胞发生癌变,还有部分癌变细胞分泌ER和PR并受到其影响。ER、PR在分子层面表达的水平与癌细胞分化程度存在正相关,ER、PR的表达水平越高则预后越好;Her-2过度表达将导致癌细胞的增殖,Her-2表达水平与乳腺癌的恶性程度正相关[8]。Ki-67高表达可预测肿瘤增殖、侵袭和转移[9]。乳头状癌虽然是乳腺癌较少见的特殊类型,但同样受到ER、PR、Her-2、Ki-67等的调控和影响。
我们的研究发现,乳腺乳头状癌4个亚型的US影像特征在ER、PR表达中差异无统计学意义(P>0.05),但其ER、PR阳性表达率分别高达97.6%(41/42)和88.1%(37/42)。在Her-2表达中,pDCIS亚型肿块后方回声改变存在统计学差异(P<0.05),后方回声无改变与Her-2阴性表达相关;Her-2阴性表达率高达88.1%(37/42),分析原因可能与大多数乳头状癌的病理组织学分级低有关。我们的研究发现,EPC亚型肿块大直径、IPC亚型肿块后方回声衰减与Ki-67的阳性表达相关,Cheng等[10]认为直径大的肿块、肿块回声衰减等对Ki-67有独特的预测价值,与我们的研究结果一致;pDCIS亚型Ki-67阳性表达率(25.0%)明显低于其阴性表达率(75.0%),说明pDCIS亚型癌细胞增殖活跃度较低,这与其较低病理分级和分期相吻合。
我们的研究显示,4个亚型的MG影像特征在ER、PR、Her-2表达中没有关系,但45病例ER、PR阳性表达的患者人数均高于阴性表达者,ER、PR阳性表达率分别为91.1%(41/45)和77.8%(35/45);Her-2阴性表达率高达96.2%(25/26)。SPC亚型的钙化分布特征在Ki-67表达中存在统计学差异(P<0.05),SPC非良性钙化分布与Ki-67高表达相关,其他亚型的MG影像学特征与Ki-67表达无关。
在我们的研究中,4个亚型的MRI影像特征与ER、PR、Her-2及Ki-67表达均无关,出现这种状况可能与我们的MRI检查病例少、乳腺乳头状癌病理分级低等因素有关。与US、MG类似,MRI检查13例肿块中,ER、PR阳性表达率分别为100%(13/13)及84.6%(11/13),相反,Her-2阴性表达率达76.9%(10/13)。Piscuoglio等[6]认为乳腺乳头状癌亚型以ER和PR阳性为主,缺乏Her-2基因扩增,这与我们的研究结果相同。Ki-67表达可覆盖除G0期以外的各增殖周期细胞,Ki-67表达阳性提示癌细胞增殖活跃[11],我们的研究显示,边缘不清或毛刺征象在IPC亚型的Ki-67阳性表达率为75.0%(3/4),而pDCIS亚型Ki-67阳性表达率为0(0/4),这与IPC、pDCIS的病理TNM分期为G1和G0期特征相吻合。一般ADC值>1.10×10-3mm2/s为良性表现可能性大,≤1.10×10-3mm2/s为恶性表现可能性大。pDCIS亚型ADC值≤1.10×10-3mm2/s的Her-2阳性表达率为25.0%(1/4),而SPC亚型ADC值≤1.10×10-3mm2/s的Her-2阳性表达率为100%(2/2),这与SPC亚型MRI的恶性表现高于pDCIS亚型相一致。
综上所述,乳腺乳头状癌是一种以ER、PR阳性表达为主的乳腺癌,Ki-67、Her-2阳性表达提示肿瘤细胞增殖活跃。我们的研究发现,超声显示EPC亚型肿块直径≥2 cm及IPC亚型肿块后方回声衰减与Ki-67阳性表达存在联系。Ki-67阳性表达与SPC亚型钙化非良性分布的MG影像特征相关。这些影像特征对判断乳腺乳头状癌生物学特性有一定的帮助作用,可协助临床预测患者的预后。
