EPS及消毒剂对细菌表面附着和初期生物膜形成的影响
2024-02-26钟疏影陈国炜蔡寅诺
钟疏影,余 超,陈国炜,蔡寅诺,刘 丽
(合肥工业大学土木与水利工程学院,安徽合肥 230009)
目前的氯消毒机制能够控制饮用水配水系统(drinking water distribution system,DWDS)中出现的绝大多数病原体,但是生物膜在DWDS中可以通过容纳病原体、提供营养物质和保护病原体免受消毒剂胁迫的方式,促进病原体在系统内的生存和传播[1]。同时,主体水和生物膜中存在大量的有机物,降低了系统内消毒剂的功效和游离氯的残留[2]。而消毒剂及其副产品在DWDS的滥用也可能会诱导细菌发生突变,致使致病菌和抗性细菌在系统内的广泛传播[3]。
胞外聚合物(extracellular polymeric substances,EPS)在微生物生存中起到了极大的作用。生物膜能够通过捕获和浓缩环境营养物质形成EPS的方式,进而增加生物膜对抗消毒剂和水动力的能力[1,4]。而EPS中存在的酶(如过氧化氢酶和超氧化物歧化酶)与氧化剂类和醛类的消毒剂会发生酶促反应,导致消毒剂活性的降低[5]。一旦EPS的黏附强度被外部剪切力、氯化和机械应力等环境压力破坏,会使得细菌从生物膜释放到水中,进一步导致系统内水质的污染[6]。
EPS的生成(包括其组成和含量)往往会受水动力、消毒剂种类与浓度等条件的影响。当生物膜在系统内接触消毒剂后,水动力会强化生物膜对消毒剂的传质效应,加速消毒剂与生物膜的反应[7]。此外,DWDS中游离氯的残留质量浓度应保持在0.5~1 mg/L,然而这种残留浓度不足以阻止系统内生物膜的生长和发育[8]。研究[9]表明,次氯酸钠对DWDS中生物膜实现了极高的生物膜杀灭率,然而极高的次氯酸钠浓度反而会降低对生物膜的去除效率,从而使得生物膜重新接种。此外,一氯胺更善于穿透生物膜结构,因为它不受消毒剂扩散限制的影响[10]。但是,一氯胺也被证实能够促进硝化反应的发生,体系内存在的亚硝酸盐可与氯胺发生反应,促进生物膜的发展,影响管网的水质。
尽管如此,目前有关EPS及消毒剂对细菌表面附着及其初期生物膜形成的影响机制尚不清晰。因此,本文以铜绿假单胞菌和藻酸盐分泌过量的突变体为研究对象,通过静态尝试解析短期的消毒剂条件如何调节生物膜EPS的分泌和生物膜特征的变化,进而干预细菌的表面附着行为,为进一步研究DWDS中消毒剂影响下生物膜相关病原体的风险评估和控制提供参考。
1 材料与方法
1.1 试验准备
1.1.1 菌株准备
本文采用两种菌株:野生型铜绿假单胞菌(wild-type PAO1)和突变型铜绿假单胞菌(PAO1,ΔmucA),敲除mucA基因的突变型铜绿假单胞菌菌种由中国科学院微生物研究所提供。两种菌株使用菌液、甘油和生理盐水(体积比为2∶1∶1)混合后于-4 ℃下冷冻保存。在试验前,需要将其进行活化处理。首先,使用移液枪吸出融化成液态的菌种,并将其加入到经过灭菌处理后的50 mL的LB培养基中。将培养基置于37 ℃的恒温培养箱(DNP-9162-1A,名宸,合肥)中,在摇床(转速为150 r/min)上培养16~18 h,保证细菌的充分活化。然后取10 mL活化好的菌液(37 ℃,培养16~18 h)加入到灭菌处理过的50 mL离心管中,在离心机(5810R,Eppendorf,德国)中进行离心重悬浮处理后,将10 mL的生理盐水加入装有菌种的离心管内,制成试验使用的菌液。利用分光光度计(UV-2600,尤尼柯,上海)测定菌液的吸光度,利用生理盐水调节菌液吸光值(OD600)为0.5±0.02,对应细菌菌落形成单位(colony forming units,CFU)约为2×108CFU/mL[11]。
1.1.2 消毒剂制备
取1 mL高质量浓度次氯酸钠母液(100 g/L)溶于99 mL的去离子水中,制得1 g/L低质量浓度次氯酸钠溶液。其需要装入棕色药瓶密封保存,2~5 ℃下可保持一个月的有效期,每次使用前应使用余氯仪测定浓度,保证准确。
1.1.3 试验装置准备
试验反应器使用12孔板作为生物膜培养装置,在使用前对试验用品进行消毒处理。将12孔板和聚氯乙烯(PVC)与不锈钢(STS)载片(2 cm×2 cm)在紫外灯光下照射至少30 min;培养基和磷酸盐缓冲溶液(PBS溶液)使用高温高压灭菌(121 ℃、0.01 MPa)20 min、紫外消毒30 min后,置于超净台冷却备用。
1.2 试验设置
为了探究消毒剂胁迫对微生物EPS影响和生物膜形成的机制,本试验选用了两种细菌——野生株和突变株,设置了4种消毒剂条件(0.5、1.0、2.0、3.0 mg/L),并控制其他环境变量保持不变,包括环境温度为23 ℃、营养条件为1∶50 LB培养基。具体试验过程如下:首先,准备8个12孔板(编号1~8),在编号1~4的孔板中添加PVC载片,在编号5~8的孔板中添加STS载片。随后,在孔板每个孔中加入2 mL的1∶50 LB培养基,同时将事先制备好的两种细菌的菌种悬浮液向孔板每个孔中对应各加入20 μL。最后将每个孔板放置在37 ℃的恒温箱中进行培养,每天重复投加营养保持浓度为1∶50,生物膜培养时间共7 d。
当生物膜培养结束后,在12孔板中分别投加0.5、1.0、2.0、3.0 mg/L的次氯酸钠溶液,对附着在载片表面的生物膜进行处理。2 h之后将12孔板中的PVC和STS载片取出。
1.3 分析方法
1.3.1 生物膜提取
当消毒剂处理结束后,在无菌操作台对PVC与STS载片进行处理,用无菌PBS溶液(pH值=8)冲洗,以去除表面上存在的未附着细菌。然后用无菌棉签在PVC管内壁上反复刮取生物膜,并反复擦拭10~30次,放入含有3 mL生理盐水的离心管中。使用超声机(KQ5200DE,舒美,昆山)对离心管进行超声处理10 min后取出,以确保拭子内的生物膜被震落到溶液中,从而获得生物膜悬浮液。
1.3.2 生物量的测定
使用分子探针LIVE/DEAD细菌活性试剂盒(赛默飞世尔科技,美国)来区分生物膜样品中的活细胞和死细胞[12]。染色液的配置过程如下。首先在3.0 mL生理盐水中加入3 μL 碘化丙啶(PI,2 mmol)和3 μL 绿色荧光核酸染料(SYTO 9,0.33 mmol)制备染色液。然后将100 μL的染色液滴加到3 mL的生物膜悬浮液中,并进行避光染色30 min。将染色后的生物膜悬浮液通过直径为25 mm、孔径为0.22 μm的黑色聚碳酸酯膜[13],将夹带细菌的滤膜置于荧光显微镜(LX73,奥林巴斯,日本)下观察,随机选择10个视野进行200倍的细菌计数。根据至少20个视场的计数,估计每张膜上有活力和无活力的细菌数量。
1.3.3 EPS的测定
EPS提取采用水浴加热法,将样品置于80 ℃下水浴加热30 min,再通过0.22 μm滤膜过滤,滤液即为待测溶液。多糖采用蒽酮法,在625 nm波长下用紫外分光光度计(UV-2600,尤尼柯,上海)测定各待测液分光光度值,用葡萄糖作标准曲线;蛋白采用 Folin-Lowry法,在750 nm波长下用紫外分光光度计测定各待测液分光光度值,用牛蛋白血清作标准曲线[14]。
1.3.4 原子力显微镜(AFM)
使用无菌PBS溶液(pH值=8)冲洗表面的悬浮细菌后,将2 mL 0.5%戊二醛溶液放在载体表面2 h,然后用PBS溶液冲洗去除表面未反应的戊二醛[15]。试验过程使用了弹簧常数为0.02~0.14 N/m的清洁硅探针AFM悬臂梁(BL-AC40TS-C2,奥林巴斯,日本),而悬臂梁的弹性常数是通过热噪声法确定的,弹性常数为0.772 8 N/m。生物膜表面力的回归曲线被用来评估生物膜的黏附力,通过使用接触模式从载体表面的不同位置收集力与距离的曲线,并通过舍弃每组数据的异常值来分析生物膜黏附力,最终获得20个点位的生物膜黏附力信息。
1.3.5 生物膜粗糙度的测定
从反应器中取出样品,使用无菌PBS溶液(pH值=8)冲洗表面的悬浮细菌。在使用AFM(Multimode 8,布鲁克,德国)数据分析载体表面的生物膜形貌之前,应使用Flatten方法去除成像中产生的噪声。使用Flatten方法处理的图像显示了更多的表面信息,也可以区分更多的表面形貌变化和孔隙结构。生物膜的表面粗糙度通过平均粗糙度进行评估[16]。
2 结果和讨论
2.1 EPS和消毒剂对铜绿假单胞菌附着行为的影响
图1显示了两种菌株在PVC与STS表面附着和受不同消毒剂浓度胁迫后的生物量变化结果。试验结果显示,适度的消毒剂浓度促进了突变株在载体表面的附着。具体而言,在1.0 mg/L和2.0 mg/L质量浓度的消毒剂条件下,突变株在PVC表面附着的生物量分别为2.36×106cells/cm2和2.25×106cells/cm2,与初始阶段相比生物量分别增大至1.26倍和1.20倍。继续增大消毒剂质量浓度(3.0 mg/L),PVC表面附着的生物量减小了0.72×106cells/cm2,相较于初始阶段减小了1/5。而野生型在两种基质表面受到消毒剂影响下生物量均呈现出了减小的趋势。具体而言,在3.0 mg/L的消毒剂影响下,野生型在STS表面附着的生物量由初始阶段的4.1×105cells/cm2降低到了1.8×105cells/cm2。这说明高浓度的消毒剂对生物膜在基质表面的形成极为不利。而不同管材也影响了两种菌株生物膜在表面的附着。以突变株为例,在两种基质表面附着的初始生物量分别为1.88×106cells/cm2和1.0×106cells/cm2,突变株在PVC表面的生物量是在STS表面的1.88倍,这说明两种铜绿假单胞菌在PVC上相较于在STS上存在更大的附着优势。究其原因,可能是PVC在水环境中产生的有机物能够与消毒剂产生反应,从而对表面附着的生物膜产生了保护效应[17]。
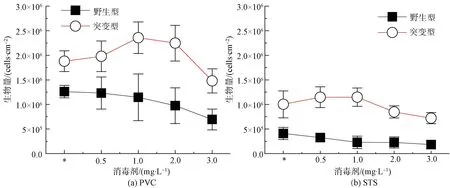
注:*表示初始附着生物量。
2.2 消毒剂对细菌EPS生成的影响
图2显示了在初始条件和不同消毒剂浓度条件下两种铜绿假单胞菌在载片表面的EPS含量。结果显示,随着消毒剂浓度的增大,两种菌株在各基质表面的EPS含量均呈现出先增大后减小的趋势。以PVC表面附着的突变体为例,在低质量浓度消毒剂(0.5、1.0 mg/L)影响下,基质表面的EPS含量分别为29.31 μg/lg(cells)和35.12 μg/lg(cells)。继续增大消毒剂质量浓度(3.0 mg/L),基质表面的EPS含量为27.26 μg/lg(cells),相较于初始阶段减小了1/7。而突变体在1.0、2.0 mg/L的消毒剂质量浓度影响下,PVC表面的EPS含量分别为35.12 μg/lg(cells)和33.49 μg/lg(cells),这一结果与图1的生物量变化趋势相一致。这说明消毒剂在一定程度上促进了细菌分泌更多的EPS以抵抗环境的影响[18]。

注:*表示初始阶段生物膜EPS含量。
同时,基质特性也影响了两种菌株所形成生物膜EPS的生成,特别是胞外多糖的形成。以野生型为例,初始阶段STS和PVC表面的胞外多糖分别为1.77 μg/lg(cells)和7.54 μg/lg(cells),胞外多糖增大了近3.26 倍。这一结果说明两种菌株在PVC表面会分泌更多的胞外多糖,目前研究[19]表明,PVC等塑料管道能够释放大量的有机碳化合物,为细菌提供了充足的营养物质,进而促进细菌在PVC表面的附着。
2.3 消毒剂浓度对生物膜表面粗糙度和力学特征的影响
图3为两种铜绿假单胞菌在初始阶段和不同消毒剂浓度影响下的生物膜黏附强度。试验结果显示,适度增大的消毒剂浓度强化了生物膜的黏附强度。具体而言,初始阶段在PVC表面的突变株生物膜黏附力为21.52 nN。当处在消毒剂质量浓度为1.0 mg/L的环境后,生物膜的黏附力增大至1.51 倍。继续增大消毒剂质量浓度(3.0 mg/L),生物膜黏附力降低到了24.52 nN,但相较于初始阶段仍存在一定程度的提升。同时,由图3结果显示,1.0 mg/L的消毒剂质量浓度对STS表面生物膜的黏附强度提升最为显著。以STS表面的生物膜黏附力为例,野生型与突变株的初始阶段黏附力分别为2.01 nN和10.11 nN。当投加1.0 mg/L质量浓度消毒剂后,STS表面两种菌株的黏附力分别增大为4.34 nN和17.12 nN。究其原因,可能是由于生物膜的EPS与外界高浓度的消毒剂发生反应,进而降低了生物膜的黏附强度[20]。
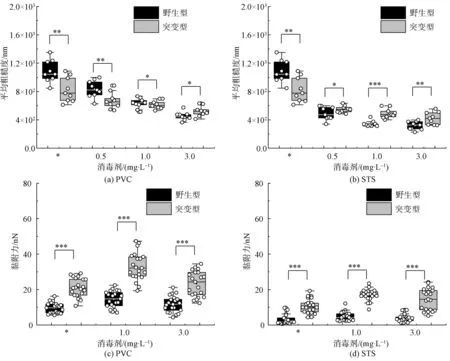
注:*表示初始附着生物膜粗糙度和黏附力。
生物膜粗糙度能够通过强化生物膜对水环境内微生物的拦截效应来促进细菌的表面聚集和生物膜的形成。因此,为了解析消毒剂对生物膜表面特征的影响,试验基于AFM分析了不同消毒剂浓度处理下的生物膜粗糙度变化。图4显示了在初始条件和3种消毒剂浓度条件下两种铜绿假单胞菌在载片上的生物膜表面特征。同时,图3为基于AFM图对生物膜粗糙度进行评估所得的平均粗糙度。由初始结果显示,突变体形成的生物膜相较于野生型更为光滑。由图3的粗糙度评估结果显示,初始阶段野生型与突变株铜绿假单胞菌的生物膜表面粗糙度分别为1 087 nm和842 nm。不断增大消毒剂浓度也降低了两种菌株表面的粗糙度,以1.0 mg/L的消毒剂质量浓度影响下的试验结果为例,PVC上两种菌株生物膜粗糙度分别为614 nm和634 nm。继续增大消毒剂质量浓度(3.0 mg/L)后,PVC上野生型与突变株的生物膜粗糙度分别减小到了427 nm和527 nm,相较于初始阶段分别下降了约3/5和2/5。这说明藻酸盐过量分泌的突变体相较于野生株具备更强的抵抗能力,而在消毒剂胁迫下EPS的分泌也起到了维持生物膜表面特征和形态结构的作用[21]。
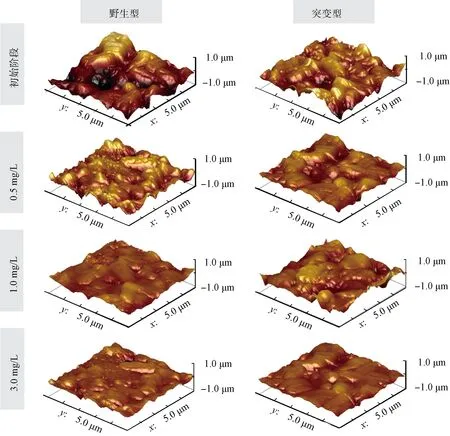
图4 不同消毒剂浓度下野生型铜绿假单胞菌和突变株在PVC表面附着生物膜的AFM图(2 h)
3 结论
(1)结果表明,相较于野生型,突变型的生物膜形成优势显著。特别是当氯质量浓度大于1 mg/L时,强化了其形成优势;EPS也显著提高了生物膜的黏附强度以及降低了其表面粗糙程度。
(2)低浓度氯促进细菌EPS的生成以及初期生物膜的形成,表面的EPS含量分别为29.31 μg/lg(cells)(0.5 mg/L)和35.12 μg/lg(cells)(1.0 mg/L)。高质量浓度氯(3.0 mg/L)则抑制了生物膜的形成,同时,也降低了两种菌株生物膜的黏附力与表面粗糙度。
(3)对于两种菌株而言,PVC管材上生物膜的形成优势显著高于STS管材,PVC表面的生物量是STS表面的1.88倍。
