降解多种真菌毒素的芽孢杆菌的筛选鉴定及其发酵饲料应用
2024-02-26张香香董维璇赖根生王德培
■ 郭 瑞 张香香 董维璇 赖根生 王德培,2,3*
(1.天津科技大学生物工程学院,天津 300457;2.工业发酵微生物教育部重点实验室,天津 300457;3.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457)
真菌毒素是由镰刀菌属、曲霉属和青霉属等真菌次生代谢产生的一系列有毒的、加工性能稳定、化学结构复杂的产物[1],其普遍存在于各种粮食作物及饲料原料中,对人和动物具有广泛的毒害作用。毒素污染的饲料使动物出现呕吐、消化不良、神经系统和生殖系统损伤等不利影响[2-3],造成了重大的经济损失。真菌毒素是一种相当稳定的小分子化合物,极难去除或降解,一些农畜产品进入食物链后还会持续保持其毒性,并最终在人类体中蓄积,对人类造成急性或长期的慢性影响,如产生肝脏毒性、致畸、致癌或免疫抑制效应等疾病[4]。目前,被鉴定并报道的真菌毒素数目已超过500 种,最主要的真菌毒素包括黄曲霉毒素(AFB1)、赭曲霉毒素、伏马毒素、展青霉素、玉米赤霉烯酮(ZEN)和呕吐毒素(DON)等[5]。其中饲料原料中最常见的能够对动物健康造成极显著危害的毒素包括黄曲霉毒素、呕吐毒素和玉米赤霉烯酮[6]。
目前真菌毒素去除方法包括物理脱毒法、化学脱毒法和微生物脱毒法。目前,微生物脱毒方法主要包括两个作用:一是菌体自身吸附毒素,二是微生物通过酶来降解毒素。目前可降解黄曲霉毒素B1 的酶包括AFO氧化酶[8]、漆酶CotA[9]、锰过氧化物酶MnP[10]等;降解玉米赤霉烯酮的内酯酶ZHD101[11]和ZEND[12]、漆酶BsCotA[13]、过氧化还原酶Prx[14]等;针对呕吐毒素降解的酶DepA[15]、DepB[16]、QDDH、AKR13B2 和AKR6D1[17],DDH 及其突变体TDDH[18],以及乙酰化的3-AC-DON氧化酶[19]等。这些酶都只能针对一种毒素进行降解,而玉米、豆粕、麸皮等饲料原料中普遍存在多种真菌毒素共存污染的现象,有高达91.36%的饲料及原料受到两种及以上霉菌毒素污染[20]。为进一步提高降解效率和降低生产成本,需要一种可以同时降解多种真菌毒素的酶来处理饲料原料。过氧化物酶具有广泛的底物特异性和较高的氧化还原电势,可以通过氧化氢生成的酶复合物与芳香族分子结合并将其氧化。
因此,本研究首次以亚甲基蓝筛选法来筛选可广谱降解真菌毒素的菌株,根据菌株对亚甲基蓝的脱色能力初步筛选可能存在过氧化物酶活力高的菌株,再对脱色率高的菌株进行过氧化物酶活力的测定,最后通过对毒素的实际降解能力验证,获得一株蜡样芽孢杆菌BL-17 可同时降解AFB1、ZEN、DON,并可用于发酵饲料原料。
1 材料与方法
1.1 材料
1.1.1 主要试验材料
① 菌株:实验室保藏的78株细菌。试剂:亚甲基蓝(天津市百世化工有限公司)、DON 标准品(上海芮晖化工科技有限公司)、AFB1 标品及ZEN 标品(Shanghai Macklin Biochemical Co.Ltd.)、玉米赤霉烯酮检测试剂盒及黄曲霉毒素B1 检测试剂盒(Romer Labs GmbH)、药敏实验试剂盒(常德比克曼生物科技有限公司)。
② 饲料原料:玉米胚芽粕、喷浆玉米皮来自黑龙江某公司,豆粕、麦麸来源于辽宁盘锦。
1.1.2 仪器与设备
LDZX-50FB 立式高压蒸汽灭菌锅,上海申安医疗器械厂;BX41-12P02 光学显微镜,日本OLYMPUS公司;LRH-250A生化培养箱,韶关市泰宏医疗器械有限公司;SBA-40E 物传感分析仪,山东省科学院生物研究所;Agilent-1200 高效液相色谱仪,安捷伦科技有限公司;C18 色谱柱(250 mm×4.6 mm,5 µm),安捷伦科技有限公司.
1.2 培养基配方
LB 固体培养基、LB 液体培养基、MRS 培养基,均参考赖根生等[21]配方。
亚甲基蓝培养基:胰蛋白胨10 g、酵母粉5 g、氯化钠10 g、亚甲基蓝0.1 g、纯化水1 L,pH 7.0~7.4。
发酵饲料原料配方:玉米胚芽粕22.5 g、喷浆玉米皮22.5 g、麦麸22.5 g、豆粕22.5 g、纯化水80 mL,用NaOH 调整至pH 6.0。搅拌均匀,室温下放置1~2 h。
1.3 降解AFB1、DON、ZEN菌株的筛选
1.3.1 亚甲基蓝初筛
将实验室所保藏的78 株菌分别接种到LB 固体培养基平板上活化,挑取单菌落转接到5 mL LB 液体培养基中,37 ℃、180 r/min 培养12 h,取100 µL 菌液转接至5 mL 亚甲基蓝培养基中,不接菌的空白培养基作对照,37 ℃、180 r/min 发酵24 h。取1 mL 发酵液,用纯化水稀释10倍后,吸取200 µL稀释液加到酶标板中,使用酶标仪在波长662 nm 下检测每一个孔对应的OD值,计算每株菌的脱色率。
脱色率(%)=1-(菌株发酵后的OD662值/空白对照的OD662值)×100
1.3.2 菌株的过氧化物酶活力复筛
① 过氧化物酶活力测定方法
反应溶液:称取0.102 g KH2PO3和0.399 g K2HPO3,加入纯化水溶解后,再加入0.11 mL 愈创木酚和0.266 mL 30% H2O2,定容至100 mL,pH 7.0~7.2,充分混匀,现配现用。
将样品、反应溶液和比色管放在水浴锅预热至30 ℃,向比色管中加入100 µL样品稀释溶液,快速用反应溶液定容到10 mL,混匀,30 ℃水浴,开始计时,于30 s 和2.5 min 时各吸取1 mL 反应液,立即在470 nm 处测量其OD 值,计算30 s 和2.5 min 时OD 值之差ΔA。过氧化物酶活力单位:每分钟催化1 µmol愈创木酚所需的酶量为1 U。
式中:V总——反应体系总体积(mL);
ΔA——OD值差值;
D——样品或标品的稀释倍数;
26 600——愈创木酚的在470 nm下的摩尔吸光系数(L/mol·cm);
d——比色皿的光径(cm);
t——两次测量相隔时间(min);
v1——添加的样品或标品稀释液体积(mL)。
② 菌株酶活力测定
将初筛菌株活化后,按2%接种量接种到50 mL亚甲基蓝培养基中,37 ℃、180 r/min 培养12 h。取1 mL发酵液,8 000 r/min离心10 min,吸取上清液,稀释适当倍数,按上述方法测定发酵液中的过氧化物酶活力。
1.3.3 毒素检测方法
DON 检测:将固体样品中加入超纯水并充分震荡提取,8 000 r/min 离心10 min,液体样品则直接离心,吸取5 mL 上清液置于分液漏斗中,加入等体积乙酸乙酯萃取,收集上层液体,反复3 次,将3 次的萃取液用真空干燥箱蒸干,用流动相复溶,0.22 µm 滤器过滤。用液相色谱仪进行紫外检测,流动相为乙腈∶水=10∶90、进样量20 µL、柱温40 ℃、流速1 mL/min、检测波长218 nm、出峰时间8.1 min。
AFB1 和ZEN 均采用试剂盒(Romer Labs GmbH)检测。
毒素降解率(%)=1-(样品中毒素残留量/空白对照中毒素含量)×100
1.3.4 AFB1、ZEN单独存在时的降解能力测定
将复筛菌株活化,按2%接种量分别接种到装有50 mL 已添加1 µg/mL AFB1 或1 µg/mL ZEN 的LB 液体培养基的250 mL 三角瓶中,空白对照中则加入等量的无菌水,37 ℃、180 r/min 培养,并分别在16、32 h取样,按照毒素检测试剂盒所述方法检测发酵液中的AFB1或ZEN的残留量,并计算降解率。
1.3.5 3种毒素同时存在时的降解能力测定
将复筛菌株接种到液体LB 培养基中,毒素终浓度为1 µg/mL DON、1 µg/mL AFB1 和1 µg/mL ZEN,其余操作同1.3.4所述。
1.4 BL-17菌株鉴定
1.4.1 形态学鉴定
将菌株划线于LB培养基平板,37 ℃培养24 h,观察其单菌落的菌落形态,挑取单菌落进行革兰氏染色,在光学显微镜下观察细胞形态和特征。
1.4.2 分子鉴定
按照赖根生等[21]方法对菌株的16S rDNA 序列进行扩增,PCR 产物送苏州金唯智生物科技有限公司进行测序。将测序结果在美国国立生物技术信息中心(NCBI)数据库中进行BLAST 比对,选取同源性高的16S rDNA 基因序列,通过MEGA7.0 软件以邻接法(Neighbour-joining,NJ)构建菌株的系统发育树。
1.5 发酵饲料原料
种子培养:BL-17 以2%接种量转接到含50 mL液体LB 培养基中,37 ℃、180 r/min 培养18 h;两株乳酸菌接到MRS(含0.5% CaCO3)培养基平板上,42 ℃培养24 h,再挑取产酸圈大的单菌落接到MRS液体培养基中,静置培养16 h。
兼性厌氧发酵饲料降解3 种毒素:将BL-17 和两株乳酸菌的种子液以2∶1∶1 的比例,按总接种量8%接种到发酵培养基中,搅拌均匀后装入100 mL 螺口瓶中压实并密封,室温放置3 d,以添加无菌水的饲料原料作为对照。
有氧发酵饲料降解3 种毒素:将发酵培养基装到250 mL三角瓶中,每瓶原料高度需达2.5~3.0 cm,进行121 ℃灭菌并干燥。将BL-17与两株乳酸菌按上述同样的接种量接种到发酵培养基中,用6层纱布将瓶口包好,通风条件下室温放置3 d,每隔12 h进行一次翻料。
发酵完毕后取样,分别检测厌氧和好氧发酵饲料的pH、芽孢菌与乳酸菌数目、含水量、乳酸含量、3 种毒素各自的含量及降解率。
1.6 数据处理与统计分析
试验数据用“平均值±标准差”表示,采用SPSS Sta‐tistics 25统计软件中的单因素ANOVA检验,P<0.05为差异显著。然后用OriginPro 2018版软件进行作图。
2 结果与分析
2.1 亚甲基蓝初筛
本试验选用食用级亚甲基蓝作为筛选物,对实验室保藏的78 株菌株进行初步筛选,如图1 所示,其中对亚甲基蓝脱色率大于50%的菌株有10 株,分别为BL-b、BL-s、BL-5、BL-10、BL-17、BL-18、BL-21、BL-23、BL-24、BL-31,可能具有较高的过氧化物酶活力潜能,继续对这10株菌进行复筛。

图1 部分菌株对亚甲蓝的脱色效果
2.2 菌株的过氧化物酶活力复筛结果
初筛所得到10 株菌的过氧化物酶活力结果如图2,除菌株BL-s 外的其余9 株菌均具有过氧化物酶活力,其中菌株BL-10、BL-17、BL-24、BL-31 的过氧化物酶活力较高,选择此4株菌进行后续试验。

图2 菌株的过氧化物酶酶活力
2.3 毒素降解能力测定
2.3.1 单独降解黄曲霉毒素B1或玉米赤霉烯酮的能力
如图3 所示,4 株菌均具有一定的AFB1 降解能力,且菌株对AFB1 的降解率与其过氧化物酶酶活力呈正相关,4 株菌中BL-17 的过氧化物酶酶活力最大,其对AFB1的降解率在16 h时即可达到70%以上,32 h 时降解率最高,可达93.16%。而对ZEN 的降解能力4 株菌均较强,降解率在40%以上,其中BL-17对ZEN 的降解率最高,16、32 h 时分别为71.75%和89.76%。
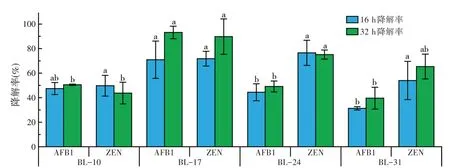
图3 菌株的AFB1和ZEN降解率
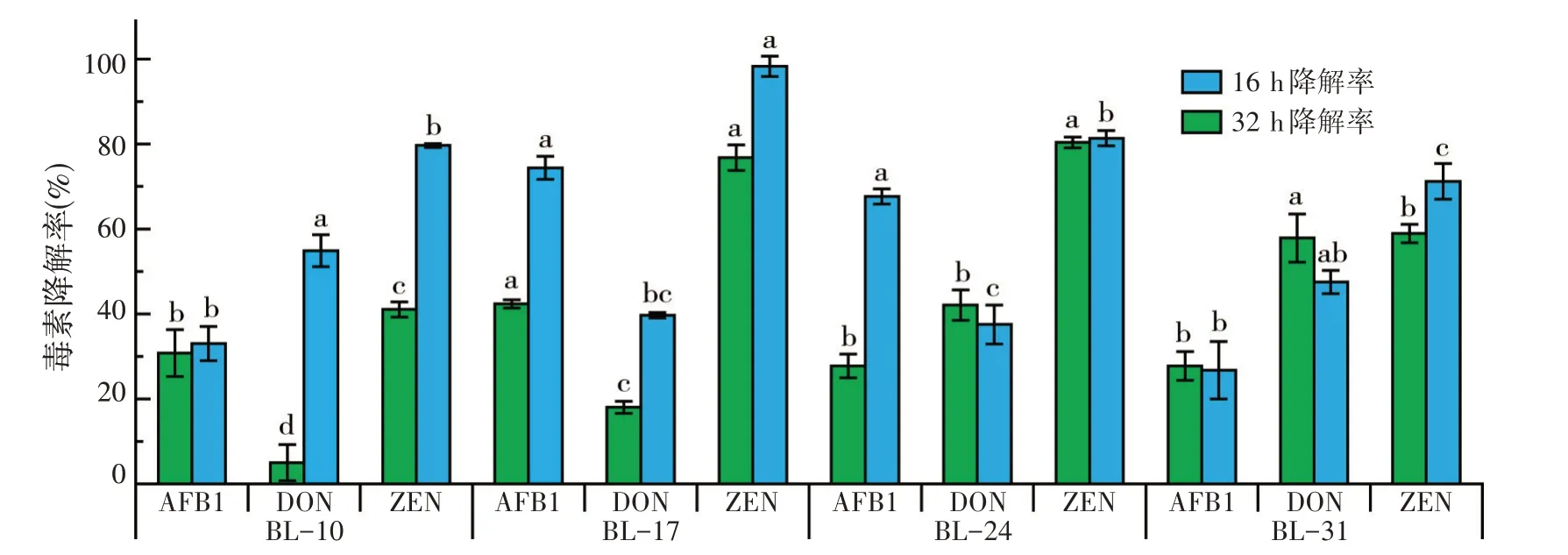
图4 菌株对3种毒素的降解率
2.3.2 3种毒素同时降解能力
在同时存在AFB1、ZEN 和DON 的情况下,各菌株对AFB1 的降解率有所降低,而对ZEN 的降解率却有所提高。其中菌株BL-17对AFB1和ZEN两种毒素的降解率都最高,32 h 分别达74.38%和98.31%,对DON 的降解率稍低,在32 h 时为39.66%。而对于DON,4株菌的降解率均不理想,降解率最高的为菌株BL-31,在16 h为57.86%,但是其降解率在32 h后降到47.51%,可能原因是BL-31 对DON 有吸附作用,后期菌体开始裂解,吸附的DON 部分被释放到培养液中。综合考虑选定BL-17继续进行后续的研究和应用。
2.4 BL-17菌株鉴定
2.4.1 形态学特征
BL-17 在LB 平板中生长,菌落近似圆形,呈白色略带光泽,菌落大且扁平,表面粗糙呈毛玻璃状,不透明,不产生色素,边缘较为平滑,质地软易挑起(图5)。单菌落经革兰氏染色后,在普通光学显微镜下可观察到其为革兰氏阳性菌,细胞为短杆状,中间有未被染色的芽孢,单个或链状排列(图6)。
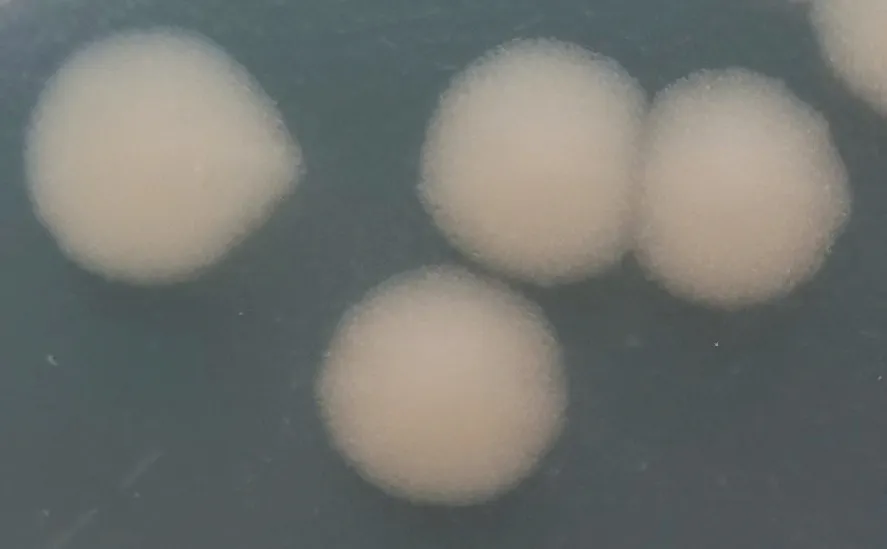
图5 BL-14菌落形态
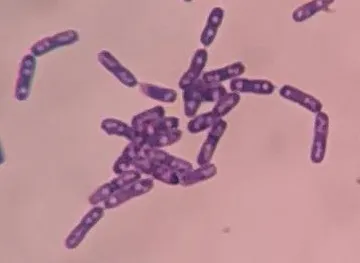
图6 BL-14细胞形态
2.4.2 分子鉴定结果
BL-17 的16S rDNA 基因扩增产物,经测序结果表明序列长度为1 456 bp。将序列进行NCBI-BLAST比对,选取序列同源性高且有代表性的12 株菌的16S rDNA 基因序列,通过MEGA7.0 软件以邻接法构建系统发育树,结果如图7 所示,菌株BL-17 与蜡样芽孢杆菌(Bacillus cereus)处于同一分支,再结合其形态学特征,确定菌株BL-17为蜡样芽孢杆菌。
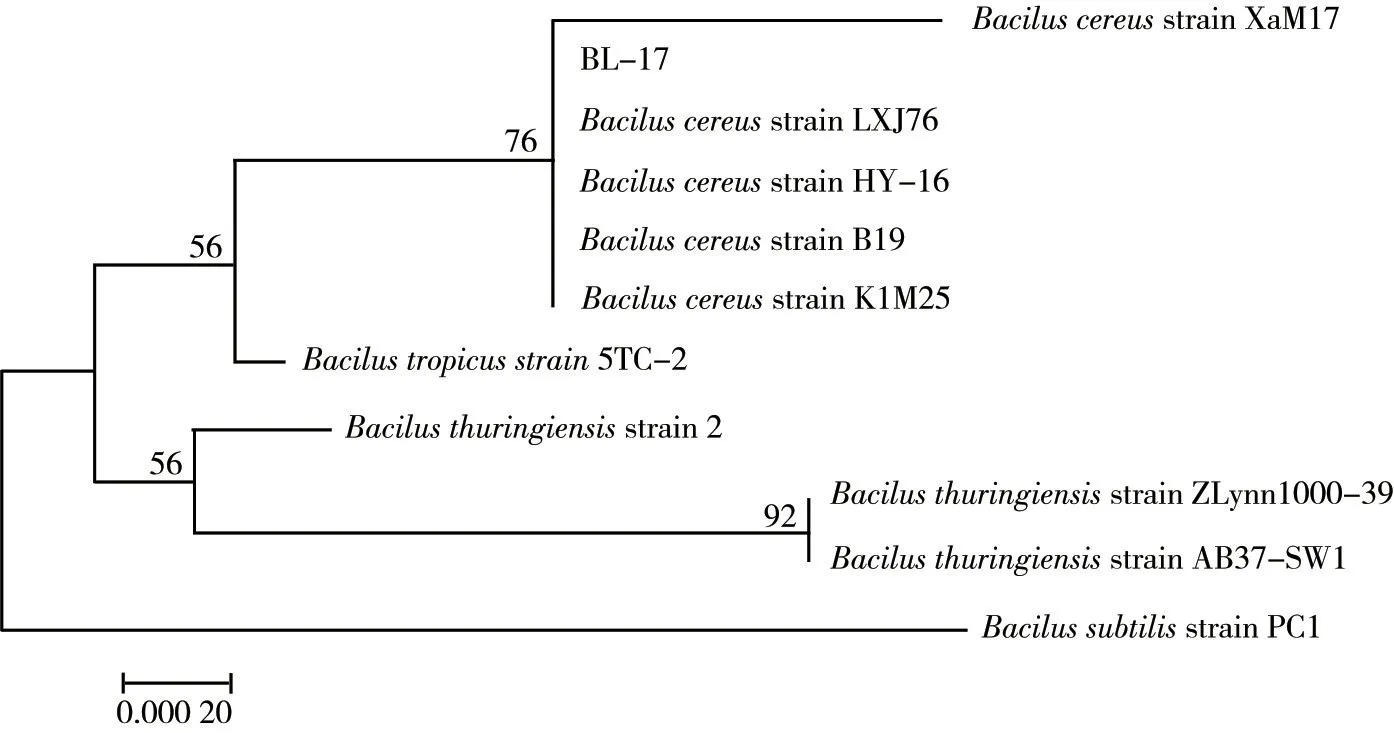
图7 基于Neighbor-Joining法BL-17的16S rDNA序列系统发育树
2.5 BL-17发酵饲料原料降解毒素结果
2.5.1 BL-17兼性厌氧发酵饲料原料结果
从表1 的结果中可以看出,兼性厌氧条件下,芽孢菌BL-17 与两株乳酸菌RS1、NJ8,共同进行饲料原料发酵降解3 种真菌毒素,可将原料中ZEN 降解72.15%,AFB1 降 解67.67%,DON 的 降 解 率 只 有20.43%。从3 种毒素的降解情况来看,BL-17 对毒素的降解更偏向于AFB1 和ZEN,对DON 降解不高。另外,从芽孢菌的计数结果来看,在此次厌氧发酵饲料中,BL-17的生长状况不理想,导致3种真菌毒素的降解率偏低,特别是对于DON的降解。
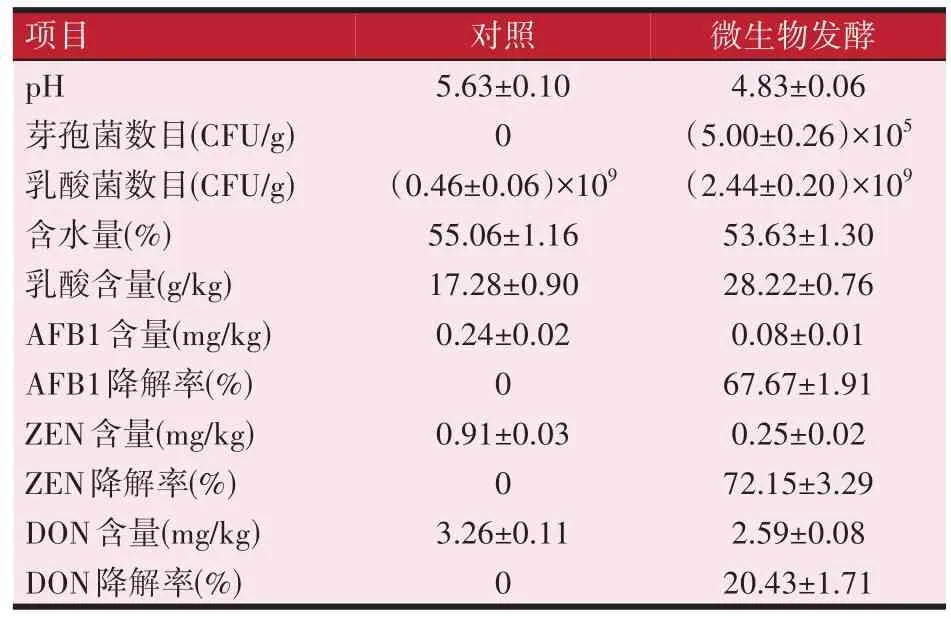
表1 兼性厌氧发酵饲料结果
2.5.2 BL-17有氧发酵结果
如表2 所示,在有氧条件下BL-17 的数目相比厌氧发酵有大幅增长,乳酸菌的数目也有所提高,但乳酸的产量明显降低。从3 种毒素的降解结果来看,BL-17 对黄曲霉毒素B1和玉米赤霉烯酮的降解率大幅提升,分别为86.72%和100%,对于呕吐毒素的降解率也提高了一倍。
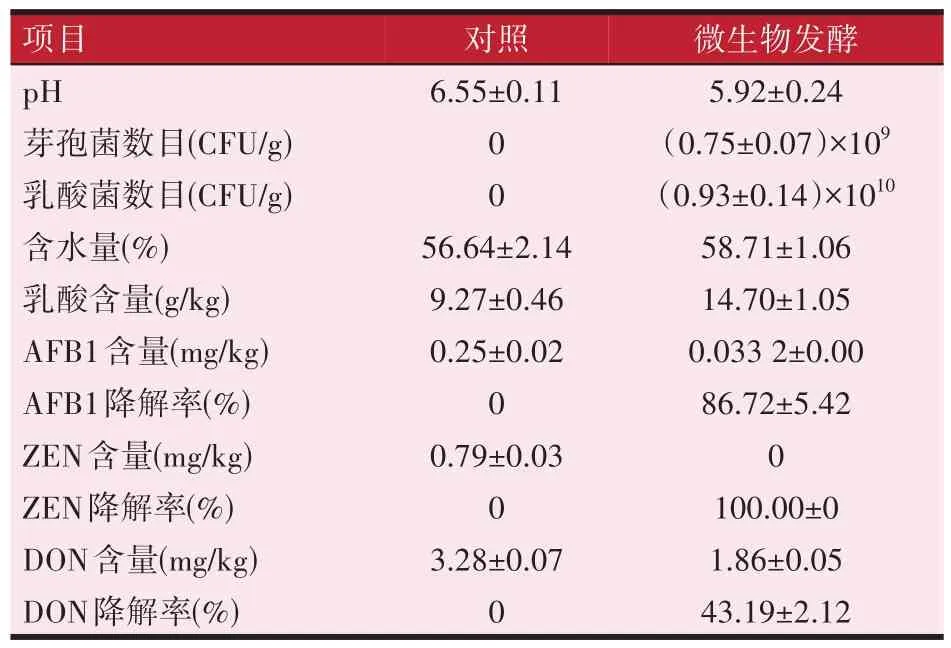
表2 有氧发酵饲料结果
3 讨论
芽孢菌降解真菌毒素多以酶降解为主,并辅以菌体吸附作用。目前,常见的降解真菌毒素的芽孢杆菌主要有枯草芽孢杆菌、蜡样芽孢杆菌、贝莱斯芽孢杆菌、地衣芽孢杆菌、纳豆芽孢杆菌等。王明清等[22]以香豆素为唯一碳源,从土壤中筛选出一株高效降解AFB1 的贝莱斯芽孢杆菌Bacillus velezensisA6,对AFB1的降解率达90.6%,研究发现有降解活性的物质主要位于胞外。余祖华等[23]以DON 为唯一碳进行筛选,得到一株蜡样芽孢杆菌B.JG05,该菌株对饲料中的DON 降解率达82.68%。徐海军等[24]以母猪粪便为材料,经过驯化、富集,筛选出一株可同时降解AFB1、ZEN 和DON 的芽孢杆菌ODS-1。本论文所用78 株菌在实验室前期筛选时,每株菌至少含有3 种水解酶。对这些菌再进行系列毒素降解的筛选,得到了可同时降解多种毒素的最好的菌株BL-17。因此BL-17 不仅具有降解多种毒素的能力,还具备多种水解酶,可以将饲料原料中的大分子物质转化为小分子营养物质,促进动物的吸收[25],提高了饲料的利用率。
通过药敏试验试剂盒,对BL-17进行不同作用类型的30 种抗生素的药敏试验可以发现,其对多种抗生素都敏感,尤其是对作用于蛋白质或者核酸的抗生素。同时,通过对BL-17进行胃酸和胆盐的模拟耐受试验,发现其在pH 4 以下的胃蛋白酶溶液或0.2%~0.4%浓度胆盐的PBS 溶液中均难以存活,在1.5 h 后存活率均低于0.1%。BL-17对胃酸和胆盐的不耐受,使其即使随发酵饲料进入动物胃部和肠道后也很难存活下来,这极大地提高了饲料的安全性。其次实验室所用的两株乳酸菌属于《饲料添加剂品种目录》中的安全添加菌,其作为益生菌在进入动物体内后可改善肠道环境,提高动物的免疫力[26]。每年因受到真菌毒素污染影响导致全球农作物产品产量损失25%左右[27]。BL-17 与两株乳酸菌协同对饲料进行发酵,既能对原料中的多种真菌毒素进行不同程度的降解,提高饲料的安全性,也可增加对玉米胚芽粕、喷浆玉米皮等一些非常规饲料原料的利用[28],在以非常规饲料为原料的发酵饲料应用上有很大好的前景。
BL-17 的筛选是针对可广谱降解真菌毒素的过氧化物酶进行的,因此BL-17中可能至少存在一种可降解毒素的过氧化物酶。如上所述,目前已经发现的几种降解酶大多数只能针对一种毒素进行降解,对于可降解多种真菌毒素的广谱酶的研究较少。BL-17作为一种可广谱降解真菌毒素的菌株,具有诸多的研究空间,可以进一步探究其对于其他毒素的降解能力,同时深入研究BL-17 产生的广谱降解酶,为真菌毒素降解酶的研究和开发提供新的途径。
4 结论
综上所述,本研究首次运用亚甲基蓝筛选法,在实验室所保藏的芽孢杆菌中,经过降解亚甲基蓝初筛、过氧化物酶活力检测复筛,最终获得出一株可同时降解AFB1、ZEN、DON,并可用于发酵饲料中的菌株BL-17。经过菌落形态观察及分子鉴定,确定BL-17 为蜡样芽孢杆菌。将BL-17 与两株乳酸菌混合对饲料原料进行发酵,在有氧条件下大幅度降解了饲料中的3 种有毒物质,对AFB1、ZEN 和DON 的降解率分别达86.72%、100%和43.19%。不仅提高了发酵饲料的安全性,同时也可增加对非常规饲料原料的利用。
