张掖市山丹县马铃薯枯萎病菌的鉴定
2024-02-26何树文王彦崔凌霄许永锋王泽浩杨成德
何树文,王彦,崔凌霄,许永锋,王泽浩*,杨成德*
(1 张掖市植保植检站,甘肃张掖 734000;2 甘肃农业大学植物保护学院,甘肃兰州 730070)
马铃薯具有较高的经济价值和营养价值(齐恩芳 等,2023),是我国主要的粮食作物之一,年种植面积超过600 万hm2(9 000 万亩),产业发展潜力巨大(李国景 等,2023)。随着马铃薯种植面积的日益增长,马铃薯病害问题也日益加剧,其病害种类不断增多,发病程度逐年加重(罗爱花 等,2019)。其中,由镰刀菌所引起的马铃薯枯萎病(Fusariumavenaceum)已成为马铃薯最重要的病害之一,其分布广泛,在美国(Taylor & Blodgett,1937)、印度(Azil et al.,2021)、意大利等马铃薯种植区均有发生。在中国,马铃薯枯萎病主要发生在内蒙古、甘肃、河北和新疆等马铃薯主产区(安小敏 等,2017)。据报道,马铃薯枯萎病在我国各地的发病率可达15%~45%,易于流行且难以防治,严重时会直接导致植株整株死亡,严重制约我国马铃薯产业的健康发展(陈春艳 等,2014)。
甘肃省是我国马铃薯的主要产区之一,据王玉琴等(2014)报道,引起甘肃省武威市天祝县马铃薯枯萎病的病原菌为燕麦镰刀菌(F.avenaceum),但其他地区病原菌种类尚不清楚。因此,本试验对甘肃省山丹县马铃薯枯萎病病原菌进行分离和致病性测定,利用显微观察其形态学特征,并结合分子生物学分析对病原菌进行鉴定,以期对山丹县马铃薯枯萎病的田间诊断和综合防治提供依据。
1 材料与方法
1.1 试验材料
供试标本为2020 年9 月于张掖市山丹县采集的具有典型枯萎病症状的马铃薯病株。供试培养基为马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖15~20 g、琼脂16~18 g、蒸馏水1 000 mL。
1.2 试验方法
1.2.1 病原菌分离及致病性测定 采用组织分离法对采集到的马铃薯病株进行病原菌分离。在超净工作台中,用无菌手术刀切取0.5 cm 长的马铃薯病株根部组织,并于0.1%升汞中消毒1 min,无菌水冲洗3 次,用无菌滤纸吸干组织表面水分后置于PDA 培养基,25 ℃培养5~7 d,单孢纯化后编号并于4 ℃条件下保存备用。
将单孢分离后的分离物置于PDB 液体培养基,25 ℃、180 r · min-1培养5 d,采用灌根法将其接种于生长30 d 的健康马铃薯根茎处,以接种无菌水为对照,重复3 次,保湿48 h,连续观察马铃薯植株发病情况。待植株发病后再次进行组织分离,将分离物的菌落形态和孢子形态等与接种菌株进行比较。
1.2.2 形态学鉴定 于25 ℃条件下培养5~7 d 后观察菌落的形态、颜色等,测量直径,在显微镜(10 × 40)下观察菌丝、分生孢子、分生孢子梗和厚垣孢子等特征,并进行拍照。
1.2.3 分子生物学鉴定 收集25 ℃条件下培养5~7 d 的病原菌菌丝,利用OMEGA 真菌DNA 提取试剂盒(D3195-01,美国Omega 生物技术公司),按说明书步骤提取病原菌DNA。
选取通用引物ITS1(5′-TCCGTAGGTGA ACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATT GATATGC-3′)对病原菌DNA 进行扩增,方法参考相关文献并经优化后应用于本试验。PCR 扩增体系(32 μL)为:Master Mix 10 μL,DNA 模板1 μL,ITS1 0.5 μL,ITS4 0.5 μL,ddH2O 20 μL;扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,共30 个循环;72 ℃延伸7 min,4 ℃保存。
利用镰刀菌属特异性引物EF728M(5′-CAT CGAGAAGTTCGAGAAGG-3′) 和Tef1R(5′-GCCATCCTTGGAGATACCAGC-3′)对病原菌DNA 进行PCR 扩增。反应体系(25 μL)为:模板DNA 4 μL,10 μmol · L-1上、下游引物各1 μL,2× Easy Taq PCR Super Mix 12.5 μL,ddH2O 6.5 μL。PCR 扩增程序为:95 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 s,72℃ 延伸2 min,35 个循环;72 ℃延伸10 min。
取6 μL 扩增产物,于1.2%琼脂糖凝胶上进行电泳检测,将具特异性条带的扩增产物送至西安擎科生物工程有限公司进行测序。所得序列于NCBI中进行Blast 比对,用MEGA 7.0 软件采用邻接法(Neighbor-joining)构建系统发育树(崔凌霄 等,2018)。
2 结果与分析
2.1 田间发病症状
患病植株下层叶片最先出现萎蔫,主要表现为叶片边缘卷曲、呈褐色,随后上部幼嫩叶片出现萎蔫等症状(图1-a),切开病株维管束呈现褐色(图1-b)。
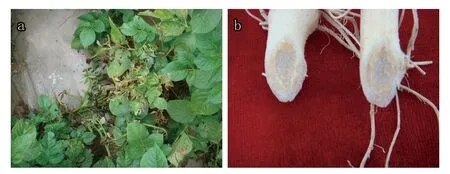
图1 马铃薯枯萎病症状
2.2 病原菌分离及致病性测定
经组织分离,于张掖市山丹县马铃薯枯萎病病株上共分离纯化得到3 株真菌分离物,编号分别为1-1、3-2 和3-6。
将3 株分离物进行盆栽致病性测定。结果表明,接种50 d 后,接种分离物1-1 的马铃薯植株发病严重,叶片萎蔫、卷曲,呈褐色,病株维管束切开后呈褐色,发病较严重时出现整株枯死等症状(图2-a);接种分离物3-2 和3-6 的马铃薯植株均出现明显的枯萎症状,但发病症状较分离物1-1 引起的症状轻,主要表现为植株下部老叶枯萎、凋落(图2-b、c);接种无菌水的对照均无发病症状(图2-d)。将发病后的马铃薯再次进行组织分离,均得到与接种物培养性状相同的分离物,依据科赫氏法则,确定分离物1-1、3-2 和3-6 均为引起张掖市山丹县马铃薯枯萎病的致病菌。

图2 病原菌致病性测定
2.3 病原菌鉴定
2.3.1 形态学鉴定 将致病菌株1-1、3-2 和3-6接种于PDA 平板,25 ℃培养7 d。其中,菌株1-1生长较慢,菌落表面中心由白色渐变为红色,边缘呈白色不规则状(图3-a),未观察到分生孢子;菌株3-2 菌丝密集,菌落为白色(图3-d),大型分生孢子呈镰刀状,3~5 个分隔,其中一端弯曲程度大于另一端,大小为(50~75)μm ×(4~5)μm,小型分生孢子椭圆形(图3-e);菌株3-6 菌丝红色,生长后期菌落中央表面呈黄色(图3-g),菌丝有隔,厚垣孢子圆形(图3-i),未观察到分生孢子。
2.3.2 基因序列分析鉴定 提取3 株病原菌的基因组DNA,利用ITS 通用引物扩增并测序,通过Blast 相似性分析后,选择同源性大于95%的序列进行系统发育树构建。结果表明,分离自张掖市山丹县马铃薯的3 株病原菌中,菌株3-2 与木贼镰刀菌(F.equiseti)聚于同一分支,菌株1-1 和3-6 与三线镰刀菌(F.tricinctum)聚于同一分支(图4)。利用EF-1α 特异性引物对3-2 和1-1 进行扩增并测序,下载同源性较高的序列构建系统发育树,其结果与ITS 结果相一致(图5)。结合形态特征,最终将3-2 鉴定为木贼镰刀菌,1-1 和3-6 鉴定为三线镰刀菌,其中木贼镰刀菌引起的马铃薯枯萎病为国内首次报道,三线镰刀菌引起的马铃薯枯萎病为甘肃省首次报道。
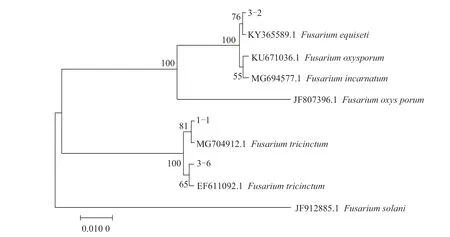
图4 基于ITS 基因序列构建病原菌1-1、3-2 和3-6 及其他相关菌株的系统发育树
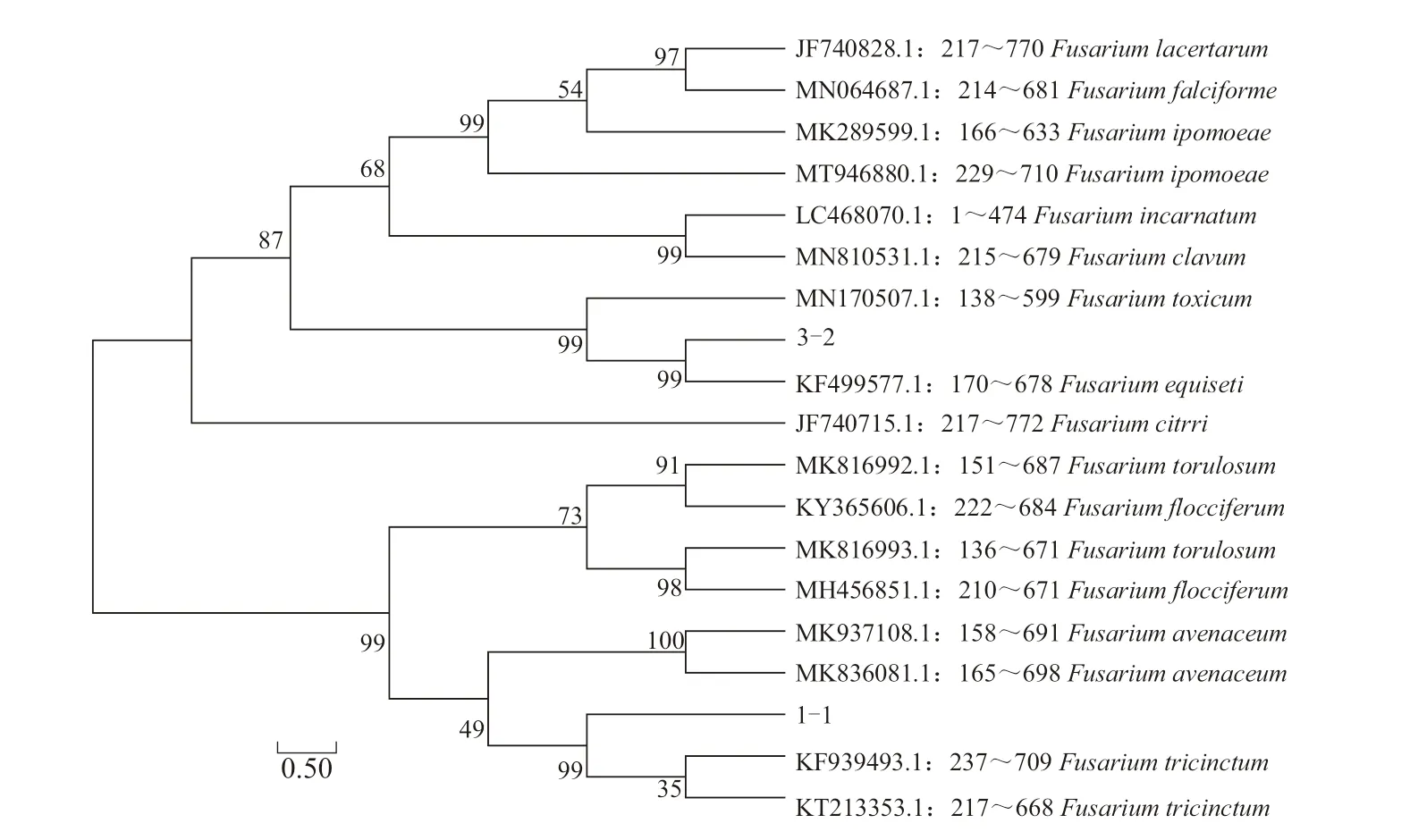
图5 基于EF-1α 基因序列构建病原菌1-1 和3-2 及其他相关菌株的系统发育树
3 讨论与结论
据国内外报道,能够引起马铃薯枯萎病的镰刀菌共有8 种,分别为尖孢镰刀菌(F.oxysporum)、茄病镰刀菌(F.solani)、 接骨木镰刀菌(F.sambucinum)、雪腐镰刀菌(F.nivale)、串珠镰刀菌(F.moniliforme)、三线镰刀菌(F.tricinctum)、锐顶镰刀菌(F.acuminatum)和燕麦镰刀菌(F.avenaceum)(曲延军,2014)。不同区域分离的菌株在致病力方面存在差异性,如贾瑞芳等(2023)报道的139 株镰刀菌属真菌均能引起马铃薯枯萎病,但不同种的镰刀菌属菌株在马铃薯上存在一定的致病力分化。镰刀菌对环境的敏感性较强,且遗传变异较大,其同一属内不同菌株间可能存在着遗传多样性,进而造成致病力存在差异性。其中,引起甘肃省武威市天祝县马铃薯枯萎病的病原菌为燕麦镰刀菌(F.avenaceum)(王玉琴 等,2014),其他地区病原菌种类尚不明确。在本试验中,对甘肃省山丹县马铃薯枯萎病病原菌进行分离和致病性测定,共得到3 株具有致病性的镰刀菌,包含1株木贼镰刀菌(3-2)和2 株三线镰刀菌(1-1 和3-6)。早期木贼镰刀菌主要侵染马铃薯薯块,能够引起马铃薯薯块的干腐病。2009—2010 年,对密歇根州马铃薯贮藏库内的薯块进行调查后发现,在370 个发病薯块中共分离得到228 株镰刀菌,其中木贼镰刀菌为第二大优势种,占分离总株数的19.3%(Gachango et al.,2012)。同样,在Ödemiş和Torbalı 仓库中,从468 个发病薯块中分离得到了41 株具有致病性的镰刀菌,其中木贼镰刀菌占比14.63%(Yikilmazsoy & Tosun,2021)。除此之外,木贼镰刀菌也可造成马铃薯植株茎基部腐烂等症状,曾被认为是造成德兰士瓦马铃薯枯萎病的主要病原菌(Theron & Holz,1989)。而本试验中木贼镰刀菌3-2 引起的马铃薯枯萎病为国内首次报道。三线镰刀菌是镰刀菌属中一类重要的病原菌,目前在中国主要发生在内蒙古(陈慧 等,2016)和青海(杨波 等,2019),而在甘肃省由三线镰刀菌引起的马铃薯枯萎病为首次报道。陈慧等(2016)报道,三线镰刀菌接种后于马铃薯生长的中后期发病,发病初期植株下部叶片萎蔫;发展后期,叶片由下而上逐渐萎蔫枯死,与本试验结果相同。其中三线镰刀菌3-6 引起的病害症状表现为马铃薯植株下部叶片枯萎,而三线镰刀菌1-1 引起的病害症状为整个马铃薯植物萎蔫枯死,说明同一属的不同菌株间存在差异性,具有遗传多样性。曹宜等(2004)曾分析了22 株尖孢镰刀菌遗传物质的差异性,利用分子生物学手段证明了不同基因的表达结果是造成尖孢镰刀菌致病力存在差异的主要原因。因此,三线镰刀菌中也可能存在着同样的差异性基因表达,导致其不同菌株间的致病性存在差异性。
木贼镰刀菌菌株3-2 菌落呈淡米黄色、疏松、棉絮状,分生孢子梗单生具分枝,大分生孢子呈镰刀形,3~5 个分隔,与文献中报道的木贼镰刀菌的培养性状相似(Gachango et al.,2012)。三线镰刀菌菌株1-1 的菌落形态为菌落表面中心由白色逐渐变为红色,边缘呈不规则状;菌株3-6 的菌落形态为菌丝红色,生长后期菌落中心表面呈黄色,二者之间培养性状存在差异性。但也有相关报道表明,镰刀菌对环境的变化较敏感,容易受到温度、酸碱度、海拔等因素的影响(O’Donnell et al.,1998;郝蓉蓉 等,2015)。因此,通过常规的形态学鉴定很难将镰刀菌确定到种。本试验进一步通过分子生物学手段将菌株1-1 和3-6 最终均鉴定为三线镰刀菌,说明分子生物学在复杂种的鉴定过程中具有重要的作用。
本试验明确了山丹县马铃薯枯萎病病原菌的种类,可以为甘肃省山丹县马铃薯枯萎病的田间诊断和综合防治提供理论依据。
