嗜卷书虱Cu/Zn-SOD1, Cu/Zn-SOD2和Fe/Mn-SOD的克隆及对高低温胁迫的响应
2024-02-26徐德均朱斌健徐俊延敖国红张长禹韩开宇
王 潇, 徐德均, 朱斌健, 徐俊延, 敖国红, 张长禹, 韩开宇
(1. 贵州中烟工业有限责任公司毕节卷烟厂, 毕节 551700; 2. 贵州大学昆虫研究所, 贵州省山地农业病虫害重点实验室,贵阳 550025; 3. 贵州翰髙烟叶病虫害防治中心, 贵阳 550009)
温度是影响昆虫生存、行为、生物学、生理学和种群动态的最重要的环境因素之一(Paimetal., 2016; Sarkar and Barik 2017; Abarca and Spahn, 2021)。极端温度胁迫(热和冷)可能导致昆虫发育历期延长、寿命缩短和繁殖力降低等(Rwomushanaetal., 2008; Ross-Gillespieetal., 2018; Pumhanetal., 2020)。为了抵消由于环境高温或低温暴露而造成的损害,昆虫已经进化出各种行为和生理适应(Storey, 1997; Wang and Kang, 2005)。增强抗氧化酶活性被广泛认为是提高昆虫对温度胁迫耐受性的重要的策略之一(Zhangetal., 2015; Kangetal., 2017)。
温度胁迫可导致昆虫体内活性氧(reactive oxygen species, ROS)的水平升高,从而对机体细胞内的脂质、蛋白质和DNA造成氧化损伤(Lopez-Martinezetal., 2008; Yangetal., 2021)。为了避免ROS损伤,昆虫生活过程中进化出各种抗氧化酶参与氧化损伤反应(Yangetal., 2010; Chenetal., 2018)。在昆虫中,抗氧化酶主要包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)和谷胱甘肽S-转移酶(glutathione S-transferase, GST)(Felton and Summers, 1995; 李贝贝等, 2021)。SOD作为昆虫抵御氧化应激的第一道防线,是目前唯一发现可以特定功能清除昆虫体内多余氧自由基的抗氧化酶,主要通过催化歧化反应将ROS生成O2和H2O2,保护氧代谢组织细胞免受超氧化物自由基的氧化损伤(Mengetal., 2009; Wangetal., 2018; 王云, 2022)。例如,荒漠甲虫小胸鳖甲Microderapunctipennis在极端温度胁迫下,其体内SOD1,SOD2和SOD3的表达量显著升高,表明3种SOD基因响应极端温度胁迫中发挥了重要的作用(Xikeranmuetal., 2019);广聚萤叶甲Ophraellacommuna卵和幼虫在高温42 ℃胁迫下,其体内SOD酶活性均显著升高(Chenetal., 2018);烟粉虱Bemisiatabaci成虫在低温4 ℃胁迫1 h,其体内SOD酶活性显著升高(Lietal., 2011)。
嗜卷书虱Liposcelisbostrychophila隶属于啮虫目(Psocoptera)书虱科(Liposcelididae)书虱属Liposcelis,是一种重要的世界性储藏物害虫(Nayaketal., 2014)。近年来, 嗜卷书虱对仓储系统中的热处理产生了较高的耐受性(Wangetal., 2000; Miaoetal., 2020)。例如,嗜卷书虱卵期对温度的耐受性最强,需在46 ℃持续>35 h才可以杀死卵(Beckettetal., 2003)。然而,目前关于嗜卷书虱对极端温度耐受性的分子机制尚不完全清楚。尽管Miao等(2020)研究发现,嗜卷书虱成虫体内SOD酶活性在高温42.5 ℃胁迫2 h显著升高,但未从mRNA水平开展相关研究。因此,本研究通过克隆嗜卷书虱LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD并分析其序列特征,检测这3个基因在高低温胁迫下的表达变化,揭示SOD基因在响应温度胁迫中的作用,为探究嗜卷书虱响应极端温度胁迫的分子机制奠定理论基础,并为科学制定这种害虫热处理应用的防治策略提供参考。
1 材料与方法
1.1 试虫
本研究使用的嗜卷书虱虫源采自贵州毕节市卷烟厂烟叶仓库内,在黑暗的人工气候箱内用烟叶饲养,饲养温度(28±1) ℃和相对湿度80%±5%。取1日龄成虫,分别置于42和4 ℃条件下处理0(CK), 1和2 h,每个处理30头虫,3次生物学重复,试验期间相对湿度为80%±5%。所有样品处理后,采用液氮速冻,并储存在-80 ℃冰箱中备用。
1.2 嗜卷书虱总RNA提取和cDNA的合成
采用Eastp®Super Total RNA Extraction Kit (Promega, 上海)提取1.1节嗜卷书虱总RNA。用1%琼脂糖凝胶电泳和超微量紫外分光光度仪检测RNA的质量和浓度。以提取的高质量总RNA为模板,按照反转录HiFiScript cDNA Synthesis Kit (CWBIO, 泰州)说明书进行cDNA第1链合成。
1.3 嗜卷书虱Cu/Zn-SOD1, Cu/Zn-SOD2和Fe/Mn-SOD的克隆
基于嗜卷书虱转录组数据库(未发表)对Cu/Zn-SOD1,Cu/Zn-SOD2和Fe/Mn-SOD序列设计特异性引物(表1),以合成的cDNA为模板扩增嗜卷书虱SOD基因中间片段。PCR反应体系(25 μL): Premix Taq (Ex Taq Version 2.0 Plus Dye)酶(1.25 μmol/25 μL)(TaKaRa, 大连) 12.5 μL, cDNA模板(200 ng/μL) 1 μL, 正反向引物(10 μmol/L)各1 μL, ddH2O 9.5 μL。反应程序: 95 ℃ 30 s; 94 ℃30 s, 54 ℃ 30 s, 72 ℃ 1 min, 35个循环;72 ℃ 10 min。用1%琼脂糖凝胶电泳检测PCR产物,用SanPrep Column PCR Product Purification Kit (Sangon Biotech, 上海)纯化回收目的片段, 连接到克隆载体pMDTM19-T(TaKaRa, 大连)上并转化至大肠杆菌Escherichiacoli感受态细胞DH5α (TaKaRa, 大连)中,使用含Amp抗生素的LB平板进行过夜培养,挑选单一菌落做菌落PCR检测并测序(上海生工)。

表1 引物信息
1.4 生物信息学分析
利用DNAMAN 8. 0对克隆片段序列进行拼接,经NCBI(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)中的Blast工具进行同源序列检索确认后获得基因的全长序列;利用ORF Finder(http:∥www.ncbi. nlm.nih.gov/projects/gorf/)查找嗜卷书虱Cu/Zn-SOD1,Cu/Zn-SOD2和Fe/Mn-SOD基因完整的开放阅读框;用DNAMAN推导编码蛋白氨基酸序列;使用ExPASy ProtParam (http:∥www.expasy.org/tools/protparam.html)、KinasePhos和ScanProsite对蛋白质的理化性质进行在线预测;应用MEGA 6.0软件以邻接法构建系统发育树。
1.5 嗜卷书虱Cu/Zn-SOD1, Cu/Zn-SOD2和Fe/Mn-SOD高低温胁迫下的表达分析
取1.1节处理的嗜卷书虱分别提取总RNA,去基因组DNA后并反转录为cDNA, 每个实验处理设置3个生物学重复和3次技术重复,以β-actin和α-tub为内参基因,采用RT-qPCR分析不同处理下嗜卷书虱Cu/Zn-SOD1,Cu/Zn-SOD2和Fe/Mn-SOD的表达量变化。采用TB GreenPremix Ex Taq (TaKaRa, 大连)染料进行RT-qPCR,引物序列见表1。反应体系(20 μL): cDNA模板(100 ng/μL)1 μL, TB Green Premix Ex Taq 10 μL, ROX Reference Dye 0.4 μL, 正反向引物(10 μmol/L)各1 μL, ddH2O 6.6 μL。反应程序: 95 ℃30 s; 95 ℃5 s, 55 ℃30 s, 40个循环。
1.6 数据分析
利用2-ΔΔCt法对嗜卷书虱3个SOD基因的表达量进行相对定量分析(Livak and Schmittgen, 2001)。采用SPSS 22.0软件中的Tukey氏检验法对高低温胁迫下数据进行差异显著性检验(P<0.05)。
2 结果
2.1 嗜卷书虱Cu/Zn-SOD1, Cu/Zn-SOD2和Fe/Mn-SOD基因克隆与序列
克隆测序得到3个SOD基因(LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD) cDNA序列长度分别为995, 724和667 bp,GenBank登录号分别为OQ938782, OQ938783和OQ938784。LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD的开放阅读框(ORF)分别长465, 630和636 bp,分别编码154, 209和211个氨基酸。编码蛋白相对分子量分别为15.85, 22.33和23.72 kD,等电点分别为6.17, 7.68和6.79,分子式分别为 C679H1082N208O221S, C1007H1560N276O284S8和C1074H1599N299O300S7;N端氨基酸均为蛋氨酸(M, Met),推测的蛋白质半衰期均为30 h;含有带负电荷的氨基酸残基(Asp+Glu)分别为17, 15和23个,带正电荷的氨基酸残基(Arg+Lys)分别为13, 16和22个;稳定性系数分别为22.84, 36.00和27.42,即3种蛋白质性质稳定;总平均疏水指数(grand average hydrophobicity index, GRAVY)分别为-0.318, -0.043和-0.392,表明这些蛋白均为疏水性蛋白质;脂肪族氨基酸指数分别为77.27, 88.66和72.75。亚细胞定位分析表明,LbCu/Zn-SOD1为细胞质、线粒体和细胞核型,LbCu/Zn-SOD2为细胞质型,LbFe/Mn-SOD为线粒体型。利用ScanProsite工具进行的氨基酸分析表明,LbCu/Zn-SOD1具有1个Cu/Zn超氧化物歧化酶特征,即GNAGARAACGVI(第138-149位残基);LbCu/Zn-SOD2具有2个Cu/Zn超氧化物歧化酶特征,即GFHIHQNGSVA(第95-105位残基)和GNAGKRLACCVI (第191-202位残基);LbFe/Mn-SOD具有1个Fe/Mn超氧化物歧化酶特征,即DVWEHAYY(第163-170位残基)。
2.2 嗜卷书虱LbCu/Zn-SOD1, LbCu/Zn-SOD2和LbFe/Mn-SOD系统进化
序列相似性分析表明,嗜卷书虱LbCu/Zn-SOD1和LbCu/Zn-SOD2分别与嗜虫书虱LiposcelisentomophilaCu/Zn-SOD (GenBank登录号: QMS47489.1)和Cu/Zn-SOD(GenBank登录号: QMS47508.1)的氨基酸序列一致性最高,分别达到90.26%和77.42%;而LbFe/Mn-SOD在其他同源昆虫中未检索到。系统发育树显示,3种SOD蛋白各聚为一支,其中LbCu/Zn-SOD1和LbCu/Zn-SOD2又分别以昆虫目为单位聚类,该聚类结果与昆虫学上的传统分类一致。从目以下的分类阶元来看,同一目的分支下又包含一些亚分支,同一亚分支中的昆虫亲缘关系较近,表明Cu/Zn-SOD1和Cu/Zn-SOD2的聚类结果能较好地反映昆虫种间的亲缘关系(图1)。
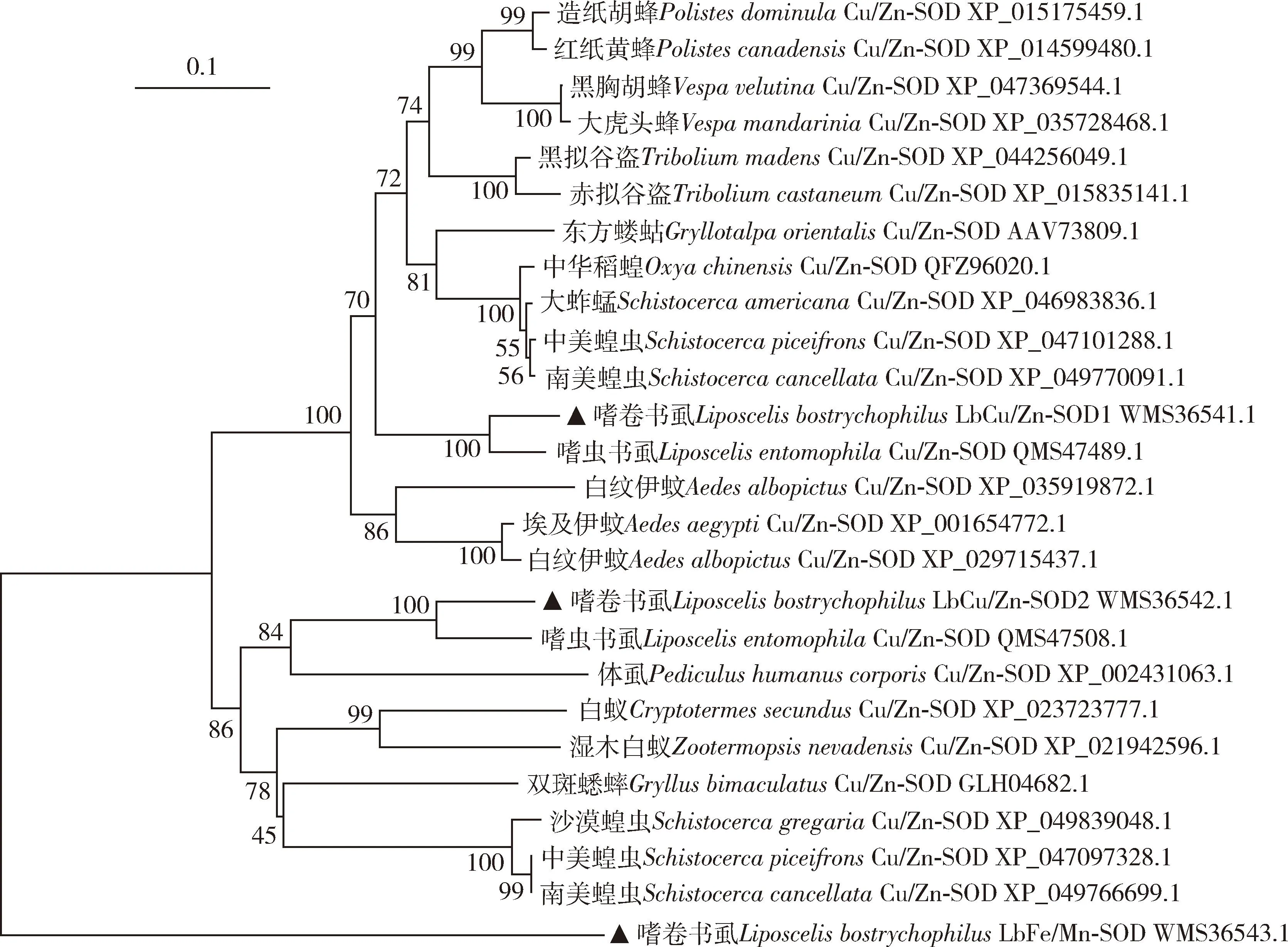
图1 邻接法构建的基于氨基酸序列的昆虫Cu/Zn-SOD1, Cu/Zn-SOD2和Fe/Mn-SOD蛋白系统进化树
2.3 高温胁迫下嗜卷书虱LbCu/Zn-SOD1, LbCu/Zn-SOD2和LbFe/Mn-SOD的表达量
在42 ℃高温胁迫下,嗜卷书虱成虫中LbCu/Zn-SOD1和LbCu/Zn-SOD2的表达量与对照相比均显著升高(P<0.05),且都在1 h时达到最高,分别为对照的2.90和1.86倍;而LbFe/Mn-SOD的表达量在42 ℃处理1 h时与对照相比显著降低(P<0.01),在2 h时与对照相比显著升高(P<0.001),为对照的7.09倍(图2)。
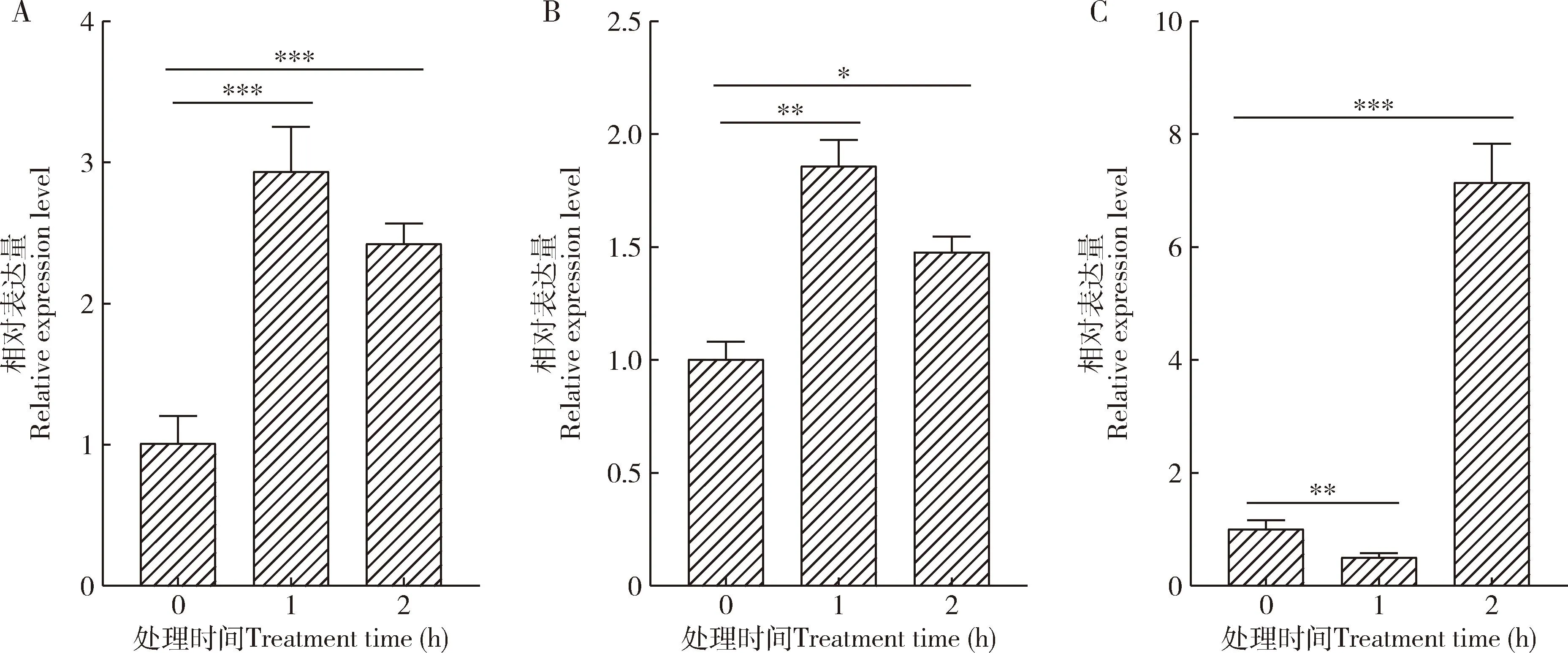
图2 不同时长42 ℃高温胁迫下嗜卷书虱成虫中LbCu/Zn-SOD1 (A), LbCu/Zn-SOD2(B)和LbFe/Mn-SOD(C)的相对表达量
2.4 低温胁迫下嗜卷书虱LbCu/Zn-SOD1, LbCu/Zn-SOD2和LbFe/Mn-SOD的表达量
在4 ℃低温胁迫下,与对照相比,嗜卷书虱成虫中LbCu/Zn-SOD1和LbCu/Zn-SOD2的表达量在1 h时均无显著差异(P>0.05),在2 h时的表达量均显著升高(P<0.05),分别为对照的2.24和1.61倍;而LbFe/Mn-SOD的表达量在4 ℃处理1 h时与对照相比显著降低(P<0.05),在2 h时与对照相比显著升高(P<0.001),为对照的2.85倍(图3)。

图3 不同时长4 ℃低温胁迫下嗜卷书虱成虫中LbCu/Zn-SOD1(A), LbCu/Zn-SOD2(B)和LbFe/Mn-SOD(C)的相对表达量
3 讨论
昆虫在长期进化过程中已经进化出适应恶劣环境条件的策略,包括极端温度。SODs作为昆虫体内普遍存在的抗氧化酶,在昆虫应对各种环境胁迫反应中发挥重要作用(Mengetal., 2009; Yangetal., 2010; Wangetal., 2018)。本研究通过RT-PCR技术克隆得到嗜卷书虱LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD,这3种基因编码的蛋白均包含Cu/Zn或Fe/Mn超氧化物歧化酶特征,且嗜卷书虱LbCu/Zn-SOD1和LbCu/Zn-SOD2基因编码蛋白序列均与嗜虫书虱已知的Cu/Zn-SOD蛋白序列同源性最高,系统发育树中亲缘关系最近(图1),表明嗜卷书虱体内LbCu/Zn-SOD1和LbCu/Zn-SOD2蛋白均为SOD蛋白家族成员且序列高度保守,与中华蜜蜂Apisceranacerana(刘俊峰等, 2012)和荻草谷网蚜Sitobionmiscanthi(刘志伟等, 2023)等昆虫体内SOD蛋白的研究结果一致。此外,本研究中所鉴定的LbFe/Mn-SOD在其他同源昆虫中均未发现有该基因。由此,推测LbFe/Mn-SOD基因可能为嗜卷书虱所特有的基因,其原因有待进一步验证。
高温胁迫会导致昆虫体内ROS的水平升高,而昆虫在进化过程中已形成完整的活性氧清除机制(Lopez-Martinezetal., 2008)。SOD作为昆虫抵御氧化应激的第一道防线,通过催化歧化反应清除昆虫体内多余的ROS,从而保护机体免受氧化损伤(Mengetal., 2009; Parketal., 2009; Wangetal., 2018)。在本研究中,嗜卷书虱成虫在高温42 ℃暴露1和2 h均观察到体内LbCu/Zn-SOD1和LbCu/Zn-SOD2的表达量显著升高,并在1 h时达到最大值。而LbFe/Mn-SOD的表达量在高温暴露1 h时显著降低, 2 h时显著升高(图2)。这些结果表明,SOD基因的表达量升高可能是嗜卷书虱克服高温诱导的超氧阴离子毒性的适应性反应。我们的结果与暴露于热胁迫下的龟纹瓢虫Propylaeajaponica、粘虫Mythimnaseparata、橘小实蝇Bactroceradorsalis和黄瓜新小绥螨Neoseiuluscucumeris的研究结果(Zhangetal., 2014; Alietal., 2017; Caietal., 2019; Pumhanetal., 2020)部分一致。因此,我们推测LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD在嗜卷书虱对热胁迫的响应中起着重要作用。
低温胁迫作为昆虫生活环境中不可避免的环境因子,同样会导致体内ROS水平升高(Choietal., 2006)。昆虫为了能够在低温胁迫这种不良环境下消除过量ROS的伤害,其体内SOD基因表达量会出现显著变化(Kimetal., 2005; Gaoetal., 2013; Gaoetal., 2015)。例如,在低温胁迫下烟粉虱、西方蜜蜂Apismellifera、亚洲蜜蜂A.cerana、美国白蛾Hyphantriacunea和中华蜜蜂等昆虫体内SOD基因的表达量均显著升高(Kimetal., 2010; Lietal., 2011; Kooetal., 2016; 夏振宇等, 2019)。在本研究中,也发现嗜卷书虱LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD的表达量在低温4 ℃暴露2 h时均显著升高(图3),表明3个SOD基因可能在低温胁迫条件下发挥清除ROS的作用,从而提高了嗜卷书虱低温胁迫的耐受性。
综上所述,本研究克隆得到了嗜卷书虱LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD,通过体内表达量分析认为LbCu/Zn-SOD1,LbCu/Zn-SOD2和LbFe/Mn-SOD基因可能在嗜卷书虱响应高低温胁迫中起着重要作用,为后续通过RNAi或基因敲除等技术探究基因的功能提供了线索,并为明确高低温胁迫下嗜卷书虱体内生理生化变化机制提供了理论依据。
