新型口服小分子抗新型冠状病毒感染药物的快速遴选评价实践Δ
2024-02-26刘洪涛连玉菲方灵芝邱学佳
刘洪涛,连玉菲,方灵芝,邱学佳,张 玥
(1.河北医科大学第一医院药剂科,石家庄 050000; 2.河北省人民医院药学部,石家庄 050051)
据统计,截至2022年12月,全球确诊新型冠状病毒感染(COVID-19)患者约6.51亿例,死亡患者约665万例,COVID-19的全球流行已对人类生命安全和健康构成了严重威胁[1-2]。随着多种新型口服靶向抗病毒药物的研发上市,使COVID-19早期治疗有了新希望。我国为适应新形势下人民群众医药健康需求,依据世界卫生组织指南标准,制定了《中国医疗机构药品评价与遴选快速指南(第二版)》,以科学、量化、快速的评估方法,协助医疗卫生领域遴选优质药品。本研究将应用上述指南从临床有效性、药学特性、安全性、经济性、其他属性等方面对奈玛特韦片/利托那韦片、莫诺拉韦胶囊及阿兹夫定片进行卫生技术评估,旨在为医疗机构遴选与合理使用药物提供依据。
1 资料与方法
1.1 资料来源
通过药品说明书及国家药品监督管理局网站,收集适应证、药理作用、药动学、药剂学、用法与用量、贮藏与效期等药品基本信息。登陆中国上市药品目录集及国家药品监督管理局药品评审中心公示,查询药品一致性评价结果。通过检索医脉通、药智数据、Up To Date、MCDEX等工具库,收集疾病诊疗指南。检索中国知网、万方数据库、Embase、PubMed等中外数据库,获取药品有效性和安全性相关循证学资料。药品价格登录河北省医疗机构药品交易采购平台查询。国家医保和基本药物情况通过《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》及《国家基本药物目录(2023年版)》获取。药品全球使用情况登录药智网和各国药品管理部门网站查询。生产企业情况通过2021年美国《制药经理人》发布的全球制药企业前50位名单和2021年国家工业和信息化部医药工业百强榜查询。
1.2 卫生技术评估细则与量化表
依据《中国医疗机构药品评价与遴选快速指南(第二版)》[3],采用百分制量化评估,对奈玛特韦片/利托那韦片、莫诺拉韦胶囊及阿兹夫定片进行卫生技术评估。评估维度及配分标准:药学特性(28分);有效性(27分);安全性(25分);经济性(10分);其他属性(10分)。其中,药学特性、有效性、安全性、经济性为药品的核心属性(得分占比为90%),主要反映其临床价值。其他属性中的医保情况、基本药物情况、全球使用情况是药品的政策属性(得分占比为10%),反映国家对药品使用的政策支持力度及药品的可及性。
1.3 评估结果与应用推荐
评估结果主要用于新药引进及药品调出时,医疗机构可根据评分结果制定药品调整决策,具体推荐见表1。

表1 药品评分结果与应用推荐
2 结果
2.1 药学特性
2.1.1 药理作用:(1)阿兹夫定是全球首个双靶点抗病毒创新药,既具有抗人类免疫缺陷病毒(HIV)作用,又具有抗新型冠状病毒(SARS-CoV-2)作用。阿兹夫定片属人工合成的核苷类似物,是一种前体药物,在细胞内代谢为活性三磷酸盐,在SARS-CoV-2 RNA合成时嵌入到病毒RNA中,导致病毒RNA链合成终止。此外,阿兹夫定片还可特异性作用于病毒RNA依赖性RNA聚合酶(RdRp),导致病毒在逆转录过程中终止,从而抑制病毒复制[4]。研究发现,使用阿兹夫定片后,其活性成分分别聚集于外周血单核细胞及胸腺(淋巴)两处,在清除外周血中病毒的同时,又激活免疫系统,并通过在胸腺(淋巴)缓慢释放活性代谢物不断清除病毒,达到“标本兼治”的效果[5]。(2)莫诺拉韦与阿兹夫定均属RdRp抑制剂,但与阿兹夫定不同的是,莫诺拉韦不能阻断病毒复制,只是诱导病毒发生致死性突变[6]。(3)奈玛特韦片/利托那韦片中,奈玛特韦是SARS-CoV-2主要蛋白酶Mpro(3C-样蛋白酶,3CLpro)的拟肽类抑制剂,通过抑制SARS-CoV-2 Mpro使其无法处理多蛋白前体,从而阻止病毒复制。利托那韦是HIV-1蛋白酶抑制剂,对SARS-CoV-2 Mpro无活性,主要通过抑制P糖蛋白(P-gp)及CYP3A介导的奈玛特韦代谢,从而升高奈玛特韦血药浓度,发挥协同作用。体外研究结果显示,奈玛特韦与利托那韦联合应用,使奈玛特韦抗病毒活性增强10倍[7]。综上所述,莫诺拉韦胶囊作用机制明确得4.00分;阿兹夫定片与莫诺拉韦胶囊相比作用靶点有创新,得5.00分;奈玛特韦片/利托那韦片属新靶点药物,有创新,得5.00分。
2.1.2 体内过程:(1)阿兹夫定片尚未在COVID-19患者中开展大规模药动学研究,基于前期HIV感染患者连续7 d服用4 mg的数据,阿兹夫定片的药动学过程基本符合线性药动学特征[8]。服用后胸腺分布最多,其次为脾脏,在心、肝、肺等其他组织分布较少,血浆蛋白结合率较低,在体内基本不代谢,主要以原型药通过肾脏排泄。(2)莫诺拉韦为前体药物,进入体内后几乎不与血浆蛋白结合,在体内被水解为活性5’-异丁酸酯(NHC),NHC不在肝内代谢,最终由体内嘧啶代谢途径消除,经尿液排泄不超过3%,肝肾功能异常对药物体内过程影响较小[9]。(3)健康受试者单次口服奈玛特韦片/利托那韦片300 mg/100 mg后的数据显示,奈玛特韦具有非线性药动学特征[10]。吸收方面,高脂餐可使奈玛特韦片/利托那韦片的曲线下面积(AUC)升高约1.5%,故该药可与食物同服。奈玛特韦主要以原型药存在于血浆中,少量经肝脏代谢为无活性水解产物。奈玛特韦主要由CYP3A4代谢,能可逆性地抑制CYP3A4和MDR1,对其他肝药酶CYP无诱导作用。利托那韦主要经肝脏代谢,其既是CYP3A和CYP2D6的底物,又是CYP3A和CYP2D6的抑制剂,但对CYP2D6的抑制作用弱于CYP3A。利托那韦与奈玛特韦联合应用时,能够抑制奈玛特韦的代谢[7]。奈玛特韦主要以原型药经肾脏排泄,尿液、粪便中排泄比例约为49.6%、35.3%,利托那韦约86%主要经肝胆系统清除[10]。上述三药的体内过程均较明确,主要药动学参数见表2。阿兹夫定目前主要依据HIV治疗数据,缺乏COVID-19患者药动学参数,得4.50分;奈玛特韦片/利托那韦片和莫诺拉韦胶囊数据较完整,得5.00分。

表2 三药的主要药动学参数比较
2.1.3 药剂学/使用方法、储存及效期:阿兹夫定片与莫诺拉韦胶囊主辅料均明确,注意阿兹夫定片辅料中含乳糖,乳糖不耐受患者禁用。奈玛特韦片/利托那韦片主药明确,但辅料未标注。三药均为口服剂型,可自行给药。包装均较适宜,1盒均为1个疗程剂量,单片剂量与单次用量换算方便。(1)阿兹夫定片推荐出现SARS-CoV-2核酸或抗原检测阳性后48 h内服用,1日1次,1次5 mg口服(整片吞服,不可嚼服或碾碎,可溶解后管饲),疗程≤14 d,肝肾功能异常需减量。(2)奈玛特韦片/利托那韦片推荐出现SARS-CoV-2核酸或抗原检测阳性后5 d内服用,1日2次,1次奈玛特韦300 mg(2片)+利托那韦100 mg(1片)口服(整片吞服,不可嚼服或碾碎,可溶解后管饲),疗程5 d。肾功能异常需调整剂量,肌酐清除率为30~60 mL/min,推荐奈玛特韦减量至1次150 mg(1片);肌酐清除率<30 mL/min,不推荐使用。轻中度肝功能异常无需调整剂量。(3)莫诺拉韦胶囊推荐SARS-CoV-2核酸或抗原阳性后5 d内服用,1日2次,1次800 mg口服(可取胶囊内容物溶解后服用或管饲),疗程5 d,肝肾功能异常均无需调整剂量。三药各项得分情况见表3。
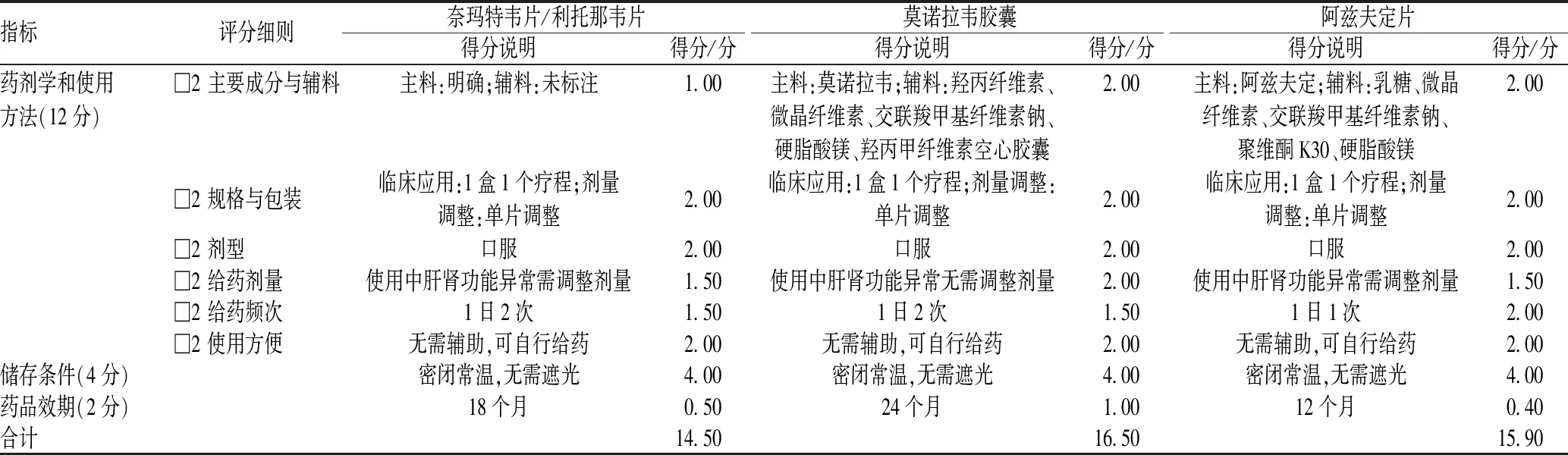
表3 三药的药剂学/使用方法、储存条件及药品效期得分
2.2 有效性
2.2.1 适应证:(1)阿兹夫定片是我国首个自主研发并拥有全球专利的口服小分子COVID-19治疗特效药物,既往用于治疗获得性免疫缺陷综合征患者,2021年7月25日被国家药品监督管理局批准增加治疗COVID-19的适应证,目前推荐用于治疗成人普通型轻中度COVID-19[1]。(2)莫诺拉韦胶囊是美国默沙东公司和Ridgeback生物治疗公司联合开发的全球首个COVID-19治疗用新型小分子口服药物,2022年12月29日在我国获批上市。(3)奈玛特韦片/利托那韦片由美国辉瑞公司研发,2022年2月11日在我国获批上市。目前,奈玛特韦片/利托那韦片与莫诺拉韦胶囊在国内被批准用于治疗成人轻、中型伴进展为重型高风险因素的患者[1]。这些高风险因素包括:高龄(年龄≥60岁);肥胖或超重(体重指数≥30 kg/m2);重度吸烟者;晚期妊娠和围产期女性;患有基础疾病,如心脑血管疾病(含高血压)、慢性肺部疾病、糖尿病、慢性肝脏疾病、慢性肾脏疾病、肿瘤等;免疫功能缺陷(如获得性免疫缺陷综合征、长期使用皮质类固醇或其他免疫抑制药物导致免疫功能减退状态)。阿兹夫定片无论患者是否存在高风险因素均可服用,得5.00分;但奈玛特韦片/利托那韦片和莫诺拉韦胶囊目前仅推荐用于存在发展为重度高风险因素的患者,属临床附条件使用,得4.50分。
2.2.2 指南推荐:目前,国内外COVID-19相关诊疗指南均推荐奈玛特韦片/利托那韦片(Ⅰ级推荐,B级证据)和莫诺拉韦胶囊(Ⅰ级推荐,A级证据)为一线抗病毒治疗用药。此外,我国还将阿兹夫定片(Ⅰ级推荐,B级证据)作为不同机制的一线抗病毒治疗替换药物列入指南,具体用药推荐见表4。故奈玛特韦片/利托那韦片得11.00分,阿兹夫定片得10.50分,莫诺拉韦胶囊得9分。

表4 三药在国内外COVID-19治疗指南/专家共识中被推荐情况
2.2.3 临床疗效:COVID-19的临床疗效主要指标为病毒载量、症状缓解率、住院率等,次要指标为不良反应发生率、死亡率等。(1)阿兹夫定片。在俄罗斯开展的一项前瞻性、双盲对照研究中,纳入314例重症COVID-19患者,治疗第7日,观察
组(阿兹夫定片组)40.43%的患者症状有改善,而安慰剂组只有10.87%,显示了阿兹夫定的疗效。一项在我国开展的临床随机对照试验,纳入348例普通轻型COVID-19患者,随机分配为安慰剂组和观察组(阿兹夫定片组),阿兹夫定片组治疗第3、5、7日病毒载量下降值均大于安慰剂组[4]。我国另一项纳入20例普通轻型COVID-19患者的小样本随机对照研究中,与安慰剂组比较,观察组(阿兹夫定片组)患者服药后核酸转阴率更高(第4日:100%vs. 30%;第6日:100%vs. 40%,P<0.05),且观察组未出现3级以上不良反应,可见阿兹夫定片在COVID-19治疗中疗效确切,耐受性良好[16]。(2)奈玛特韦片/利托那韦片。美国开展的一项随机双盲对照试验(EPIC-HR研究)评价了奈玛特韦片/利托那韦片的临床疗效及安全性,纳入症状出现在5 d以内的门诊高危COVID-19患者2 246例,随机分为观察组(奈玛特韦片/利托那韦片组)和安慰剂组,结果显示,治疗3 d时观察组患者病毒载量较安慰剂组降低约10倍;治疗28 d时观察组患者全因死亡率比安慰剂组更低(0.77%vs. 7.01%,P<0.001),相对风险降低89.1%,可见奈玛特韦片/利托那韦片治疗COVID-19有效[17]。(3)莫诺拉韦胶囊的临床疗效主要基于2个研究。MOVe-OUT研究[18]共纳入患者1 433例,其中期结果显示,随机分组后的29 d,莫诺拉韦组中有7.3%的患者住院、0例死亡,安慰剂组中有14.1%的患者住院、8例死亡,与安慰剂组比较,莫诺拉韦组的绝对风险降低了5.0%、相对风险降低了50%;整体研究结束时,与安慰剂组比较,莫诺拉韦组的住院/死亡风险更低(6.8%vs. 9.7%),绝对风险降低了3.0%、相对风险降低了30%;但与中期数据相比,研究结束时莫诺拉韦胶囊整体有效性(中期50%vs. 末期30%)有所下滑。另一项MOVe-IN2研究[19]纳入发病10 d内的住院患者,安慰剂组与莫诺拉韦组在治疗结束时未显示出明显的临床获益(所有组持续恢复的中位时间皆为9 d),可见莫诺拉韦胶囊疗效在住院患者中受到局限。2022年10月,《柳叶刀》发布了一项中国香港关于COVID-19口服药莫诺拉韦胶囊和奈玛特韦片/利托那韦片治疗COVID-19奥密克戎感染有效性的真实世界研究,该研究收集了2022年2月26日至6月26日11 847例服用过莫诺拉韦胶囊或奈玛特韦片/利托那韦片的COVID-19患者的病历记录,大多属于COVID-19的高危人群(年龄≥60岁)且未完成疫苗接种[20]。该研究发现,莫诺拉韦胶囊治疗组的全因死亡率为17.9/100 000人日,相比对照组降低了24%;奈玛特韦片/利托那韦片治疗组的全因死亡率为4.2/100 000人日,相比对照组降低66%,奈玛特韦片/利托那韦片显示出更优的疗效。综上所述,奈玛特韦片/利托那韦片的疗效优于莫诺拉韦胶囊,得(6.00+4.00)分;莫诺拉韦胶囊得(5.00+3.50)分;阿兹夫定片多为小样本研究且无与奈玛特韦片/利托那韦片或莫诺拉韦胶囊的头对头研究,得(5.50+3.50)分。
2.3 安全性
2.3.1 不良反应:(1)阿兹夫定的轻中度不良反应以发热、头晕、恶心、血小板计数升高较为常见。根据其Ⅱ期临床研究结果[4,16],发生率最高的不良反应为头晕(约50%),其他常见的不良反应为肝酶升高(约25%)、血尿酸升高(约15%)、血细胞异常(中性粒细胞减少及血小板计数升高多见),严重程度主要为1—2级,一般无需处理,停药后可自行缓解。整个研究中无与阿兹夫定相关的严重不良反应及死亡病例。(2)奈玛特韦片/利托那韦片的轻中度不良反应以腹泻(3%)、味觉减退(6%)较为常见[15];偶见头晕、呕吐、消化不良、肌痛(1%)及肝酶升高(以丙氨酸转氨酶及天冬氨酸转氨酶升高为主)。严重不良反应如结肠炎、阿弗他溃疡(<0.01%)及呼吸困难等罕见。(3)莫诺拉韦胶囊的Ⅱ/Ⅲ期临床研究显示,常见轻中度不良反应为腹泻(1.7%)、恶心(1.4%)、头晕(1%),3—4级的严重不良反应如肝功能异常、血细胞异常的发生率均≤2%,一般干预治疗或停药后可缓解[18-19]。综上所述,阿兹夫定的轻中度不良反应发生率高于其余两药,但未发现严重不良反应,得(1.00+5.00)分;奈玛特韦片/利托那韦片的常见轻中度不良反应发生率<10%,严重不良反应罕见,得(2.00+4.50)分;三药中,莫诺拉韦胶囊的轻中度不良反应发生率最低,但其3—4级严重不良反应发生率高于其他两药,得(2.50+4.00)分。
2.3.2 特殊人群:(1)儿童用药推荐。目前,三种药物在我国均不推荐用于儿童患者,尤其奈玛特韦片/利托那韦片因其对儿童软骨发育有影响,我国《新型冠状病毒感染诊疗方案(试行第十版)》已不推荐其用于儿童患者。但欧美国家仍推荐奈玛特韦片/利托那韦片用于≥12岁且体重≥40 kg的儿童轻中型患者。(2)妊娠及哺乳期妇女用药推荐。阿兹夫定片的非临床生殖毒性试验结果显示,药物可致胎儿畸形,且可分泌至母乳,对乳儿造成伤害,故妊娠期及哺乳期妇女禁用[8]。奈玛特韦片/利托那韦片的大鼠胚胎实验结果显示,药物对胎儿无明显毒害作用,但未进行相关人群试验,推荐妊娠期妇女在必要时权衡利弊使用。因缺乏药物在乳汁中分泌相关研究数据,无法排除药物对乳儿的影响,建议奈玛特韦片/利托那韦片治疗期间及停药后7 d内停止哺乳[17]。莫诺拉韦胶囊的动物生殖毒性试验结果显示,其可能会对胎儿造成伤害,故妊娠期妇女不推荐使用[6]。莫诺拉韦胶囊活性代谢产物可分泌至乳汁,对乳儿造成不良影响,建议用药期间及停药后4 d内禁止哺乳。其余特殊人群用药推荐及各项得分见表5。
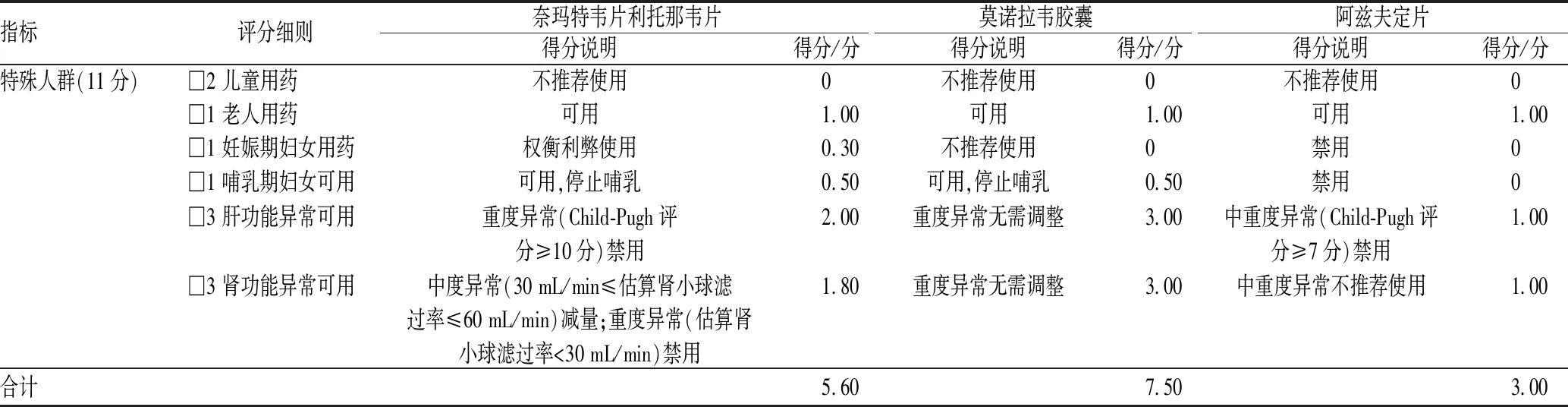
表5 三药的特殊人群用药推荐及得分
2.3.3 药物相互作用所致不良反应:阿兹夫定片为P-gp底物及弱效P-gp诱导剂,合用P-gp底物(地高辛、达比加群酯、秋水仙碱)和P-gp抑制剂(伊曲康唑、伏立康唑、泊沙康唑等唑类抗真菌药,环孢素,蛋白酶抑制剂利托那韦,以及决奈达隆、胺碘酮、维拉帕米、克拉霉素、葡萄柚汁等),以及P-gp诱导剂(利福平、圣约翰草提取物)时需谨慎,必要时监测合用药物的血药浓度,酌情增减剂量[21]。莫诺拉韦胶囊不是特殊肝药酶及转运体的底物,目前尚未发现不良药物相互作用。奈玛特韦片/利托那韦片中的奈玛特韦为CYP3A4底物,且利托那韦为CYP3A4及CYP2D6的底物,存在较多药物相互作用,主要机制是与联合用药竞争上述2个主要代谢酶,导致血药浓度升高,出现相关不良反应。禁止与奈玛特韦片/利托那韦片联合应用的药物(包括但不限于)哌替啶、胺碘酮、普罗帕酮、夫西地酸、伏立康唑、氯氮平、喹硫平、辛伐他汀、洛伐他汀、西地那非、地西泮、艾司唑仑、卡马西平、利福平、苯妥英等。目前可通过以下3个途径进行相关药物相互作用查询,(1)利物浦DDI检查工具(www.covid19-druginter-actions.org);(2)诺道医学微信小程序中的“新冠治疗药学相互作用检索工具”;(3)用药助手、美康合理用药软件中的“药物相互作用”模块。综上,阿兹夫定片存在需要调整剂量的联合用药,得2.00分;莫诺拉韦胶囊暂无不良药物相互作用,得3.00分;奈玛特韦片/利托那韦片存在联合用药禁忌,得1.00分。
2.4 经济性及其他属性
目前三药均为单一厂家品种,阿兹夫定片疗程费用最低,已被纳入医保乙类用药,在我国及俄罗斯、巴西等地上市使用;奈玛特韦片/利托那韦片和莫诺拉韦胶囊价格较高,其中奈玛特韦片/利托那韦片疗程费用最高,两药均未列入医保,两药在我国及美国、欧洲、日本均已上市使用。三药的经济性及其他属性得分见表6。

表6 三药的经济性及其他属性得分
2.5 评测结果与应用推荐
应用上述卫生技术评估方法进行量化评分,最终阿兹夫定片得75.00分,莫诺拉韦胶囊得73.36分,奈玛特韦片/利托那韦片得71.78分,三者主要差别体现在有效性、安全性及经济性3个方面,见表7。根据三药评分结果推荐:(1)新药引进时,三药得分均>70分,属强推荐引进范围,可根据得分高低决定各药引进的优先级;(2)药品调整时,如医疗机构药物品种较多,可根据上述评分,优先保留阿兹夫定片,酌情选择总分较低的药品调出。

表7 阿兹夫定片、莫诺拉韦胶囊、奈玛特韦片/利托那韦片遴选量化评分(分)
3 讨论
3.1 评测结果分析
本研究通过快速遴选与评价,较全面地收集了新型口服小分子抗COVID-19药物的各项属性,单项得分可直观地反映出药品在不同属性中的优劣,前3项(药学特性+有效性+安全性)得分可体现药品在疾病治疗中的价值及优势,总分可体现药品的综合优势,该评价体系可多维度地为医疗机构合理引进及临床治疗合理使用药品提供较充分的循证学依据。
上述评估结果显示,前3项得分由高至低排序为莫诺拉韦胶囊>奈玛特韦片/利托那韦片>阿兹夫定片,可见除去经济性因素,莫诺拉韦胶囊在疗效与安全性的综合评估中更有优势,主要体现在肝肾功异常的患者仍可使用,且无需调整剂量;目前尚无不良药物相互作用,多药联合应用更安全,其轻中度不良反应发生率为三药最低,服药人群耐受性更好。其次为奈玛特韦片/利托那韦片,其疗效优于莫诺拉韦胶囊,但药物相互作用较多,许多合并基础疾病需联合应用其他药物的老年患者使用可能受限。阿兹夫定片与奈玛特韦片/利托那韦片、莫诺拉韦胶囊比较,其适用人群更广泛,无论有无发展为重型风险因素的轻中型成人患者均可使用,但安全性是三药中最低的,腹泻、头晕等不良反应发生率较高,患者耐受性差。三药总分由高至低排序为阿兹夫定片>莫诺拉韦胶囊>奈玛特韦片/利托那韦片,加上经济性因素,阿兹夫定片以实惠的价格而综合得分最高,医疗机构优先引进阿兹夫定片,会大大降低患者治疗的经济负担,优化公共卫生资源。此外,医疗机构可在选择引入阿兹夫定片的基础上,根据就诊人群特点及需求,酌情选择奈玛特韦片/利托那韦片或莫诺拉韦胶囊其一备用,则可满足部分特殊患者的需求。
本次评估的局限性:三药总分排序与前3项得分排序截然不同,可见经济性因素在本次评估中占有较高权重。如果根据评分结果只引进阿兹夫定片,对于需要多药联合应用的老年患者,可能因为药物相互作用禁忌,出现无药可用的情况,使患者失去有效治疗机会。
3.2 卫生技术评估量化评分应用解析
本研究基于《中国医疗机构药品评价与遴选快速指南(第二版)》优化评估方法,其结果为医疗机构遴选抗COVID-19优质特效治疗药物提供了新思路。与既往评分量表相比,本研究使用的新百分制评分量表在药学特性及有效性方面提高了分数配比,更重视药物本身治疗特点及治疗效果,更符合临床应用需要。此外,对药剂学与使用方法,安全性中的不良反应情况、特殊人群用药,以及其他属性中的生产企业状况3项评分按不同层级进一步细化配分,使各项评分可操作性更强、客观性更强、同质化程度更高,减少了评估结果的主观偏差。
但该评估体系也存在局限性,实践时应注意。(1)时效性:该评估方法中临床疗效、指南推荐、经济性、医保情况等方面会实时变化,药品得分应及时更新,以顺应疾病治疗发展趋势,并及时合理调整医疗机构药品目录。(2)配分合理性:该评价系统中经济性所占权重较高,对于一些难治病或罕见病,遴选药物时可能使价格较高的特效药物落选,造成患者无药可用的情况。实践时,可适当降低经济性配分权重,或在结果评判中增加前3项得分遴选标准,降低经济性因素的过强干扰。(3)打分灵活:评估过程中,可根据评分细则及实际需求对各维度评分适当调整,得分可精确至小数点后,以便灵活体现药品间差异。
