利用光学基因组图谱技术诊断杜氏肌营养不良1 例报告
2024-02-25张惠文
梁 欢 张惠文
上海交通大学医学院附属新华医院 上海市儿科医学研究所 儿内分泌遗传科(上海 200092)
杜氏肌营养不良(Duchenne muscular dystrophy,DMD,OMIM 310200)是一种X 连锁隐性遗传的肌营养不良症,在活产男婴中的患病率约为1/6000~1/4000[1],女性病例较为罕见[2]。该病的致病基因位于染色体Xp 21 的抗肌萎缩蛋白基因(dystrophin,DMD,OMIM 300377),有79个外显子,长达2.5Mbp,是人类最大的基因之一[3]。DMD基因编码抗肌萎缩蛋白,该蛋白主要分布在骨骼肌和心肌细胞的细胞膜上,起支架作用,能保护肌细胞膜在肌肉收缩时免遭损伤。DMD基因变异导致抗肌萎缩蛋白功能异常,引起肌细胞损伤,进而出现进行性肌肉坏死、萎缩,可导致两种肌病——贝氏肌营养不良和杜氏肌营养不良,后者较重,主要表现为进行性肌无力、发育迟缓和/或发育倒退,最终出现呼吸衰竭及心力衰竭等,体格检查可发现腓肠肌假性肥大、肌力下降等体征。
目前,在DMD 患者中发现了几千种不同的DMD基因变异[4-5],约60%~70%为片段缺失,5%~15%为片段重复,另有20% 为点突变、小缺失或插入,而倒位突变较为罕见,不足1%[6]。因而针对片段缺失/重复检测的多重连接依赖性探针扩增分析(multiplex ligation-dependent amplification,MLPA)为DMD 的主要检测手段。对于MLPA 阴性者,可选择二代测序技术,以发现一些微小变异。需要注意的是,即使综合这几种检测手段,仍有约7%的患者找不到致病变异[7]。
光学基因组图谱(optical genome mapping,OGM)是一项基于纳米通道的基因作图技术,利用基因组中的特定序列位点直接对大分子DNA 进行荧光标记,实现DNA 分子的线性光学成像,在识别基因组的结构变异方面具有独特的优势[8-9]。此前,相关研究用OGM对11例DMD患者进行了遗传验证,准确地确定了突变删除、重复和反转的断点,还发现该方法能够识别涉及DMD基因的5.1-Mbp倒位[10]。这表明OGM 能够灵敏且准确地识别基因组结构变异,有望成为临床基因诊断的新方法。
在此,我们报道1 例DMD 患儿,该患儿在进行了MLPA和全外显子测序后,均未发现致病变异。通过OGM检测,成功识别出1个长达711kb的臂内倒位突变,涉及DMD基因44~55号区段的12个外显子,破坏了该基因的正常结构,属于致病性变异,成功实现了该患儿的分子诊断。
1 对象与方法
1.1 研究对象
回顾性分析2020年6月12日在上海交通大学医学院附属新华医院儿内分泌遗传科就诊的1例DMD患儿的临床资料。本研究已获得监护人知情同意并通过上海交通大学医学院附属新华医院伦理委员会审查(No.XHEC-D-2022-101)。
1.2 方法
1.2.1 临床资料收集 通过新华医院电子病历系统收集该患儿的临床表现和诊断过程。
1.2.2 基因检测方法 ①MLPA:对DMD基因的79 个外显子利用天昊公司试剂盒进行缺失/重复检测。②全外显子测序:以患儿外周血基因组DNA为检测材料,先将基因组DNA 打断并制备文库,然后通过BGI V 4 芯片对目标基因外显子及临近剪切区的 DNA 进行捕获和富集,最后使用MGISEQ-2000测序平台进行变异检测。测序片段通过罗伯斯-惠勒比对工具(Burrows-Wheeler-alignment tool,BWA)与加州大学圣克鲁兹分校(university of California Santa Cruz,UCSC)hg19人类参考基因组进行比对。使用基因组分析工具包(genome analysis toolkit,GATK)进行碱基质量值校正单核苷酸位点突变、小的插入或删减和基因型检测。使用 ExomeDepth 进行外显子水平的拷贝数突变检测。③光学基因组图谱技术:使用Bionano Prep KitsTM从新鲜血液中提取并标记大分子量的基因组DNA,然后将其装载在Saphyr芯片(®G 2.3)上进行线性化,使用Saphyr仪器进行光学成像。通过对原始数据结果预处理、组装,对比到人类参照基因组hg 38。对相关指标进行分析,数据质控合格(表1),可进行下一步变异分析。
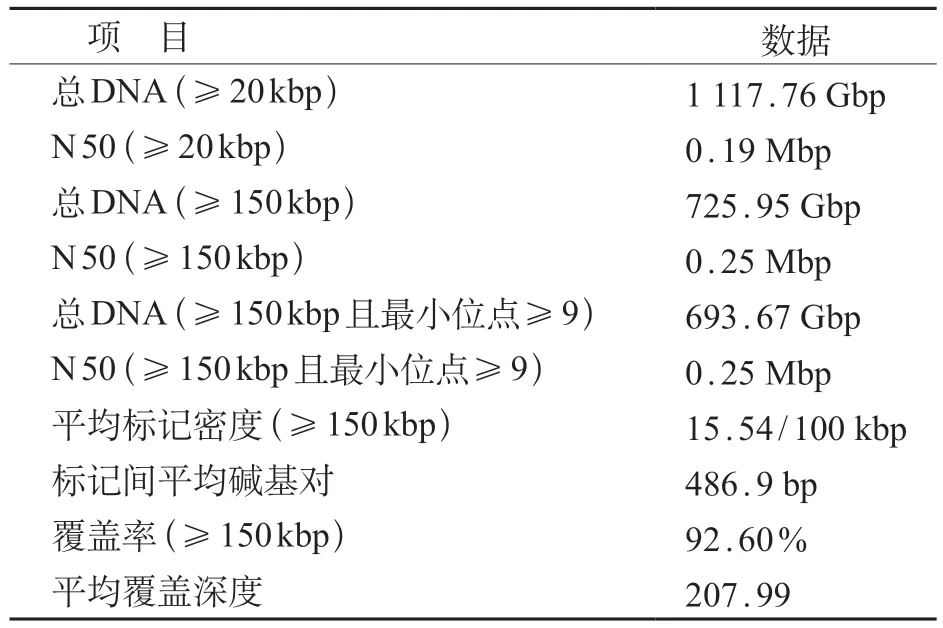
表1 OGM检测质控数据
2 结果
2.1 临床资料
患儿,男,汉族,2岁。2020年6月12日(7月龄)因肺炎住院治疗。血生化:肌酸激酶(CK)12 369U/L,显著高于正常参考值(55~170U/L),当时患儿能翻身、能独坐,无明显大运动发育落后,查体未发现腓肠肌肥大,针对DMD基因的MLPA检测未发现缺失/重复。10月龄时,进一步行全外显子组测序检测,未检出可解释CK显著升高的基因变异。21月龄时,家长发现患儿走路不稳,容易摔跤。自发病以来,患儿智力、语言发育正常。体格检查:神清,身材匀称,心肺腹部无异常,隐匿性阴茎,脊柱无侧弯,四肢无畸形,双侧腓肠肌肥大,肌力Ⅳ级,肌张力正常,腱反射可引出,无亢进或减弱。既往体健,由于患儿为领养,出生史和家族史不详。患儿的诊治时间轴见图1。

图1 患儿疾病进展与诊断过程图
2.2 基因检测结果
M L PA 结果显示,患儿D M D基因所有的79 个外显子未见缺失/重复突变。全外显子测序结果显示,未检出与患儿表型相关的基因变异。OGM 结果显示,患儿Xp 21.1 存在1 个臂内倒位突变:seq[GRch 38]inv(X)(p 21.1 p 21.1)chrX:31534761_32245846inv,断点分别位于DMD基因44号外显子的上游和55号外显子下游,倒位片段长约711.09 kbp,涉及DMD基因的44~55号区段的12个外显子,破坏了DMD基因的正常结构,属于致病性变异。倒位突变示意图如图2所示。
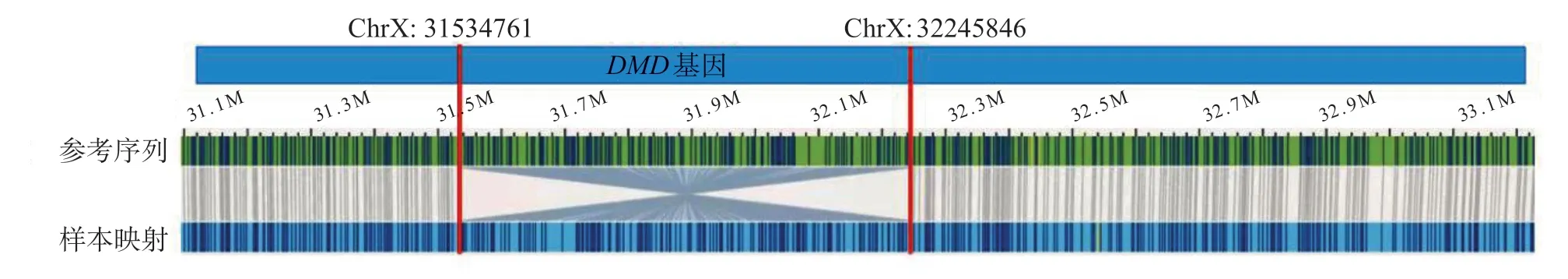
图2 DMD 基因倒位突变示意图
3 讨论
本例患儿在7 月龄时,发现血清CK 水平达正常值的50 倍以上,21 月龄时出现明显的肌无力症状,伴有双侧腓肠肌肥大,临床上高度怀疑为DMD。在MLPA 和全外显子检测阴性的基础上,选择了OGM 进一步检测,发现该患儿在Xp 21.1 存在1 个臂内倒位突变,两个断点均位于DMD基因内部,倒位片段长约711.09 Kbp,涉及DMD基因的自44 到55 号的12 个外显子,破坏了DMD基因的正常结构。按照Redin 等[11]提出的对平衡性染色体结构变异的分类标准:DMD基因变异与DMD 疾病表型的关系确切,且片段重排影响了该基因的功能区域,可判定该变异为致病性变异。依据DMD 多学科管理专家共识[12],DMD的确诊应该基于发现DMD基因致病性变异或存在抗肌萎缩蛋白完全缺失的证据,故该患儿可以诊断为DMD。
DMD基因是人类最大的基因之一[3],该基因区域内有99%以上的序列是内含子,含有丰富的可介导大片段基因重排的转座元件[13],结构的复杂性决定了该基因变异的多样性,因此,DMD的基因诊断需要结合多种检测方法。由于DMD基因变异中,大片段的缺失/重复占据主导,约80%左右[14-15],MLPA 是基于探针的扩增分析,可快速且准确地检出基因的大片段缺失或重复变异,故MLPA 成为了DMD患儿的首选检测手段,但该技术无法检出非缺失与重复的突变,这是本例患儿MLPA 检测阴性的原因所在。DMD基因变异常发生在编码区和/或相邻的非编码区[14-15],小片段的突变及单核苷酸变异在DMD患儿中也较为常见,故外显子靶向捕获二代测序和全外显子测序也是DMD 患儿常用的诊断手段。但是二代测序属于短读测序,在识别结构突变时存在固有的局限性。需要注意的是,即使综合上述几种基因检测方法,目前仍有约7%的患者找不到致病变异[7]。对于这种情况,以往的指南推荐进行肌肉活检以确认抗肌萎缩蛋白的表达情况[16-17],但肌肉活检为有创性检查,家长的接受度低。
由于MLPA 和二代测序的技术缺陷,导致无法检测出平衡性结构变异,这是一类染色体总量不变,特定片段定位或者方向改变(如易位、倒位)的结构变异。针对这类变异的检测方法有助于提升DMD患者的诊断率,目前临床上常用方法有核型分析、荧光原位杂交法(FISH)[18]。核型分析可检出染色体数目异常和显微水平的结构异常,具有直观、成本低的优点,在检测非整倍体方面具有强大优势,但受限于显带技术分辨率低(3~10 Mb),无法精确提供变异的具体位置和大小,对于浅带和带型差异较小的区域容易误判或漏判[19]。FISH主要用于特定染色体的变异验证,具有直观、分辨率高(40~250kb)的优点,但该技术只能利用定制探针对已知的位置进行检测,无法检测未知的变异[20]。
近年来,RNAseq和长读长测序技术也被用于平衡性结构变异的检测。RNAseq支持如剪接分析、等位基因表达分析和变异分析等多项分析,本身也是一种诊断工具。在一项原发性肌病的研究中发现[21],RNAseq 能够观察到异常的剪接序列,成功识别DMD基因上的结构突变并分析这些突变对RNA的影响,如发现2 种倒位突变引起剪切异常,1 种倒位/缺失突变引发了外显子跳跃。但RNAseq技术需要高质量RNA,较以DNA为原料的检测方法,样本提取、保存的要求高。长读长测序技术也能够识别出倒位变异,相关研究报道了1 位DMD 患者,在进行多项基因检测无果后,通过长读长全基因组测序发现了DMD基因的1 个倒位-删除-插入复杂重排突变[22],但是该项技术价格高昂,且算法难度高,目前难以在临床常规开展。因此,对于传统检测方法应用于倒位突变时的诊断窘境,OGM可能是一项颇具潜力的解决办法。
OGM 利用基因组中的特定序列位点对大分子DNA 分子进行荧光标记,无需经历打断、扩增及修饰等过程,可以实现直接标记的DNA 分子的线性光学成像[23],平均读长超过200kbp,可一次性检出多种不同类型的基因结构突变,包括缺失、易位、倒位、重复、插入、环状染色体、复杂重排和等臂染色体等[24]。与传统的染色体结构变异的检测手段相比,OGM 具有更高的分辨率,并且能够精确提供断裂位点信息与插入方向,在识别结构突变的方面具有独特优势。此前,相关研究发现OGM能够准确识别出8例DMD患者携带的各种结构突变,并能够提供结构突变的断裂位点信息,其中包括1个涉及DMD基因的长达5.1 Mb 的倒位突变,该突变此前已被RNAseq 方法检出[25],这表明OGM 技术能够高效、准确地检出DMD患者的致病变异。有研究对来自孤独症谱系障碍或智力障碍、先天性畸形、生殖障碍、染色体病和产检异常的85个样本进行验证,涉及缺失、重复、异位、倒位、环状染色体和复杂重排等多种类型的结构突变,结果发现OGM对于结构突变的检测结果与传统方法达到了100%的一致性,说明OGM检测具有较高的准确性[19]。近期,国内的一项研究也证实了OGM的诊断效能。研究者利用OGM技术,在9例核型异常的样本中检测结构突变,其中3 例为非平衡性结构突变,6 例为平衡性结构突变,包括5例易位和1例臂内倒位,检测结果与核型、芯片等传统方法一致,并能精细化断裂点位置,确定重复或插入的片段方向[26]。OGM除了能够发现DMD患者的致病变异以外,还能够识别母亲携带的结构突变[10],表明OGM在DMD诊断及携带者筛查中具有重要的临床意义。同时,OGM技术也存在一些局限性。由于OGM不涉及碱基序列的测定,分辨率受限于标记密度,故不能检出较小的突变(<500bp)。由于异染色质区域(如着丝粒、近端着丝粒染色体的短臂)为人类参考基因组序列的空白区域,故OGM无法检出断裂点或融合位点位于此区域的平衡性结构变异,但随着人类基因组序列的完善,OGM对于这些区段的结构变异检测也逐渐成为可能。此外,OGM 新发现的一些结构变异缺乏与表型之间的关联性,仍需更多的研究进行论证[27]。
综上,我们报道了1例DMD患儿,其进行MLPA和全外显子测序后均未明确病因。使用OGM发现在Xp 21.1 存在1 个臂内倒位突变,长约711.09 kbp,涉及DMD基因的44~55 号区段的12 个外显子,实现了该患儿的分子诊断。这表明,OGM能够成功识别DMD基因的倒位突变,有望成为DMD患儿的重要补充诊断手段。
