肾集合管癌10例临床及病理特征研究
2024-02-25王美玲冯振中吴继锋
乔 娟,王美玲,王 弦,秦 蓉,冯振中,吴继锋
(安徽医科大学第二附属医院病理科,安徽 合肥 230601)
肾集合管癌(CDC)是一种起源于肾髓质集合管(Bellini管)的恶性上皮肿瘤,是一种非常少见的肾细胞癌亚型。CDC恶性程度高、预后差,50%以上的患者在2年内死亡,近半数患者在首次确诊时已出现远处转移[1]。CDC的影像学图像及临床表现均无特异性,病理学检查是确诊的“金标准”。本文收集10例CDC病历资料分析其临床及病理学特征并复习相关文献,以提高对该肿瘤的认识。
1 资料与方法
1.1一般资料 选取2017年3月至2023年3月本院收治的9例CDC患者和会诊病例1例作为研究对象;其中男6例、女4例,年龄48~86岁,中位数66.9岁;左、右侧肾各5例;肉眼血尿1例,肉眼血尿伴尿频尿急2例,腰痛4例,腰痛伴肉眼血尿2例,间断发热1例;4例行超声检查,其中1例未见明显异常,1例诊断为肾囊肿,2例诊断肾占位性病变;CT或MRI检查均提示肾占位性病变,3例提示肿瘤侵及肾周及肾上腺;5例见腹膜后淋巴结转移,其中4例见肺、肝或骨转移。10例均行肾根治性切除术。
1.2方法 手术标本经10%中性福尔马林固定,常规取材、脱水、石蜡包埋、切片、HE染色。免疫组化染色采用EnViSion法,在Roche Benchmark ULTRA全自动机上进行;所用抗体CK、CK7、CK19、Pax-8、Vimentin、EMA、34βE12、CarbonicA Ⅸ、RCC、CD10、CD117、TFE3、TFEB、P504S、CK20、GATA3、INI-1、SDHB、CgA、Syn、CD56、Ki-67均购自上海罗氏制药有限公司和福州迈新生物技术开发有限公司。
2 结 果
2.1大体检查 肿瘤大部分位于肾中、上极髓质或髓质肾盂交界区,2例巨大肿瘤弥漫累及近整个肾组织;肿瘤最大直径4.5~15.0 cm,切面灰白灰黄,局灶灰褐伴坏死,质地中等,肿块界限不清,无假包膜;大部分见肿瘤侵及肾窦及肾周脂肪组织。
2.2HE染色检查 肿瘤均呈浸润性生长,肿瘤细胞排列呈不规则管状(图1A)、乳头状(图1B)、巢团状或实性片状(图1C),管腔内部分细胞呈靴钉样(图1D),肿瘤细胞高度异型,部分细胞胞浆透明,部分嗜酸性,细胞核大,核大小、形状不规则,核仁明显,核分裂象易见(图1E);9例肿瘤伴坏死(图1F),间质可见明显的促纤维结缔组织反应伴大量淋巴细胞浸润(图1G);3例中部分区域见肿瘤细胞呈梭形,伴肉瘤样分化(图1H);肿瘤组织与肾盂无明显移行,肾盂黏膜上皮无异型(图1I)。
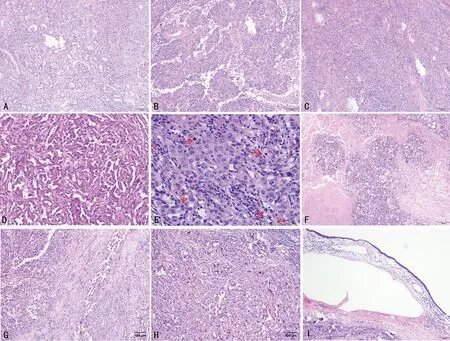
注:A.肿瘤细胞呈不规则管状(100×);B.肿瘤细胞呈乳头状,可见纤维脉管轴心,间质见多量淋巴细胞浸润(100×);C.肿瘤细胞呈巢团状(100×);D.肿瘤细胞部分呈靴钉样凸向管腔(200×);E.核分裂象(箭头,400×);F.肿瘤伴大片坏死,间质明显纤维化(右下,100×);G.肿瘤间质明显纤维化并见较多淋巴细胞浸润(100×);H.肉瘤样区,细胞梭形,异型明显(100×);I.肿瘤组织与肾盂无移行,肾盂黏膜上皮无异型(100×)。图1 CDC组织学特征结果(HE)
2.3免疫组化 肿瘤细胞表达CK、CK7(图2A)、CK19、Pax-8(图2B)、SDHB、INI-1,不同程度表达Vimentin、EMA、34βE12(图2C)、CarbonicA Ⅸ,RCC、CD10、CD117、TFE3、TFEB、P504S、CK20(图2D)、GATA3、CgA、Syn、CD56均阴性;Ki-67(图2E)增殖指数20%~70%。

注:A.肿瘤细胞CK7阳性;B.肿瘤细胞Pax-8阳性;C.肿瘤细胞34βE12阳性;D.肿瘤细胞CK20阴性;E.肿瘤细胞Ki-67增殖指数约70%。图2 免疫组化结果(EnViSion法,100×)
2.4随访 随访资料来源于住院、门诊病历资料及电话随访。本组10例病例,7例获得随访,3例失访。1例手术切除后行免疫、靶向及放化疗联合方案辅助治疗,其余6例术后均未行任何放化疗等辅助治疗。随访日期截至2023年8月31日,仅有1例(行辅助治疗)存活,其余6例均于术后2年内死亡,生存时间最短1个月,最长20个月。
3 讨 论
CDC是一种临床罕见的高侵袭性的肾细胞癌亚型,由FLEMING等[2]于1986年作为一种独立的病理学亚型首次描述,收集6例CDC分析其临床、病理学特征并提供免疫组化证据,显示其来源于肾集合管。1998年WHO肾肿瘤分类将其归为一种独立的肾细胞癌类型。FLEMING等[2]报道CDC约占肾癌的1%~2%,与文献报道CDC发生率相符[3-4],但有部分文献资料报道其发生率为0.06%~0.50%[5-8],明显不足1.00%,CDC发生率数据相差较大,可能是由于CDC少见,样本量局限。CDC发病年龄范围广泛,13~85岁,中位年龄43~63岁,男女比例2∶1;约2/3的患者有腰背部疼痛、血尿、疲劳及体重减轻等临床症状。本研究10例CDC患者,年龄48~86岁,中位年龄66.9岁,男性多于女性,临床症状以腰背部疼痛及肉眼血尿等为主,与报道相符[3]。
影像学检查(包括CT或MRI)是诊断肾肿瘤的重要方法,CDC在影像学上的表现有其自身的一些特点。CDC起源于肾髓质的集合管,当肿瘤很小时,肿瘤通常是圆形或类圆形,局限于肾髓质,肾脏的轮廓无明显改变。进展期肿瘤体积大,累及肾皮髓质、肾盂、肾周、肾周脂肪甚至向肾外突出及出现转移;CDC血供不丰富,CT平扫时表现为相等或稍高密度肿块,少数呈稍低密度。此外,增强CT扫描中,CDC内的增强值都低于肾皮质和髓质,且呈轻-中度延迟强化[6,8]。CDC的典型CT表现,包括髓质位置、不均匀和弱强化、肾窦受累、浸润性生长、肾轮廓保持等。该组CDC的影像学表现与报道中表现大致一致。但由于肿瘤生长快,通常在诊断时体积较大且弥漫浸润,影像学检查提示肿瘤无包膜,界限不清,无法明确肿瘤起源[7];同时这些影像学特点无特异性,无法良好的区分CDC与其他肾脏恶性肿瘤等占位性病变[1]。
影像学检查对诊断CDC具有一定的辅助意义,病理学诊断仍是诊断的“金标准”。大体上,肿瘤常位于髓质,肿块体积大,最大直径1.0~16.0 cm,切面灰白灰黄质韧,部分灰褐,伴出血及坏死,肿瘤边缘不规则,界限不清,呈浸润性生长,肿瘤侵至皮质,通常见肾脏外浸润[9-10]。本研究中CDC肿瘤最大直径为4.5~15.0 cm,10例中9例伴出血、坏死及其他大体表现均与文献相符[10]。组织学上,CDC主要表现为高级别管状、乳头状结构,具有特征性的浸润生长方式,间质见明显的促纤维结缔组织增生反应及较多以淋巴细胞为主的炎细胞浸润。肿瘤细胞呈立方、柱状或靴钉样,细胞高度异型,多形性明显,胞质嗜酸或透明,细胞核大,核仁明显,核分裂象易见,少数病例可见肉瘤样变或横纹肌样变。
CDC尚缺乏特异性免疫标志物,需联合组织学表现及多种抗体综合诊断[5];但其表型具有一定的共同特征,肿瘤细胞表达肾上皮细胞标记物(Pax-8、Pax-2)和Vimentin,同时表达高分子量角蛋白(CK19、34βE12)和CK7,联合检测一组抗体Pax-8、CK7、34βE12、CD10及Vimentin对诊断CDC有意义[11]。潘寿华等[3]研究中肿瘤细胞不表达或低表达CD10、Vimentin;但有文献显示,CK7表达不一[4]。该组CDC肿瘤细胞表达CK、CK7、CK19、Pax-8、SDHB、INI-1,不同程度表达Vimentin、EMA、34βE12、CarbonicA Ⅸ,Ki-67增殖指数20%~70%,免疫组化表达谱广泛,与既往相关报道基本一致。
目前,CDC的分子遗传特征研究有限,尚未发现特异的分子检测指标。杂合性丢失检测发现,CDC样本中多条染色体臂上均发生异常,染色体8q、16p、1p、9p的缺失及13q的获得[1,12]。PAL等[13]对17例CDC患者通过二代测序进行全面的基因组图谱分析,结果显示NF2(29%)和SETD2(24%)是最常见的基因组改变;同时发现约22%的患者存在FH纯合子缺失,并且FH和SMARCB1(INI1)的改变与NF2相互排斥。BRATSLAVSKY等[14]研究中46例CDC患者19%存在SMARCB1基因改变、14%存在NF2基因改变、8%存在FBXW7基因改变及8%存在CDKN2A基因改变。
2016版WHO肾脏肿瘤分类中提出CDC诊断标准:(1)累及肾髓质;(2)明显的小管样形态;(3)间质促纤维组织增生;(4)高级别的细胞学特征;(5)浸润性生长;(6)无伴随其他类型的肾细胞癌或尿路上皮癌。CDC组织学特征与多种肿瘤重叠交叉,并且尚缺乏明确特异的免疫表型及分子改变,因此CDC的诊断条件中很多不具有诊断特异性,目前以排除性诊断为主[15]。鉴别诊断包括:(1)肾髓质癌。主要发生在年轻人,以男性为主(男女比例10∶1),所有患者均有镰状细胞贫血,90%以上为非洲人;肿瘤细胞呈条索状或吻合呈网状,细胞异型明显;肾髓质癌及CDC均见间质纤维组织增生及炎细胞浸润,不同的是CDC主要以淋巴细胞浸润为主,而肾髓质癌可见中性粒细胞、淋巴细胞和嗜酸性粒细胞等多种炎细胞浸润,同时可见明显的微脓肿形成[16]。分子遗传学INI1基因失活,INI1蛋白表达缺失,OTC3/4的表达也有助于鉴别。(2)浸润性高级别尿路上皮癌。尿路上皮癌与CDC的术后治疗方法及预后不同,明确区分二者具有重要的临床及预后意义。尿路上皮癌位于肾盂,呈巢团状浸润肾间质,缺乏CDC细胞在管腔内呈靴钉样的特点,常伴有尿路上皮异型增生或原位癌;免疫组化GATA3+或p63+/PAX8-支持尿路上皮癌的诊断[17]。(3)高级别乳头状肾细胞癌。多位于肾皮质,常有假包膜,与周围组织界尚清;镜下癌细胞呈乳头状排列,乳头轴心及间质可见泡沫样细胞、砂粒体及含铁血黄素沉积,间质无明显促纤维增生反应及炎细胞浸润;免疫组化P504S、CK7、CD10阳性。(4)延胡索酸水合酶缺陷型肾细胞癌。组织学特征主要表现为乳头状、管囊状、实性片状、筛网状等不同结构混合存在,瘤细胞均有病毒包涵体样嗜酸性大核仁及核周空晕;免疫组化FH阴性、2SC阳性及FH基因突变检测有助于明确诊断[18-19]。
CDC是高度侵袭性恶性肿瘤,预后差,目前根治性肾切除术及局部淋巴结清扫是治疗的主要方法。但大多数患者首次诊断时就已经出现淋巴结转移或远处转移,手术后患者的生存率较差。一些治疗方案,包括化疗、放疗和免疫治疗,在大多数CDC患者中并没有显示出良好的反应。目前,吉西他滨-顺铂方案被认为是转移性CDC的一线全身治疗;免疫治疗或靶向治疗在CDC治疗中的作用尚未明确[6,20-21]。本组中1例患者术后行免疫、靶向及放化疗联合方案辅助治疗,已存活20个月,治疗效果有待继续随访。
CDC是一种罕见的肾细胞恶性肿瘤,病程短、进展快,常远处转移,预后差。手术治疗仍是目前主要的治疗方法。术后联合放化疗、免疫治疗或靶向治疗可能使患者受益;早诊断、早治疗有助于提高患者的生存率,改善预后。
