甲状腺全切+L-T4皮下注射建立孕期亚临床甲减大鼠模型及稳定性研究*
2024-02-25李晓钰黄杨玲谢良卓
李晓钰,付 强,黄杨玲,谢良卓,陈 巍,2△
(1.辽宁中医药大学研究生学院,辽宁 沈阳 110847;2.辽宁中医药大学附属第二医院干诊科,辽宁 沈阳 110034)
亚临床甲状腺功能减退症(SCH)简称亚临床甲减,其主要特点是血清促甲状腺激素(TSH)升高,而血清游离甲状腺素(FT4)水平正常[1-2]。SCH在我国的患病率为16.7%[3],其中妊娠期SCH的发病率占2.0%~5.0%[4],因其可影响后代脑发育及增加母体流产的发生率而被重视,但关于该病的发病机制尚未明确,是内分泌领域研究的热点问题。因此,更好地建立妊娠期SCH大鼠模型对该病的研究具有重要意义。本研究应用甲状腺全切术+L-T4皮下注射的方法进行孕期SCH大鼠造模,并对其进行模型评价。
1 材料与方法
1.1研究对象 实验对象为26只体重在180~200 g的雌性SD大鼠(购自北京华阜康生物科技股份有限公司),实验动物许可证号为:SCXK(京)2019-0008。SD大鼠饲养于辽宁中医药大学动物实验中心(SPF级实验室),给予普通饲料适应性喂养1周。
1.2方法
1.2.1实验用药 T4(美国Sigma公司,XW00514 891);乳酸钙(批号:C190420P)。
1.2.2分组与造模 将26只SD大鼠在SPF级实验室经适应性喂养1周后,并进行分组,随机分为2组(对照组10只,模型组16只)。术前禁饮24 h,用10%、0.35 mL/100 g剂量的水合氯醛注射液进行腹腔注射麻醉,术中局部切口给予23单位注射用青霉素钠盐3~4滴以防感染,术后对照组给予高钙水。具体操作:模型组将大鼠呈仰卧姿势固定在实验室手术板上,颈部进行备皮,然后用75%浓度的乙醇局部消毒,铺巾,沿胸骨向前行1.5~2.0 cm的颈部正中切口,钝性分离皮下组织,逐一钝性分离结缔组织、肌肉层,可见一呈蝴蝶型粉色附着于气管上的甲状腺组织,将气管与两侧肌肉分离,取甲状腺底部,剥离,并将小块棉球塞于术侧进行止血,再用上述方式处理对侧。注意要将气管上的甲状腺峡部剥离,术中避免损伤颈部动脉与静脉血管,避免长时间夹持气管。切口用生理盐水进行冲洗,再用无菌纱布擦干术野,在切口处滴注23单位的注射用青霉素钠盐3~4滴以防止感染,后将肌肉、皮肤切口分层缝合。术后予以普通饲料和0.1%乳酸钙饮用水饲养,以防术后缺钙。对照组仅充分暴露甲状腺后,立即缝合。术后1个月,2组大鼠进行眶后静脉丛取血,离心后取上清液,存放于EP管中待检测。
当模型组血清TSH值高于对照组最大值,且TT4值小于对照组最小值时,则提示甲状腺全部切除干净,模型组予以L-T41.0 μg/(100 g·d)皮下注射,对照组给予等剂量生理盐水皮下注射,每天检测体重,根据体重调整L-T4给药剂量,10 d后再次检测血清TSH、TT4。当模型组血清TSH值高于对照组最大值,且TT4值与对照组数值无明显差异时,则提示非孕期SCH模型建立成功。非孕期SCH模型建立成功后,以雌鼠:雄鼠=2:1的比例进行合笼交配,每天进行阴道涂片,当雌鼠的阴道涂片在镜下发现精子时,记为妊娠0 d即E0,妊娠13 d记为E13,并在此期间皮下注射L-T4。
1.2.3指标监测 监测2组大鼠术后1个月、甲状腺全切+L-T410 d后、E13这3个时间点的血清TSH、TT4水平和体重,以及各组大鼠平均产子数量及生产率。采用ELISA方法检测血清TSH水平(术后TSH检测试剂盒:武汉优尔生;CEA463Ra-48T/术后+L-T4TSH检测试剂盒:德国LDN;ARE-8600-48T/E13TSH检测试剂盒:CEA463Ra)。采用放免法检测TT4水平(中国医科大学放射免疫科检测)。
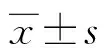
2 结 果
2.12组大鼠不同时期血清TSH水平变化比较 模型组大鼠术后1个月血清TSH水平高于对照组,差异有统计学意义(P<0.01)。甲状腺全切+L-T410 d后,模型组大鼠血清TSH水平高于对照组,差异有统计学意义(P<0.01)。妊娠13 d时,模型组大鼠血清TSH水平明显高于对照组,差异有统计学意义(P<0.01)。见表1。

表1 2组大鼠不同时期血清TSH水平变化比较
2.22组大鼠不同时期血清TT4水平变化比较 模型组大鼠术后1个月血清TT4水平小于对照组,差异有统计学意义(P<0.01)。2组大鼠甲状腺全切+L-T410 d后血清TT4水平比较,差异无统计学意义(P>0.05)。妊娠13 d时,2组大鼠TT4水平比较,差异无统计学意义(P>0.05)。见表2。

表2 2组大鼠不同时期血清TT4水平变化比较
2.32组大鼠不同时期体重变化比较 2组大鼠术前体重比较,差异无统计学意义(P>0.05)。术后1个月、甲状腺全切+L-T410 d,模型组大鼠体重明显低于对照组,差异有统计学意义(P<0.01)。妊娠13 d时,模型组大鼠体重明显低于对照组,差异有统计学意义(P<0.01)。见表3。
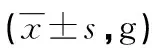
表3 2组大鼠不同时期体重比较
2.42组大鼠平均产子数及生产情况比较 2组大鼠平均产子数均为12只,差异无统计学意义(P>0.05)。对照组大鼠生产率[90.00%(9/10)]高于模型组[43.75%(7/16)],但差异无统计学意义(P>0.05)。
3 讨 论
妊娠期SCH是一种内分泌疾病,其对妊娠结局有着显著的不良影响,如流产、妊娠期高血压、胎盘早剥、先兆子痫、妊娠糖尿病、宫内生长受限、早产和低出生体重[5-8]。此外母体甲状腺激素水平对维持正常的妊娠和胎儿生长发育起着关键作用,与后代的神经智力发育障碍密切相关[9]。妊娠期母体甲状腺激素需求持续增长,若孕妇无法适应甲状腺激素应激反应,易导致内分泌紊乱,增加妊娠期甲状腺功能减退风险[10]。相关研究指出,妊娠期SCH同样可增加不良妊娠结局风险[11]。甲状腺激素在胎儿脑发育过程中占据着重要地位,在妊娠12周以前,胎儿甲状腺功能尚未完全建立,胎儿脑发育所需的甲状腺激素几乎全部依赖于母体供给[12];如果在妊娠期间,母体发生甲状腺激素缺乏,将会对胎儿神经系统的发育造成明显且不可逆转的损伤[13],可引起记忆力减退及情感行为障碍,其发病机制与脑组织处于轻微甲状腺激素缺乏有关[14]。由于SCH具有隐匿性、无明显症状反应,仅有TSH水平呈轻度或中度升高,易被临床筛查忽略或漏诊,因此妊娠期SCH患病率并未得到控制[15]。
妊娠中的SCH具有越来越重要的临床意义,因此建立可靠的模型是进行各项研究的基础与关键。目前,SCH的造模方式分为2种:第1种是应用抗甲状腺药物,例如甲巯咪唑饮水喂养构建SCH模型[3];第2种是应用甲状腺全切术再植入L-T4微渗泵,并根据体重的变化调整L-T4给药剂量来构建SCH模型[16]。由于抗甲状腺药物致使母鼠SCH的同时还会影响胚胎的发育,所以一般采用甲状腺全切术再植入L-T4微渗泵作为比较理想的造模方式。在母鼠品种的选择上,SD大鼠和Wistar大鼠是目前使用最多、应用最广泛的2个品系,主要应用于生理学、营养学、药理学、毒理学、肿瘤学及环境污染与人类健康等研究[17]。与Wistar大鼠相比,SD大鼠产仔多、生长发育快、适应性和抗病能力更强[18]。有研究表明,保持在室温下的SD大鼠具有更高的生长率和食物转化率[19],且SD大鼠的胎儿畸形率和变异率较低[20]。如果进行发育型研究,则选用SD大鼠造模更为合适。迄今为止,已经明确人类和大鼠孕期与甲状腺激素相关主要事件发生的对应时间:母鼠E13(T3受体在胚胎大脑表达)相当于人类妊娠12周[21]。因此,本实验选用SD大鼠建立理想的动物实验模型。本实验采用甲状腺全切术,再行L-T4皮下注射法建立非孕期SCH大鼠模型,并在人类与大鼠孕期甲状腺激素水平相对应的时间点进行血清TSH、TT4的测定,以确定孕期SCH大鼠模型建立是否成功。与对照组比较,模型组大鼠血清TSH明显升高、TT4无明显差异,则提示孕期SCH大鼠模型建立成功。本研究结果表明,采用甲状腺全切术、1.0 μg/(100 g·d)L-T4皮下注射可以成功建立非孕期SCH大鼠模型,并在大鼠E13时测定血清TSH、TT4水平,与对照组比较,血清TSH水平明显升高、TT4水平无明显差异,则证明大鼠仍处于SCH状态,说明大鼠妊娠E0~E13给药剂量可不做改变。
综上所述,采用SD大鼠行甲状腺全切术,再行L-T4皮下注射法可以成功建立稳定的孕期SCH动物模型,为今后寻求治疗该疾病更有效的方法及更好地控制妊娠期SCH的发展提供基础。
