安罗替尼联合信迪利单抗同步放化疗治疗驱动基因阴性非小细胞肺癌临床研究*
2024-02-25吴春锋朱惠平柳燕冬
吴春锋,蒋 健△,朱惠平,柳燕冬
(1.苏州大学附属张家港医院,江苏 张家港 215600;2.苏州大学附属第一医院,江苏 苏州 215004)
非小细胞肺癌(NSCLC)是全球肿瘤相关死亡的主要原因,40%~50%的NSCLC 患者驱动基因为阴性,既往的治疗方案为传统放化疗。随着免疫检查点抑制剂及抗血管生成靶向药物的应用,综合治疗已用于驱动基因阴性的NSCLC 的治疗[1]。安罗替尼为多靶点酪氨酸激酶抑制剂,通过抑制肿瘤血管生成和肿瘤生长而发挥抗肿瘤作用,可延长NSCLC 患者的总生存期(OS)和无进展生存期(PFS)[2]。信迪利单抗为程序性死亡受体1(PD-1)抑制剂,通过阻断程序性死亡配体1(PD-L1)的活化,减少调节性T 淋巴细胞的凋亡,调节抗肿瘤免疫应答,发挥抗肿瘤作用[3]。信迪利单抗已获得国家药品监督管理局(NMPA)批准,可联合化学治疗(简称化疗)一线治疗NSCLC,但少见用于驱动基因阴性NSCLC患者。本研究中探讨了安罗替尼联合信迪利单抗同步放化疗治疗驱动基因阴性NSCLC 的临床疗效和安全性。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:经组织学或细胞学确诊为NSCLC,病理类型为鳞状细胞癌,肿瘤-淋巴结-远处转移(TNM)分期为Ⅲb-Ⅳb 期;高通量测序无表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、肉瘤致癌因子-受体酪氨酸激酶(ROS1)等基因突变;美国东部肿瘤协作组(ECOG)体能状态评分为0 分或1 分;具有可测量的肿瘤病灶用于疗效评估。本研究方案获医院医学伦理委员会批准(批件号为伦审批第21Z12056 号),所有患者签署临床知情同意书。
排除标准:合并其他恶性肿瘤;严重肝、肾、心、肺等重要器官功能障碍;凝血功能异常或有出血倾向。
病例选择与分组:采用PASS 11.00 软件估算样本量,设定1-β=0.9,α=0.05,假设观察组的疾病控制率(DCR)为87.0%,对照组的DCR 为52.0%,计算所需样本量为70 例,脱落率15%,实际所需样本量为80 例。选取苏州大学附属张家港医院2021 年3 月至2022 年3 月收治的驱动基因阴性NSCLC 患者80 例,按随机数字表法分为观察组和对照组,各40 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
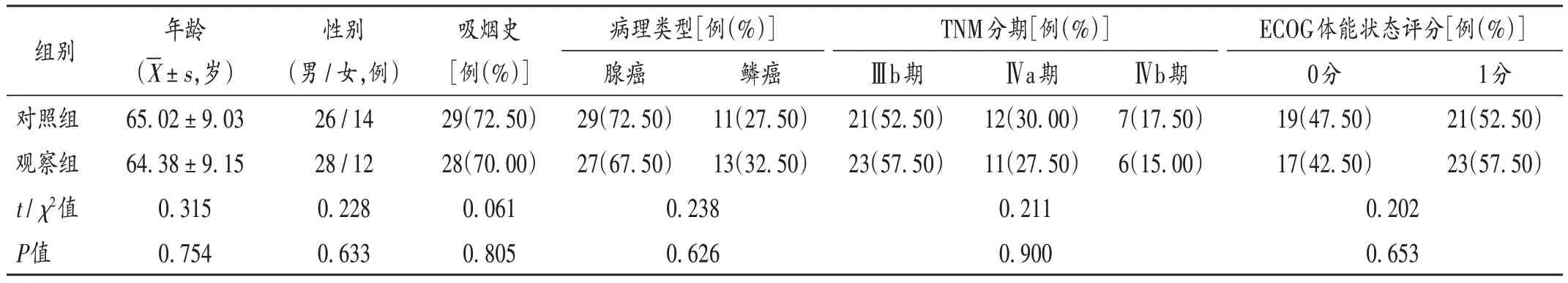
表1 两组患者一般资料比较(n=40)Tab.1 Comparison of the patients′ general data between the two groups(n=40)
1.2 方法
对照组患者给予同步放化疗,肺内原发灶和区域淋巴结行6MeV X线放射治疗(简称放疗),每次2.0 Gy,每周5 次,总剂量60~64 Gy。同时,采用NP 化疗方案,给予酒石酸长春瑞滨注射液(江苏豪森药业集团有限公司,国药准字H19990278,规格为每支1 mL∶10 mg<按C45H54N4O8计>)25 mg/m2,静脉注射,第1 天、第8 天;顺铂注射液(江苏豪森药业集团有限公司,国药准字H20040813,规格为每支6 mL∶30 mg)30 mg/ m2,静脉注射,第1 天至第4 天。以21 d 为1 个周期,共治疗4 个周期。
观察组患者在对照组治疗基础上加用安罗替尼联合信迪利单抗。给予盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180004,规格为每粒12 mg <按C23H22FN3O3计>)12 mg,清晨空腹口服,每日1 次,以21 d 为1 个周期,共治疗4 个周期。信迪利单抗注射液(苏州信达生物制药有限公司,国药准字S20180016,规格为每支100 mg∶10 mL)200 mg/m2,静脉滴注,第1 天。以21 天为1 个周期,共治疗4 个周期。
1.3 观察指标与疗效判定标准
观察指标:1)肿瘤标志物。分别采集患者治疗前、治疗4 个周期后的静脉血各3 mL,注入干燥试管,待血液凝固后取上层液离心(相对离心力3 028g)5 min,采用酶联免疫吸附试验检测血清癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角质蛋白19 片段抗原21-1(CYFRA21-1),检测仪器为FC Multiskan 型酶标仪(美国Thermo 公司)。2)生活质量。采用欧洲癌症研究与治疗组织(EORTC)生活质量测评量表[生活质量调查核心问卷(QLQ-C30)和肺癌专用问卷(QLQ-LC13)][4]评价患者治疗前、治疗4 个周期后的生活质量。其中,QLQ-C30 包括躯体功能、角色功能、认知功能、情感功能、社会功能,含有3 个症状量表(疲乏、疼痛、恶心呕吐)和6个单项(气促、失眠、食欲丧失、便秘、腹泻、经济困难);QLQ-LC13包括气促、咳嗽、咳血、口腔疼痛、吞咽困难、手足刺痛、脱发、胸疝、手或肩部疼痛、其他部位疼痛共10 个条目。评分越高,表明患者生活质量越高。3)不良反应。记录两组患者治疗期间骨髓抑制(白细胞减少、贫血、血小板减少)、胃肠道反应(恶心、呕吐)、感染、免疫相关反应(肺炎、皮肤毒性反应、免疫性肠炎、肝炎)等不良反应发生情况。根据《抗癌药物急性与亚急性毒性反应判定标准》[5]对不良反应进行分级,记录Ⅲ级及以上不良反应发生情况。4)随访。所有NSCLC 患者定期接受电话随访和门诊复查,截至2023年3 月。复查内容包括血常规、肝肾功能、肿瘤标志物、胸部CT 或MRI、全身骨显像等,记录PFS 和OS。其中,PFS 定义为确诊至肿瘤复发/进展或随访截止时间,OS定义为确诊至死亡或随访截止时间。
疗效判定:治疗4 个周期后,参考实体瘤疗效评价标准(RECIST)1.1版实体肿瘤疗效标准[6]评价疗效。完全缓解(CR),肿瘤病灶完全消失;部分缓解(PR),所有可测量目标病灶的直径总和缩小不低于30%;疾病稳定(SD),介于PR 和疾病进展(PD)之间;PD,所有测量靶病灶直径之和的最小值增加不低于20%或出现新病灶。DCR=CR+PR+SD,客观缓解率(ORR)=CR+PR。
1.4 统计学处理
2 结果
2.1 临床疗效
观察组ORR和DCR均显著高于对照组(P<0.05)。详见表2。

表2 两组患者临床疗效比较[例(%),n=40]Tab.2 Comparison of clinical efficacy between the two groups[case(%),n=40]
2.2 不良反应
对照组发生白细胞减少、血小板减少各2例,贫血、呕吐、感染各3例,恶心8例;观察组发生白细胞减少5例,血小板减少2 例,恶心9 例,呕吐、感染各3 例,贫血、免疫相关肺炎、免疫相关皮炎各1 例。两组Ⅲ级及以上不良反应发生率比较无显著差异(P>0.05)。详见表3。

表3 两组患者Ⅲ级及以上不良反应发生情况比较[例(%),n=40]Tab.3 Comparison of incidence of grade Ⅲand above adverse reactions between the two groups[case(%),n=40]
2.3 肿瘤标志物水平
治疗后,观察组患者的血清CEA,CA125,CYFRA21-1水平均显著低于对照组(P<0.05)。详见表4。
表4 两组患者治疗前后肿瘤标志物水平比较(,n=40)Tab.4 Comparison of tumor markers between the two groups before and after treatment(n=40)

表4 两组患者治疗前后肿瘤标志物水平比较(,n=40)Tab.4 Comparison of tumor markers between the two groups before and after treatment(n=40)
2.4 生活质量
治疗后,观察组患者的QLQ-C30 和QLQ-LC13评分均显著高于对照组(P<0.05)。详见表5。
表5 两组患者治疗前后生活质量比较(,分,n=40)Tab.5 Comparison of quality of life between the two groups before and after treatment(,point,n=40)
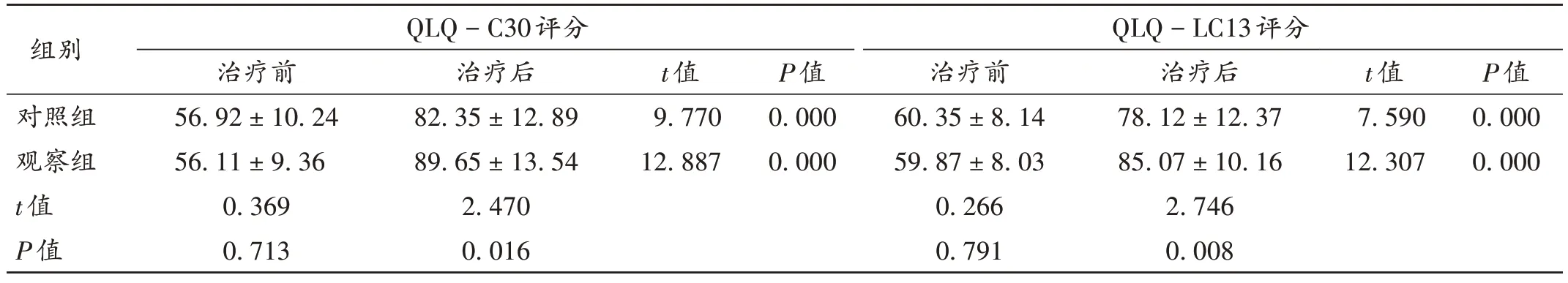
表5 两组患者治疗前后生活质量比较(,分,n=40)Tab.5 Comparison of quality of life between the two groups before and after treatment(,point,n=40)
2.5 生存率
中位随访15 个月(12~24 个月),共失访3 例,其中观察组失访1 例,对照组失访2 例。观察组中位PFS 为6.9个月,中位OS为12.6个月;对照组中位PFS为4.3个月,中位OS为8.9个月。观察组中位PFS和中位OS时间均显著长于对照组(Log-rankχ2=13.760,31.830,P<0.05)。详见图1。

A.无进展生存期 B.总生存期图1 两组患者无进展生存期和总生存期生存曲线A.PFS B.OSFig.1 Survival curves of PFS and OS in the two groups
3 讨论
1/3 的NSCLC 患者具有可靶向的驱动基因突变,目前的治疗方案以化疗为基础,联合抗血管生成的靶向药物或免疫治疗等[7-9]。安罗替尼为多靶点小分子抗血管生成靶向药物,可下调胞外信号调控激酶通路信号传导,抗肿瘤血管生成,较舒尼替尼、索拉非尼等药物具有更高的选择性和抗血管新生作用[10-11];还可通过抑制干细胞因子受体[12],抑制下游Janus 激酶/信号转导与转录激活子信号通路传导,抑制肿瘤细胞增殖、侵袭和迁移[11]。一项随机、双盲、Ⅲ期临床研究显示,安罗替尼可延长肺癌患者的PFS 和OS,且毒副作用可控[13]。安罗替尼一线治疗不耐受驱动基因阴性的晚期NSCLC的ORR为56%,DCR为70%,中位PFS为4.0个月,中位OS 为9.0 个月[14]。目前,安罗替尼联合化疗、免疫治疗的临床试验也在陆续开展中,为NSCLC 的治疗提供更多的可能性[15]。相比传统放化疗,靶向治疗更加精准化和个体化,延长了驱动基因阴性NSCLC 患者的生存时间。
PD-1 是T 淋巴细胞表面常见的免疫抑制因子,PD-L1 在恶性肿瘤细胞表面过表达,与PD-1 结合抑制T淋巴细胞增殖活化,使其失活,最终诱导免疫逃逸,导致治疗失败。PD-1抑制剂可通过阻断PD-1/PD-L1通路来增加免疫细胞活化,介导肿瘤细胞清除[16]。目前,PD-1 抑制剂单药或联合放化疗治疗晚期NSCLC均显示出显著的临床疗效,显著延长了NSCLC 患者的OS 和PFS,为NSCLC 患者的综合治疗提供了更多选择[17-18]。信迪利单抗是一种全人源化免疫球蛋白G4(IgG4)单克隆抗体,可特异性地结合人PD-1,并有效抑制PD-1 与PD-L1 和程序性死亡配体2(PD-L2)的结合,增加白细胞介素2和γ干扰素水平,促使T淋巴细胞增殖、活化,提高机体抗肿瘤免疫功能[19]。一项关于局部晚期或转移性非鳞状NSCLC 的随机、双盲、Ⅲ期临床研究中,观察组给予信迪利单抗联合培美曲塞和铂类药物化疗,对照组给予安慰剂联合培美曲塞和铂类药物化疗[20]。结果显示,观察组患者中位PFS 为8.9 个月,显著长于对照组的5.0 个月;ORR 为51.9%,显著高于对照组的29.8%;Ⅲ级及以上不良反应发生率为61.7%,与对照组的58.8%相当。CHU等[21]报道显示,信迪利单抗联合安罗替尼一线治疗无法手术切除的ⅢB/C或Ⅳ期NSCLC患者直至疾病进展或发生不可接受的毒性,ORR 为72.7%,DCR 为100.0%,中位PFS为15 个月,Ⅲ级及以上治疗相关不良事件发生率为54.5%。
安罗替尼联合信迪利单抗同步放化疗治疗驱动基因阴性NSCLC 的报道少见。本研究结果显示,观察组治疗后的ORR 和DCR 均显著高于对照组,中位PFS 和OS均显著长于对照组,血清CEA,CA125,CYFRA21-1 水平均显著低于对照组,QLQ-C30 和QLQ-LC13 评分均显著高于对照组,表明安罗替尼联合信迪利单抗同步放化疗可提高驱动基因阴性NSCLC 的临床疗效,降低患者血清肿瘤标志物水平,改善生活质量,延长PFS和OS。研究显示,肿瘤免疫微环境与血管间的相互作用会促使肿瘤进展,肿瘤细胞抑制免疫细胞并募集肿瘤相关巨噬细胞、调节性T淋巴细胞、髓源性抑制细胞等免疫抑制性细胞至肿瘤组织中,分泌免疫抑制性因子,促进肿瘤血管生成;同时,脉管系统是免疫细胞浸润至肿瘤组织的重要途径,新生血管有助于免疫细胞迁移和进入肿瘤及其微环境,与肿瘤免疫逃逸有关[22]。因此,联合抗血管生成靶向治疗和PD-1 抑制剂可有效阻止免疫抑制性细胞通过新生血管网膜进入肿瘤及其微环境,并可激活抗肿瘤免疫系统,恢复抗肿瘤T 淋巴细胞功能,杀伤肿瘤细胞[23]。信迪利单抗通过解除免疫应答抑制,增加抗肿瘤免疫效能,抑制肿瘤细胞生长,增强放化疗对肿瘤细胞的杀伤作用;安罗替尼通过多靶点阻滞血管内皮生长因子受体活性,强效抑制肿瘤血管新生,减少瘤体内血液供应,促使肿瘤细胞凋亡。两组不良反应发生率相当,表明安罗替尼联合信迪利单抗同步放化疗的安全性可控。
综上所述,安罗替尼联合信迪利单抗同步放化疗可提高驱动基因阴性NSCLC 患者的临床疗效,改善生活质量,降低血清肿瘤标志物水平,延长生存时间,且安全性良好。本研究的不足之处在于样本量偏少,且为单中心研究,可能存在统计学偏倚,尚需进一步开展大样本、多中心、随机对照研究加以证实。
