信迪利单抗一线治疗晚期胃癌或胃食管结合部腺癌的疗效分析
2023-07-09叶斯斯张鹏飞
李 娟,叶斯斯,张鹏飞,白 莉
目前,胃癌仍是威胁人类生命健康的主要恶性肿瘤之一[1],我国近80%的胃癌患者确诊时已为局部进展期或晚期,预后较差[2]。近年来免疫检查点抑制剂在晚期胃癌的治疗方面取得了突破性进展,使HER-2阴性晚期胃癌的中位生存时间突破1年[4]。基于CheckMate-649、ORIENT-16、Attraction-04的前瞻性临床研究结果[3-5],免疫检查点抑制剂已被批准用于晚期胃癌的一线标准治疗,其与化疗联合已被证实有协同作用。在晚期胃癌一线治疗中CheckMate-649、ORIENT-16、Attraction-04、Keynote-062、Keynote-590等多个前瞻性临床研究均是免疫检查点抑制剂联合以铂类为基础的化疗方案[3-7],但奥沙利铂因其神经毒性,治疗中常需要减量或停用,限制了其疗效。紫杉醇因其抗肿瘤活性,目前用于治疗各种肿瘤,如肺癌、乳腺癌、卵巢癌等[8-11]。紫杉醇(白蛋白结合型)为应用纳米技术使用人血白蛋白作为载体,将紫杉醇与白蛋白结合为130 nm的复合物。白蛋白紫杉醇因其便利性、经济性广受临床青睐。目前仅RAP试验进行了晚期胃癌二线治疗,应用PD-L1抗体与紫衫类药物及抗血管靶向药物联合治疗[12],在晚期胃癌中应用免疫检查点抑制剂联合紫杉类为基础的化疗方案的前瞻性临床研究鲜有报道。本研究旨在观察在真实世界中信迪利单抗一线治疗晚期胃癌及胃食管结合部腺癌的疗效。
1 资料与方法
1.1 一般资料 回顾性分析在我院诊治的71例一线应用信迪利单抗联合化疗的晚期胃癌或胃食管结合部腺癌患者临床资料。纳入标准:(1)年龄≥18岁;(2)经病理学确诊的晚期胃食管结合部腺癌或胃腺癌;(3)体力状况(Eastern cooperative Oncology Group,ECOG)评分0~2分;(4)有影像学可评价的病灶;(5)一线治疗至少接受两周期信迪利单抗联合化疗方案治疗,且进行一次疗效评价;(6)所有治疗方案均获得患者及家属知情同意并签字。排除合并重要器官功能障碍者。
1.2 治疗方法 各药物剂量:信迪利单抗200 mg/次,1次/3周;阿帕替尼 250 mg/次,1次/d;曲妥珠单抗为每3周静脉滴注1次,初始负荷剂量为8 mg/kg,之后每3周给予6 mg/kg的维持剂量;紫杉醇(白蛋白结合型) 125 mg/m2,静滴,第1~8天,21 d/周期;奥沙利铂130 mg/m2,静滴,第1天,21 d/周期;替吉奥40 mg/(m2·d),2次/d 口服,第1~14天,21 d/周期;卡培他滨800~1000 mg/m2,2次/d 口服,第1~14天,21 d/周期。
一线联合治疗方案:(1)以奥沙利铂为基础的治疗方案包括信迪利单抗+奥沙利铂+卡培他滨(XELOX)/奥沙利铂+替吉奥(SOX)±曲妥珠单抗;(2)以紫杉醇(白蛋白结合型)为基础的治疗方案包括信迪利单抗+紫杉醇(白蛋白结合型)+替吉奥(AS)±曲妥珠单抗;(3)维持治疗方案:信迪利单抗±卡培他滨/替吉奥±阿帕替尼;信迪利单抗+卡培他滨/替吉奥±曲妥珠单抗。信迪利单抗联合治疗6~8周期后调整为维持治疗。
1.3 观察指标 疗效评价包括:完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和病情进展(progression disease,PD)。客观缓解率(objective response rate,ORR)=(CR+PR)病例数/总病例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)病例数/总病例数×100%。无进展生存期(progression-free survival,PFS):从用药开始到第一次评价肿瘤进展或死亡时间。随访截止至2023年3月1日,如随访截止时仍未进展,以最后一次随访时间为截止日期。
1.4 统计学处理 采用SPSS 22.0软件,计数资料比较采用χ2检验,生存的单因素及多因素分析采用Kaplan-Meier检验和Cox回归进行,生存状况采用Log-rank检验比较,生存时间以中位数表示,P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 71例中,信迪利联合奥沙利铂为基础治疗方案的患者45例,信迪利联合紫杉醇(白蛋白结合型)为基础治疗方案的患者26例,中位年龄60岁(30~79岁),其中男53例,女18例,95.8%为胃腺癌,54.9%伴有2个及以上部位转移,31.0%伴肝转移,73.2%伴淋巴结转移,28.2%伴腹膜转移;细胞程序性死亡配体1(programmed cell death-ligand 1,PD-L1)的联合阳性分数(combined positive score,CPS)评分<1的8例(11.3%),≥1的25例(35.2%),不详38例(53.5%)。21.1%患者一线治疗同时联合应用曲妥珠单抗。64.8%患者出现病情进展,43.7%患者一线治疗6~8周期后调整为维持治疗(表1)。

表1 一线应用信迪利治疗晚期患者一般资料 (n;%)
2.2 疗效 随访截止时间2023年3月1日,中位随访时间9.5个月(1.8~42.7个月),一线信迪利联合治疗组总人群CR 5例, pCR 3例,ORR为67.6%,DCR为97.2%。其中联合以奥沙利铂为基础治疗组CR 5例,pCR 3例;联合以紫杉类为基础治疗组无CR病例。联合铂类治疗组及联合紫杉醇(白蛋白结合型)治疗组ORR及DCR差异无统计学意义(P=0.173,表2)。

表2 一线应用信迪利治疗晚期患者疗效分析 (n;%)
一线信迪利联合治疗组mPFS为11.2个月(95% CI 9.7~12.7),其中信迪利+奥沙利铂为基础方案治疗组mPFS 11.3个月(95% CI 5.5~17.2),信迪利+紫杉醇(白蛋白结合型)为基础方案治疗组mPFS 10.9个月(95% CI 9.0~12.9),两组mPFS差异无统计学意义(P=0.212)。
2.3 mPFS单因素分析 对于ECOG评分≥2,体能状态较好的年龄≥65岁的患者,应用免疫检查点抑制剂联合化疗mPFS优于年龄<65岁的患者,差异有统计学意义(P=0.004)。Lauren分型肠型、转移器官个数为1个、行维持治疗的患者mPFS存在延长趋势,但差异无统计学意义。有肝转移、腹膜转移为不良预后因素,但差异无统计学意义(表3)。
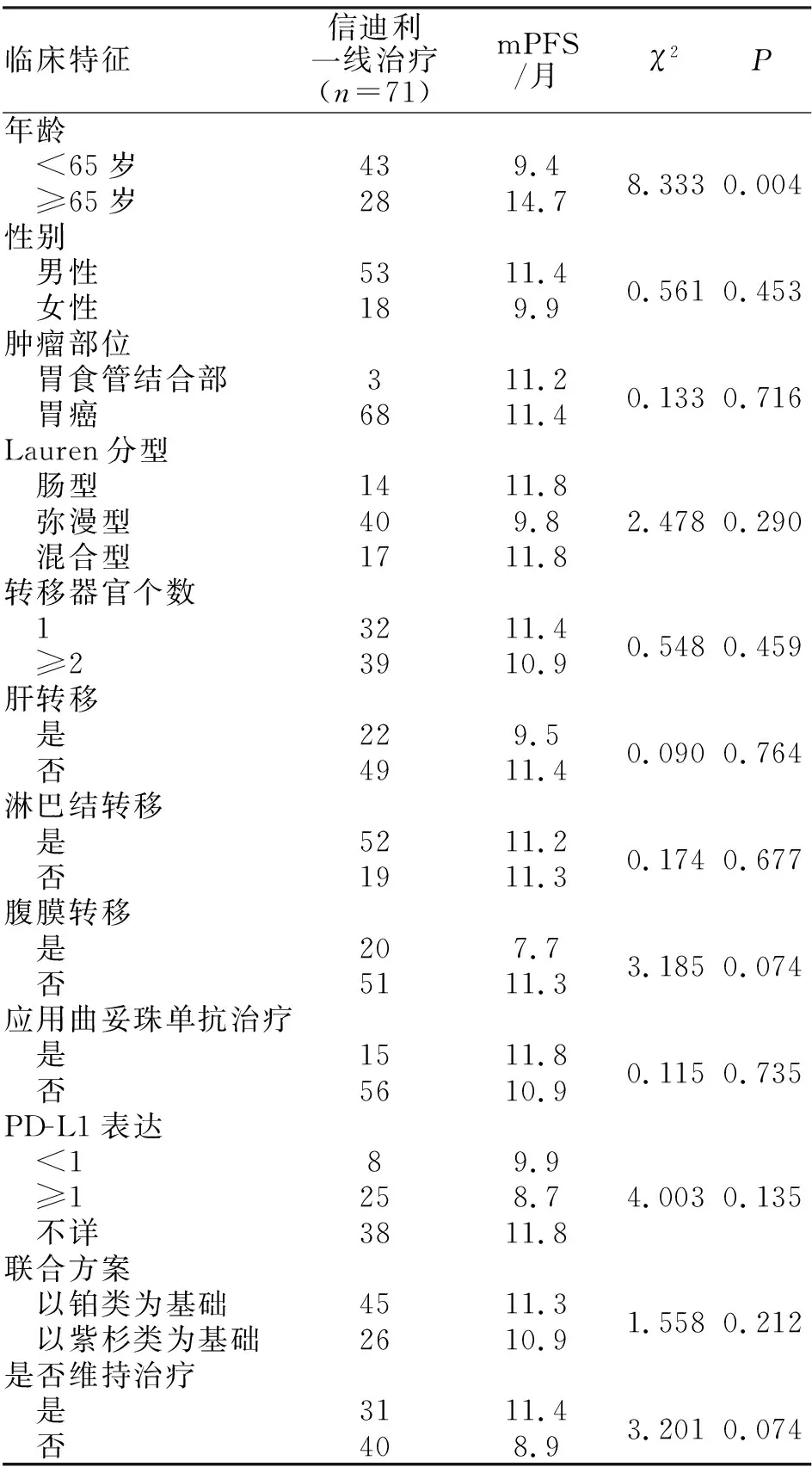
表3 影响一线应用信迪利治疗晚期患者mPFS的单因素分析 (n;%)
2.4 mPFS多因素分析 将年龄、Lauren分型、腹膜转移、PD-L1表达、联合方案、是否维持治疗等因素纳入多因素分析,结果显示年龄,是否维持治疗是影响mPFS的独立预后因素,差异有统计学意义(P<0.05,表4)。

表4 影响一线应用信迪利治疗晚期患者mPFS的多因素分析
3 讨 论
对于无法行根治性手术的局部晚期或远处转移的晚期胃癌,药物治疗主要包括化疗、分子靶向。CheckMate-649、ORIENT-16、Attraction-04等临床研究结果表明[3-5],免疫检查点抑制剂联合化疗可明显提高治疗的有效率并延长总生存期。目前免疫检查点抑制剂PD-1单抗联合化疗已成为晚期转移性胃癌的一线标准治疗。ORIENT-16研究,为我国首个证实免疫联合化疗一线治疗晚期胃癌全人群显著获益的随机双盲期Ⅲ研究[4],显示全人群OS显著获益,首次将全人群OS获益提升至15.2个月。因此信迪利单抗联合化疗在2022年中国临床肿瘤学会(CSCO)指南推荐为HER-2阴性晚期胃癌一线标准治疗。
本回顾性研究中,全人群ORR为67.6%,与ORIENT-16在所有患者中ORR 65.1%及CheckMate-649中国亚组纳武利尤单抗(nivolumab)联合化疗的ORR 68%相当[4,13]。略低于KEYNOTE-811帕博利珠单抗组的ORR 74%[14]。在CheckMate-649中PD-L1 CPS≥1的患者超过81%,CPS≥5约60%;ORIENT-16研究中61.1%的患者PD-L1 CPS≥5,而在Attraction-04中PD-L1 CPS≥1的患者仅16%[4-6]。因肿瘤活检组织有限,且PD-L1尚未被列为胃癌诊断时的常规免疫组化指标,本回顾性研究中PD-L1的检测率仅46.5%,其中仅35.2%的患者PD-L1 CPS≥1,明显低于CheckMate-649 及ORIENT-16[3,4]。因本研究的PD-L1的检测率相对较低,未观察到mPFS与肿瘤细胞PD-L1表达的相关性,这与ATTRACTION-2及ATTRACTION-4研究相似[15,16],上述研究提示在亚洲人群中PD-L1阴性的患者可能从免疫检查点抑制剂联合化疗方案中受益。在NCT02915432研究同样观察到PD-L1的过表达与生存获益无关[17]。ORIENT-16研究中,16%的患者PD-L1表达阴性[4],目前该亚组结果尚未公布。本研究中,71例信迪利单抗联合治疗的患者mPFS明显优于ORIENT-16及CheckMate-649研究中的全人群mPFS 7.7及8.3个月[3,4]。可能与本研究中一线联合曲妥珠单抗比例高(21.1%)有关。其次,24例手术患者中12例是经过免疫联合治疗后获得转化手术治疗机会,因此mPFS得到明显延长。多个Ⅱ研究显示信迪利单抗联合化疗可提高局部晚期胃癌新辅助治疗后手术患者的pCR率[18,19]。
本研究中信迪利+奥沙利铂为基础治疗组mPFS及ORR均优于以紫杉醇(白蛋白结合型)为基础组,但两组差异无统计学意义。信迪利+紫杉醇(白蛋白结合型)为基础组的mPFS明显高于文献[20]中的AS方案mPFS(9.6个月及9.2个月),该治疗组同样优于卡瑞利珠单抗联合化疗序贯卡瑞利珠单抗联合阿帕替尼一线治疗晚期胃或胃食管交界处腺癌的研究结果。
综上所述,在真实世界中,在PD-L1表达不明确的患者中应用信迪利单抗联合化疗的疗效与ORIENT-16[4]、CheckMate-649[3]研究相当。信迪利单抗联合以紫杉醇(白蛋白结合型)为基础的治疗组疗效与联合以奥沙利铂为基础治疗组相当。因本研究中免疫治疗联合紫杉醇(白蛋白结合型)治疗组病例数较少,可能无法全面反映该治疗方案的疗效。紫杉醇(白蛋白结合型)因其方便、经济、低毒在临床中广泛应用于胃癌一线治疗,今后需开展前瞻性研究进一步明确免疫检查点抑制剂联合紫杉醇类药物的疗效。
