沙库巴曲缬沙坦对慢性心力衰竭模型小鼠心功能的影响及其作用机制*
2024-02-25陈静静吉秋霞
陈静静,吉秋霞
(南通大学附属海安医院,江苏 南通 226600)
慢性心力衰竭(CHF)是心肌病、炎症等多种原因造成的心肌损伤与心功能下降,临床表现为呼吸困难、体液潴留等,属终末期心脏疾病,严重影响患者的健康[1-3]。沙库巴曲缬沙坦为复合药物,其中缬沙坦为血管紧张素受体拮抗剂,沙库巴曲为脑啡呔酶抑制剂,可扩张血管,利尿,逆转心室重构,降低心血管死亡风险[4-5]。沉默信息调节因子2 相关酶类1(Sirt1)属酰基转移酶家族,通过去乙酰化作用影响多种基因的表达,从而调节细胞功能,与细胞的存活、抗氧化应激、抗炎反应等密切相关。Sirt1 通常被认为是一种烟酰胺腺嘌呤二核苷酸前体(NAD+)依赖性去乙酰化酶,其活性受NAD+/烟酰胺腺嘌呤二核苷酸还原态(NADH)比例的调控,其调节作用涉及组蛋白、转录因子、代谢相关蛋白等多种底物。腺苷酸活化蛋白激酶(AMPK)是一种细胞能量感应激酶,当细胞感知到能量不足时,AMPK 被磷酸化激活,进而调节多种代谢途径,以促进细胞内的腺嘌呤核苷三磷酸(ATP)生成,并减少ATP 消耗,以维持能量平衡。Sirt1 通过与AMPK 相互作用,可互相影响其活性[6-7]。过氧化物酶体增殖体激活受体γ 辅助激活因子-1α(PGC-1α)是AMPK 的关键下游因子,通过调控线粒体生物合成和氧化磷酸化等途径,促进心肌细胞的能量代谢,从而维持心脏的正常功能,同时可增强抗氧化防御系统,在心肌细胞中提供更强的抗氧化保护作用,有助于应对氧化应激和减少氧化损伤[8]。既往研究显示,激活Sirt1/AMPK/PGC-1α 信号通路可改善慢性心力衰竭模型大鼠的心功能[9]。目前,临床研究主要集中于沙库巴曲沙坦对体液调节的机制上,心肌炎症、细胞凋亡也是CHF 的重要表现。故本研究中探讨了沙库巴曲缬沙坦对CHF 模型小鼠心功能的影响及其作用机制,为其防治心力衰竭提供新的理论依据和治疗靶点。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:vevo 3100 型超声成像系统(云南莱博科技有限公司);V5800型荧光显微镜(天津微仪光学仪器有限公司);CFX Opus 96 型实时荧光定量聚合酶链式反应(PCR)仪(上海旦鼎国际贸易有限公司);iBright ™FL1500型蛋白凝胶成像系统(美国Thermo Fisher Scientific公司)。
试药:沙库巴曲缬沙坦钠片(商品名诺欣妥,Nobartis公司,批号为J20171054,规格为每片100 mg);肌酸激酶MB 型同工酶(CK-MB)酶联免疫吸附试验(ELISA)试剂盒(批号为ml037724),心肌肌钙蛋白Ⅰ(cTnⅠ)ELISA试剂盒(批号为ml001932),白细胞介素6(IL-6)ELISA 试剂盒(批号为ml06159),肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(批号为ml002095),均购自上海酶联生物科技有限公司;超氧化物歧化酶(SOD)试剂盒(批号为S0101S),丙二醛(MDA)试剂盒(批号为S0131S),谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号为S0056),均购自上海碧云天生物技术有限公司;Sirt1抑制剂EX-527(批号为HY-15452),AMPK 抑制剂Compound C(批号为HY-13418A),均购自美国Med-ChemExpress 公司;兔抗鼠胱天蛋白酶3(caspase-3,批号为ab13847),Sirt1(批号为ab110304),磷酸化AMPK(p-AMPK,批号为ab131357),AMPK(批号为ab32047),磷酸化PGC-1α(p-PGC-1α,批号为ab180235),PGC-1α(批号为ab191838),甘油醛-3-磷酸脱氢酶(GAPDH,批号为ab8245),山羊抗兔二抗(批号为ab6721),均购自美国Abcam公司。
动物:SPF级C57/BL6雌性小鼠62只,8周龄,购自广东莱迪生物医药研究院有限公司,动物许可证号为SCXK(粤)2022-0064。小鼠饲养于指定的无病原体隔离设施中,环境温度为22~24 ℃,相对湿度为40%~60%,12 h/12 h明暗交替,正常进食、饮水。本研究方案经我院动物伦理委员会批准(批件号为JSN2020-01201号)。
1.2 方法
造模、分组与给药:将62 只小鼠随机分为对照组(13 只)和模型组(49 只)。通过主动脉缩窄术构建CHF模型,小鼠经30 mg/kg戊巴比妥钠麻醉,打开左前胸暴露心脏,游离腹主动脉,结扎主动脉,抽离手术针,确认腹主动脉畅通,复位心脏,缝合胸腔[10]。术后3 d,小鼠腹腔注射青霉素预防感染,以主动脉弓缩窄处血液流速大于2 400 mm/s为造模成功。对照组小鼠仅开胸,不进行缩窄操作。造模过程中,小鼠死亡12 只,其中对照组3 只,模型组9 只。将造模成功的40 只小鼠随机分为模型组(B 组)、沙库巴曲缬沙坦组(C 组)、沙库巴曲缬沙坦+EX-527 组(D 组)、沙库巴曲缬沙坦+Compound C组(E组),各10只;将10只对照组小鼠设为A组。C 组、D 组、E 组小鼠均灌胃68 mg/kg 沙库巴曲缬沙坦[11],连续4 周;D 组、E 组小鼠除灌胃沙库巴曲缬沙坦外,另外分别腹腔注射1 次5 mg/kg Sirt 抑制剂EX-527[12]、20 mg/kg AMPK 抑制剂Compound C[13],C组小鼠腹腔注射等量生理盐水。A 组和B 组小鼠均分别灌胃、腹腔注射等量生理盐水。
心脏超声检测:末次给药后,采用超声成像系统对小鼠进行超声心动图检测,包括左室射血分数(LVEF)、左室收缩末期内径(LVESd)、左室舒张末期内径(LVEDd),连续记录3个心动周期,取平均值。
血浆心肌酶、炎性因子、氧化应激水平测定:超声心动图测定结束后,麻醉小鼠,取心脏血,抗凝,离心,取血浆,冻存。按试剂盒说明书测定CK-MB,cTnⅠ,IL-6,TNF-α,SOD,MDA,GSH-Px水平。
心肌组织病理形态观察:各组随机处死5 只小鼠,取心脏,用生理盐水冲洗干净心脏残血,将心脏左室前壁组织固定于4%多聚甲醛中,用乙醇梯度脱水,二甲苯透明,石蜡包埋,2µm 切片,进行苏木精-伊红(HE)染色,封片,观察小鼠心肌组织病理形态。
心肌凋亡情况测定:将小鼠心肌组织包埋于石蜡,4µm切片,脱蜡至水,用蛋白酶K(不含DNA 酶)工作液处理15 min,用磷酸盐缓冲液(PBS)漂洗,加TUNEL 反应液,在PBS配制的3%过氧化氢溶液(温度为37 ℃)中孵育20 min,用PBS 漂洗,加50 µL TUNEL 检测液(红色),37 ℃遮光孵育60 min,用PBS 漂洗,用抗荧光淬灭封片液封片,并于荧光显微镜下观察,计数凋亡细胞。
心肌组织基因测定:分离各组另5只小鼠的心肌组织,一部分冻存,一部分采用TRIzol 法提取心肌组织总RNA,用无核糖核酸酶的水溶解,采用分光光度计检测RNA 的浓度。用逆转录酶将mRNA 逆转录为cDNA,-20 ℃冻存,用SYBR Green Master Mix 进行cDNA 扩增,使用不同的引物特异性扩增相应的DNA 片段,以2-ΔΔCt表示mRNA的相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
小鼠心肌组织蛋白测定:取冻存的小鼠心肌组织,匀浆,离心,提取总蛋白并检测蛋白浓度,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);电泳结束后,转膜,封闭,分别加入兔抗鼠caspase-3,Sirt1,p-AMPK,AMPK,p-PGC-1α,PGC-1α,GAPDH 一抗(稀释比GAPDH 为1∶5 000,其余均为1∶1 000),4 ℃孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的山羊抗兔二抗稀释液(稀释比为1∶5 000),室温孵育1 h,TBST 洗膜。采用实时荧光定量聚合酶链式反应(qRTPCR)法和免疫印迹(Western blot)法测定小鼠caspase-3,Sirt1,AMPK,PGC-1α mRNA 和蛋白表达水平,蛋白凝胶成像系统成像,采用Image Pro Plus 6.0图像软件分析蛋白条带灰度值。
1.3 统计学处理
2 结果
2.1 超声心动图指标
与A组比较,B组小鼠的LVEF水平显著降低(P<0.05),LVEDd 和LVESd 水平均显著升高(P<0.05);与B 组比较,C 组小鼠的LVEF 水平显著升高(P<0.05),LVEDd和LVESd水平均显著降低(P<0.05);与C组比较,D组、E 组小鼠的LVEF 水平均显著降低(P<0.05),LVEDd和LVESd水平均显著升高(P<0.05)。详见表2。
表2 各组小鼠超声心动图指标比较(,n=10)Tab.2 Comparison of echocardiographic indicators of mice in each group(,n=10)
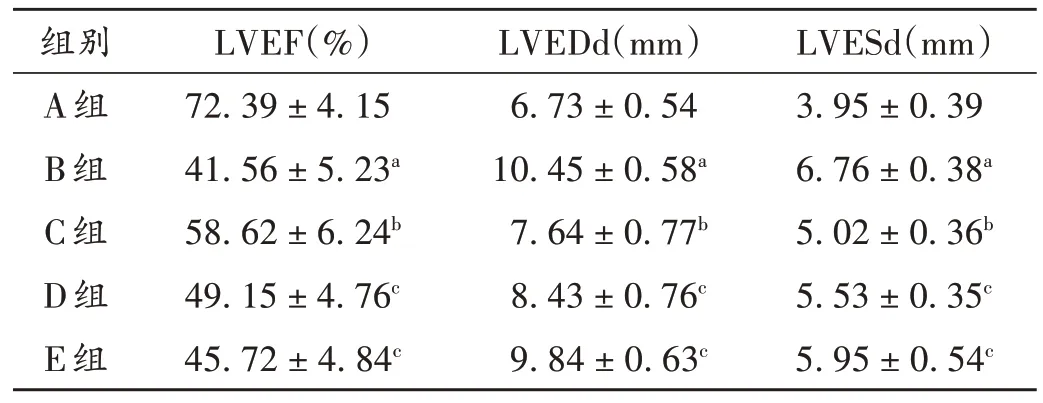
表2 各组小鼠超声心动图指标比较(,n=10)Tab.2 Comparison of echocardiographic indicators of mice in each group(,n=10)
注:与A 组比较,aP <0.05;与B 组比较,bP <0.05;与C 组比较,cP <0.05。表3至表6、图3同。Note:Compared with those in group A,aP <0.05;Compared with those in group B,bP <0.05;Compared with those in group C,cP <0.05(for Tab.2-6,and Fig.3).
2.2 心肌酶水平
与A 组比较,B 组小鼠血浆CK-MB 和cTnⅠ水平均显著升高(P<0.05);与B组比较,C组小鼠血浆CK-MB和cTnⅠ水平均显著降低(P<0.05);与C组比较,D组、E组小鼠血浆CK-MB和cTnⅠ水平均显著升高(P<0.05)。详见表3。
表3 各组小鼠血浆心肌酶水平比较(,n=10)Tab.3 Comparison of plasma myocardial enzyme levels of mice in each group(,n=10)

表3 各组小鼠血浆心肌酶水平比较(,n=10)Tab.3 Comparison of plasma myocardial enzyme levels of mice in each group(,n=10)
2.3 炎性因子水平
与A 组比较,B 组小鼠血浆IL-6 和TNF-α 水平均显著升高(P<0.05);与B组比较,C组小鼠血浆IL-6和TNF-α 水平均显著降低(P<0.05);与C 组比较,D 组、E 组小鼠血浆IL-6 和TNF-α 水平均显著升高(P<0.05)。详见表4。
表4 各组小鼠炎性因子水平比较(,pg/mL,n=10)Tab.4 Comparison of inflammatory factor levels of mice in each group(,pg/mL,n=10)

表4 各组小鼠炎性因子水平比较(,pg/mL,n=10)Tab.4 Comparison of inflammatory factor levels of mice in each group(,pg/mL,n=10)
2.4 氧化应激水平
与A组比较,B组小鼠MDA水平显著升高(P<0.05),SOD 和GSH-Px 水平均显著降低(P<0.05);与B 组比较,C 组小鼠MDA 水平显著降低(P<0.05),SOD 和GSH-Px水平均显著升高(P<0.05);与C组比较,D组、E组小鼠MDA水平均显著升高(P<0.05),SOD和GSH-Px水平均显著降低(P<0.05)。详见表5。
表5 各组小鼠氧化应激水平比较(,n=10)Tab.5 Comparison of oxidative stress levels of mice in each group(,n=10)
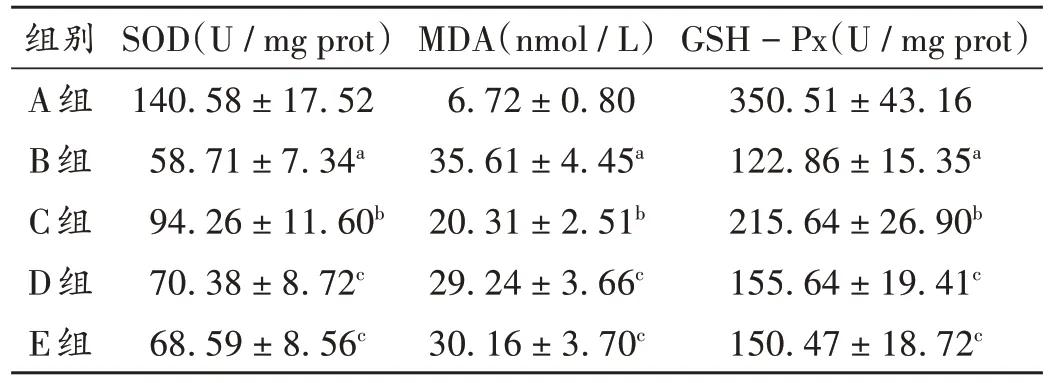
表5 各组小鼠氧化应激水平比较(,n=10)Tab.5 Comparison of oxidative stress levels of mice in each group(,n=10)
2.5 心肌组织病理
A 组小鼠心肌结构完整,排列整齐,未见炎性细胞浸润;B组小鼠心肌存在局灶性坏死,肌纤维间隔变大,炎性细胞浸润明显;C 组小鼠心肌细胞变性、炎性细胞浸润程度较B 组减轻;D 组、E 组小鼠心肌损伤程度较C组加重。详见图1。
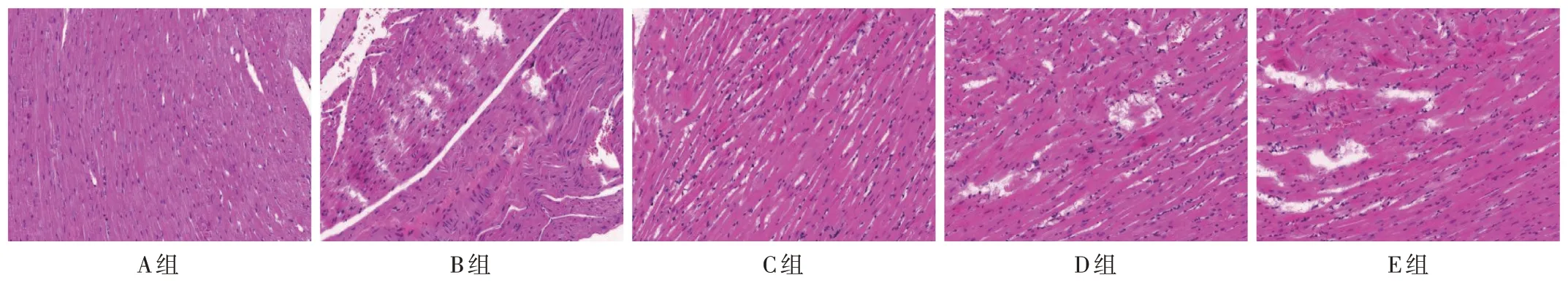
图1 各组小鼠心肌组织病理苏木精-伊红染色图(×200,n=5)Fig.1 HE images of myocardial pathology of mice in each group(×200,n=5)
2.6 心肌细胞凋亡情况
与A组比较,B组小鼠细胞凋亡率显著升高(P<0.05);与B组比较,C组小鼠细胞凋亡率显著降低(P<0.05);与C组比较,D组、E组小鼠心肌细胞凋亡率均显著升高(P<0.05)。详见表6和图2。
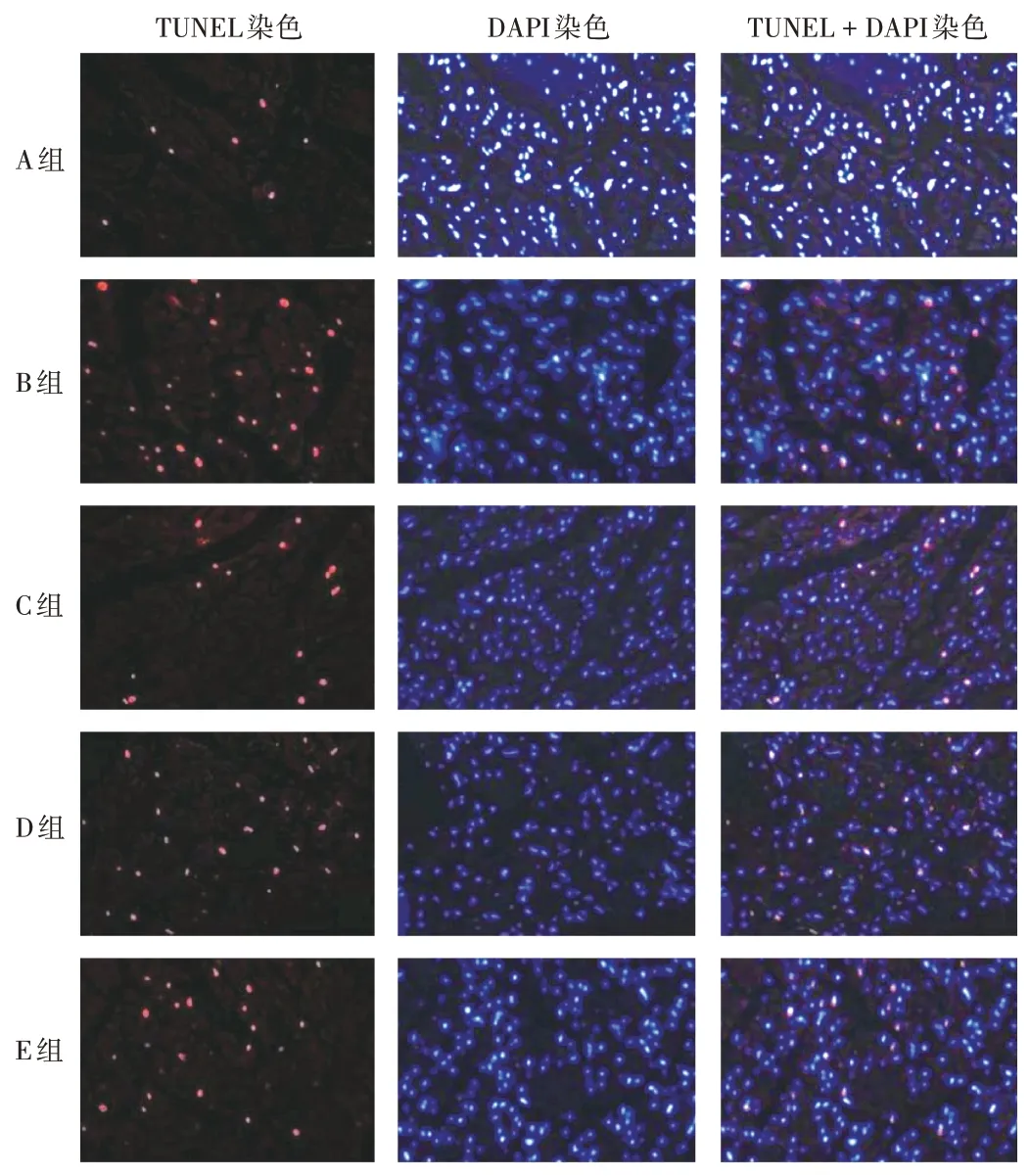
图2 各组小鼠心肌细胞凋亡情况(×200,n=5)Fig.2 Apoptosis of cardiomyocyte of mice in each group(×200,n=5)
表6 各组小鼠细胞凋亡率比较(,%,n=5)Tab.6 Comparison of apoptosis rate of mice in each group(,%,n=5)
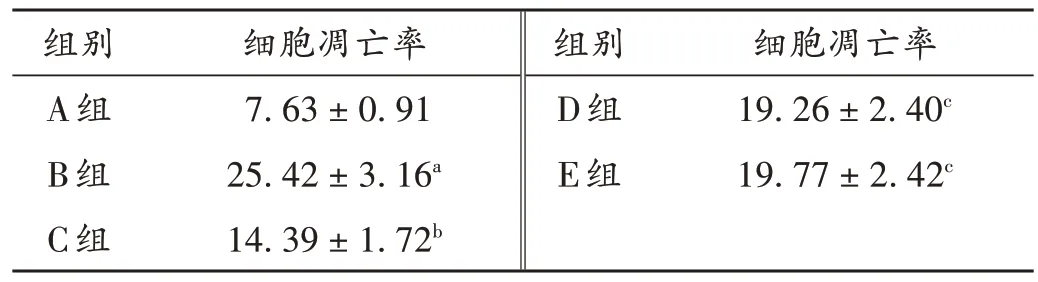
表6 各组小鼠细胞凋亡率比较(,%,n=5)Tab.6 Comparison of apoptosis rate of mice in each group(,%,n=5)
2.7 心肌组织caspase-3,Sirt1,AMPK,PGC-1α mRNA 和蛋白表达水平
与A 组比较,B 组小鼠心肌组织caspase-3 mRNA和蛋白表达水平均显著升高(P<0.05),Sirt1,AMPK,PGC-1α mRNA和蛋白表达水平均显著降低(P<0.05);与B 组比较,C 组小鼠心肌组织caspase-3 mRNA 和蛋白表达水平均显著降低(P<0.05),Sirt1,AMPK,PGC-1α mRNA和蛋白水平均显著升高(P<0.05);与C组比较,D 组、E 组小鼠心肌组织caspase-3 mRNA 和蛋白表达水平均显著升高(P<0.05),Sirt1,AMPK,PGC-1α mRNA 和蛋白表达水平均显著降低(P<0.05)。详见图3。
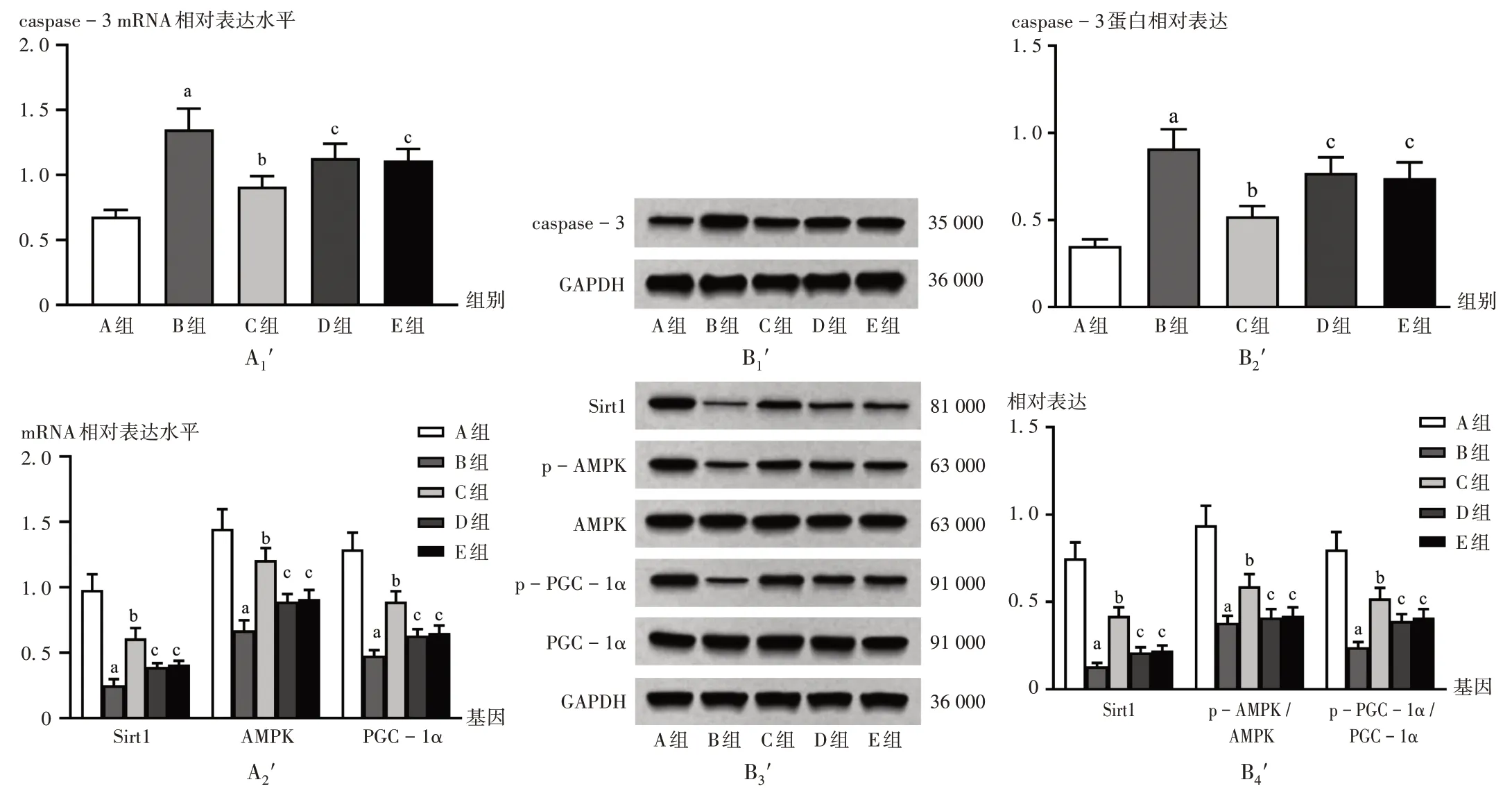
A1'-A2'.mRNA表达 B1'-B4'.蛋白表达图3 各组小鼠心肌组织caspase-3,Sirt1,AMPK,PGC-1α mRNA和蛋白表达水平比较(n=5)A1'-A2'.mRNA expression B1'-B4'.Protein expressionFig.3 Comparison of expression levels of caspase-3,Sirt1,AMPK,and PGC-1α mRNA and protein in myocardial tissue of mice in each group(n=5)
3 讨论
CHF 患者心肌结构与功能均发生改变,心脏泵血不足,无法为全身提供能量。沙库巴曲缬沙坦可作用于脑啡肽酶、肾素-血管紧张素系统,发挥利尿、扩张血管、逆转心室重构作用。心室重构是CHF 发生、发展的重要机制,故沙库巴曲缬沙坦可用于治疗CHF,降低患者心血管死亡的风险。目前,沙库巴曲缬沙坦对CHF 的治疗机制仍不完善,故本研究中对此展开探讨。本研究中成功构建CHF 小鼠模型,表现为主动脉弓缩窄处血液流速大于2 400 mm/s。小鼠心肌组织病理HE 染色图显示,小鼠心肌组织存在大量坏死与炎性细胞浸润,心肌纤维排列紊乱,细胞凋亡率升高,与既往研究[14]结果一致。经沙库巴曲缬沙坦治疗后,小鼠心肌损伤程度减轻,心肌细胞凋亡率降低,提示沙库巴曲缬沙坦可抑制CHF 模型小鼠心肌细胞的凋亡,保护小鼠的心肌组织,但具体机制仍有待进一步探究。
炎性反应在CHF 的发展中发挥重要作用。HANNA等[15]的研究结果显示,促炎因子TNF-α 和IL-6 广泛参与心力衰竭的发病机制,可调节心肌细胞表型与功能,抑制心肌细胞收缩,诱导巨噬细胞的炎症激活。PENA等[16]的研究结果显示,通过减轻氧化应激与炎性反应,可消除缺氧诱导的右心衰竭。TNF-α和IL-6水平升高与机体免疫所诱导的全身炎性反应相关,本研究中经沙库巴曲缬沙坦治疗后,C 组小鼠血浆TNF-α和IL-6水平降低,提示沙库巴曲缬沙坦可通过调节炎性因子的分泌而减轻小鼠的炎性反应。心力衰竭时室壁张力升高,刺激氧自由基产生,内源性抗氧化物活性降低又进一步影响氧自由基的清除,氧自由基可诱发心律失常,诱导心肌细胞凋亡,促进心室重构[17]。本研究结果显示,沙库巴曲缬沙坦可降低C 组小鼠血浆MDA 水平,并升高SOD 和GSH-Px 水平,提示沙库巴曲缬沙坦可增加心肌清除氧自由基的能力,降低细胞凋亡能力,从而保护心肌组织免受损伤,但保护心肌组织的机制仍有待进一步研究。
AMPK可被Sirt1去乙酰化激活,又可激活Sirt1,二者属正反馈循环,从而抑制炎性反应[18]。PGC-1α属AMPK的重要下游因子,可被AMPK直接磷酸化,在心肌损伤疾病的发生中发挥作用[19]。p-AMPK 可作用于多种下游底物,抑制ATP 的消耗,启动生成ATP 的途径,维持机体能量代谢平衡,增加细胞内NAD+含量,进而使NAD+依赖性Sirt1耗竭[20]。干扰Sirt1/PGC-1α去乙酰化通路可增强氧化应激反应,促进线粒体功能障碍[21]。张城林等[22]的研究结果显示,激活AMPK/PGC-1α 通路可通过促进线粒体合成途径,减轻心肌细胞缺氧损伤。李闯等[23]的研究结果显示,AMPK/PGC-1α通路可反映机体氧化应激状态,在心肌细胞线粒体生物合成与氧化应激反应中发挥作用。本研究结果显示,B组小鼠的心肌组织Sirt1,AMPK,PGC-1α mRNA 和蛋白表达水平均降低,提示CHF 发病过程中Sirt1/AMPK/PGC-1α通路处于阻滞状态;经沙库巴曲缬沙坦灌胃后,C 组小鼠Sirt1,AMPK,PGC-1α mRNA 和蛋白表达水平均显著升高,提示沙库巴曲缬沙坦可能通过激活Sirt1/AMPK/PGC-1α 通路而抑制CHF 小鼠的炎性反应、氧化应激损伤与心肌凋亡,保护心肌组织。在沙库巴曲缬沙坦灌胃基础上添加Sirt1 或AMPK 抑制剂时,保护作用减弱,进一步验证了上述结论。
综上所述,沙库巴曲缬沙坦可能通过激活Sirt1/AMPK/PGC-1α 信号通路而影响CHF 模型小鼠的心功能,但沙库巴曲缬沙坦影响CHF 的信号通路还有待进一步研究。
