呼吸道感染细菌联合疫苗制备及其免疫效果评价
2024-02-24张敬刘殿卿黄菲李欣卢东
张敬, 刘殿卿, 黄菲, 李欣, 卢东
1.唐山市中心血站检验科,河北唐山063000;2.唐山市妇幼保健院检验科,河北唐山063000;3.唐山市工人医院检验科,河北唐山063000
呼吸道感染包含细菌感染及病毒感染,病毒感染占比较高,经病毒感染后的患儿继发细菌感染风险也较高[1-2]。兰菌净、泛福舒及必思添等细菌溶解产物为临床常用疫苗,但这类疫苗菌种均来自国外,并非中国呼吸道感染的常见菌种,因此可能并不完全适用于中国人群[3-4]。另外,进口疫苗价格较为昂贵,不利于普及,从而对疫苗接种率造成影响,因此制备适用于中国小儿呼吸道感染疾病的疫苗具有重要意义。研究表明,溶血性链球菌、流感嗜血杆菌B型、肺炎链球菌、金黄色葡萄球菌、铜绿假单胞菌及肺炎克雷伯菌均为中国呼吸道感染的常见病菌[5-6]。本研究采用以上6种常见病菌制成联合疫苗,并探讨其对免疫效果的影响。
1 材料和方法
1.1 主要试剂及仪器
CCK-8试剂(上海经科化学科技有限公司),RPMI-1640培养基(美国赛默飞世尔科技有限公司),细胞分离液(北京金克隆生物技术有限公司),多聚甲醛(北京金克隆生物技术有限公司),γ干扰素(interferon-γ,INF-γ)及白细胞介素(interleukin,IL)-2试剂盒(上海酶联生物科技有限公司),氯化钠注射液(四川科伦药业股份有限公司),蛋白胨溶液(上海源叶生物科技有限公司),75%乙醇(苏州嘉鼎化学科技有限公司),10%鸡红细胞悬液(南京泽维尔生物科技有限公司),磷酸盐缓冲液(上海之礼生物科技有限公司),2,4-二硝基氟苯(山东西亚化学科技有限公司)。超声波破碎仪(北京星越天成科技有限公司),生物安全柜(青岛海尔医用低温科技有限公司),高速台式离心机(上海安亭科学仪器厂),平板离心机(苏州盛斯尔机械制造有限公司),高压消毒器(上海三申医疗器械有限公司),二氧化碳(CO2)孵孕箱(天津开关照明厂),全自动酶标仪(美国Molecular Devices公司),分光光度计(南京菲勒仪器有限公司),光学显微镜(日本奥林帕斯公司),流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 血液、菌种及动物
血液及菌种均由本院提供,其中血液标本为健康儿童外周血,菌种标本为痰液样本,取自反复呼吸道感染的患儿。40只SPF级小鼠购自北京华阜康公司,雌雄各20只,6~8周龄,体质量18~22 g。纳入标准:①患儿满足《反复呼吸道感染的临床概念和处理原则》[7]诊断标准;②患儿存有反复呼吸道感染的既往史;③患儿年龄5~13岁。
1.3 细菌联合疫苗制备
从痰液样本中将菌种分离培养,生理盐水冲洗所获菌种(溶血性链球菌、流感嗜血杆菌B型、肺炎链球菌、金黄色葡萄球菌、铜绿假单胞菌及肺炎克雷伯菌);采用超声波破碎仪分别将不同细菌破碎;将蛋白质沉淀后透析,采用分光光度计测量蛋白水平,并以细菌蛋白作为抗原;将所获细菌蛋白与0.9%生理盐水混合,制备成联合疫苗。根据联合疫苗质量浓度分为对照组(生理盐水)、低水平组(0.1 g/L疫苗)、中水平组(0.3 g/L疫苗)及高水平组(0.5 g/L疫苗)[8]。
1.4 体外实验
1.4.1 单个核细胞悬液制备 取20 mL外周血样本,抗凝,20 mL磷酸盐缓冲液混匀;将混匀液均匀置于细胞分离液表面;梯度离心20 min,2 000 r/min;收集白膜层,采用RPMI-1640培养基洗涤3次,每次离心10 min,2 000 r/min;去除上清液,经RPMI-1640培养基吹打,制成所需单个核细胞悬液。
1.4.2 单个核细胞增殖活性测定 取96孔平板培养板,采用RPMI-1640培养基将单个核细胞悬液调至1×106个/mL,并依次每孔接种100 μL;加入相应质量浓度(0.1、0.3、0.5 g/L)联合疫苗,同时设置等体积阴性对照孔;完成后置于37 ℃及5%CO2的孵孕箱中,分别在培养24、48、72 h时,向每孔内加入10 μL CCK-8试剂,继续培养4 h;采用全自动酶标仪检测450 nm处光密度值,反映细胞增殖活性。
1.4.3 单个核细胞淋巴细胞表型变化测定 取24孔平板培养板及单个核细胞悬液,采用RPMI-1640培养基将单个核细胞悬液调至5×106个/mL,依次每孔接种2.0 mL;每孔标号,依次为1~48号,将1~12号设置为对照组,13~24号设置为低水平组,24~36号设置为中水平组,37~48号设置为高水平组。低、中、高水平组每孔滴加0.1 mL的0.1、0.3、0.5 g/L联合疫苗,对照组每孔加入0.1 mL的RPMI-1640培养基。连续培养6天,将细胞悬液取出,离心5 min,1 500 r/min;采用磷酸盐缓冲液洗涤;加入相应荧光素标记的抗CD4、抗CD8及抗CD19抗体,随后在避光环境下孵育30 min;孵育结束后以磷酸盐缓冲液洗涤2次;采用1%多聚甲醛固定,流式细胞仪检测CD4+、CD8+及CD19+。
1.4.4 细胞因子测定 在测定单个核细胞增殖活性前,取上清液50 μL,随后继续培养,并在第2、第4、第8天采用INF-γ及IL-2试剂盒测定INF-γ及IL-2含量。
1.5 体内实验
1.5.1 造模处理 将40只SPF级小鼠分为4组,每组10只,且雌雄各一半,根据所用联合疫苗质量浓度分为对照组、低水平组、中水平组及高水平组[8];全部小鼠适应性喂养10天,随后低水平组、中水平组及高水平组小鼠每天上午灌服0.2 mL对应质量浓度的联合疫苗,对照组则在相同时间灌服0.2 mL生理盐水;灌服10天后处死全部小鼠。
1.5.2 迟发型超敏反应测定 各组小鼠处理9天后,取50 μL 1%的2,4-二硝基氟苯涂抹于小鼠右耳前后两面,随后左耳涂抹等量丙酮-橄榄油;24 h后处死小鼠,采用8 nm打孔器分别在左右耳同一部位打下圆耳片,并进行称重;肿胀度=右耳质量-左耳质量。
1.5.3 脾脏指数及胸腺指数测定 对处死小鼠称重,完成后取出脾脏及胸腺,清理表面血液后,对脾脏及胸腺进行称重;脾脏(胸腺)指数=脾脏(胸腺)质量/小鼠体质量。
1.5.4 巨噬细胞吞噬功能测定 各组小鼠处理7天后,将1%蛋白胨溶液注射至小鼠腹腔,1次/天,3天。第3天注射结束后,间隔24 h,并将10%的鸡红细胞悬液1 mL注射至小鼠腹部,30 min后处死小鼠,并再次向小鼠腹腔注射2 mL生理盐水;揉按小鼠腹腔1 min,将腹腔内液体混匀;混匀后取1 mL腹腔液;将所取腹腔液均匀涂抹于载玻片,置于37 ℃恒温箱孵育30 min,固定,染色,冲洗,晾干后于显微镜下观察。吞噬指数=鸡红细胞被吞噬数/巨噬细胞数。
1.5.5 血清溶血素含量测定 各组小鼠灌注联合疫苗3天后,小鼠腹部注射1 mL 10%鸡红细胞悬液。免疫结束后,处死小鼠并摘取其眼球取血;离心,取血清,生理盐水稀释500倍;将10%鸡红细胞悬液、1 mL稀释血清在同一试管内混匀;将混匀液作为对照;取混匀液,放置于37 ℃恒温水浴下30 min,冰浴;离心后取上清液,采用酶标仪在波长为540 nm处测量光密度(optical density,OD)值。
1.6 统计学分析
采用SPSS 21.0软件进行数据处理与分析。计量资料采用t检验,多组间比较采用单因素方差分析,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 联合疫苗对人外周血单个核细胞增殖活性的影响
各组单个核细胞增殖活性均随时间延长而升高,并且在相同时间内,联合疫苗质量浓度越高,单个核细胞增殖活性越高(P<0.05;表1)。
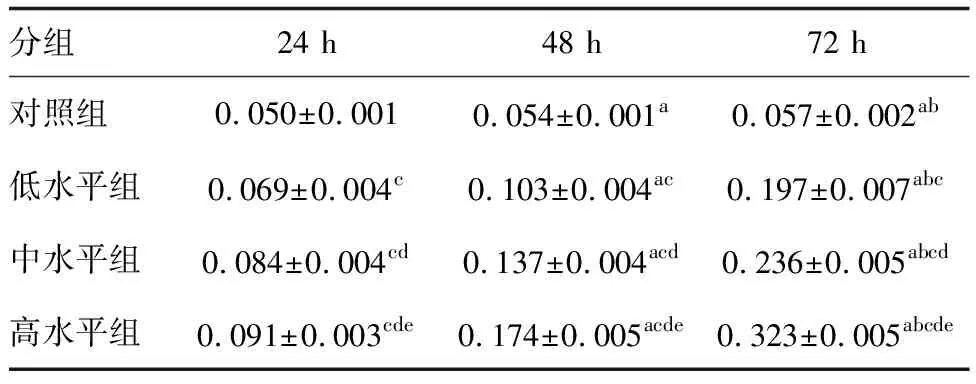
表1 联合疫苗对人外周血单个核细胞增殖活性OD值的影响
2.2 联合疫苗对单个核细胞淋巴细胞表型的影响
与对照组比较,低、中、高水平组单个核细胞CD4+、CD19+水平升高,CD8+水平降低,且随着联合疫苗质量浓度升高,各指标水平变化越明显(P<0.05;表2)。
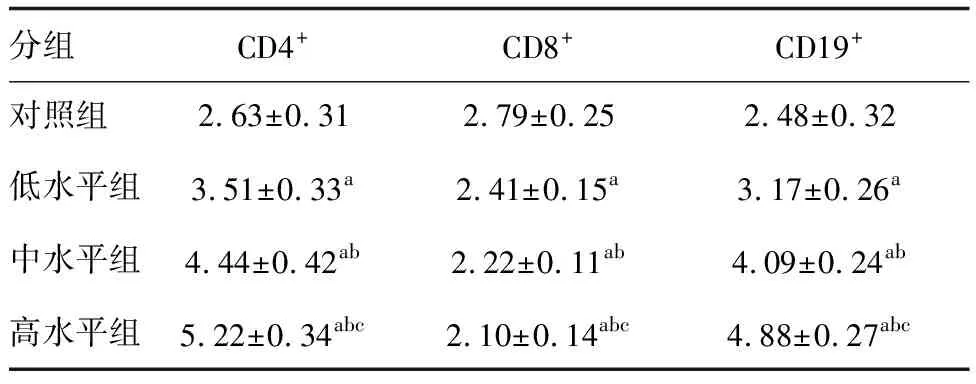
表2 联合疫苗对单个核细胞淋巴细胞表型的影响 %
2.3 联合疫苗对细胞因子的影响
各组INF-γ及IL-2水平均随时间延长而升高,并且在相同时间内,联合疫苗质量浓度越高,INF-γ及IL-2水平越高(P<0.05;表3)。
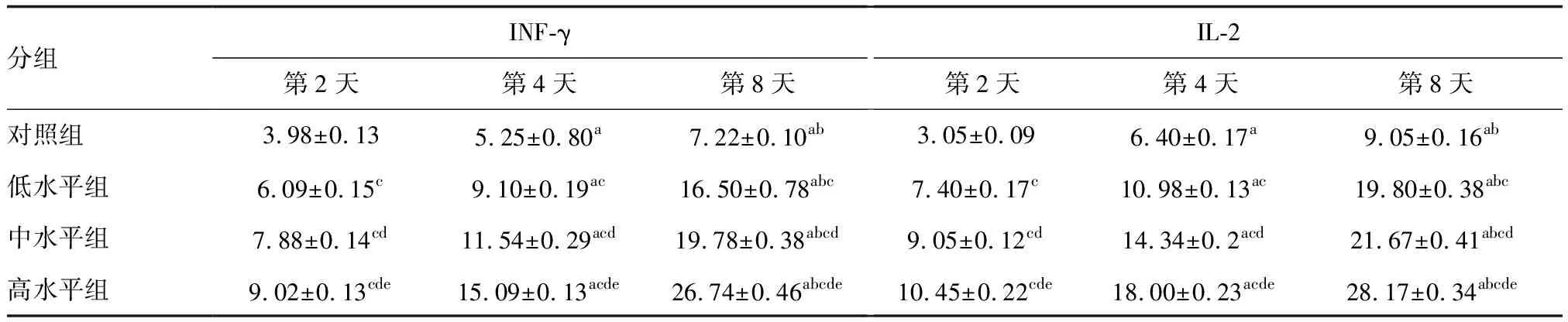
表3 联合疫苗对细胞因子的影响 ng/L
2.4 联合疫苗对小鼠各免疫性指标水平影响
与对照组比较,低、中、高水平组肿胀度、脾脏指数、胸腺指数、吞噬指数及血清溶血素水平均升高,且随着联合疫苗质量浓度升高而升高(P<0.05;表4)。
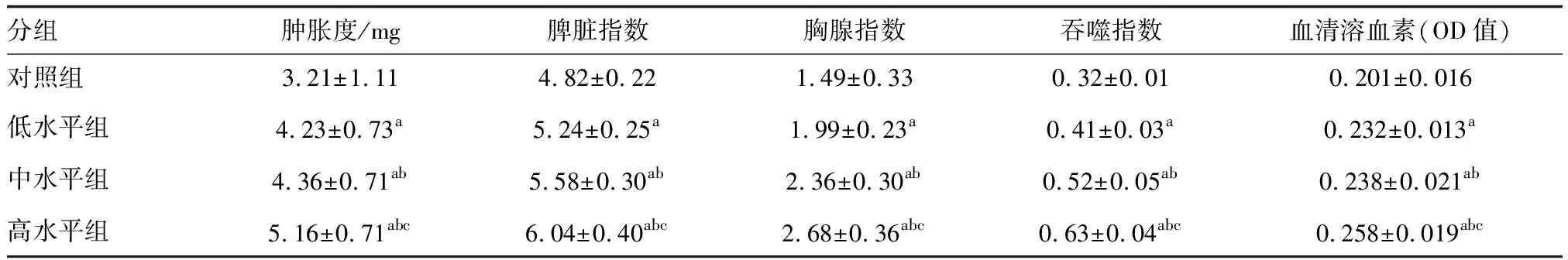
表4 联合疫苗对小鼠各免疫性指标水平的影响
3 讨 论
中国呼吸道感染发病率较高,且儿童发病率高于成人,临床上常采用抗菌药物进行治疗,但导致各类致病菌耐药性均有所升高[9-10]。因此需采用有效的预防措施以降低呼吸道感染发病率。接种疫苗为预防疾病的重要措施,但目前中国所接种疫苗主要为进口疫苗,因其价格较为昂贵,从而影响接种率,同时预防效果亦需经过大量实验研究[11-12]。
本次研究采用溶血性链球菌、流感嗜血杆菌B型、肺炎链球菌、金黄色葡萄球菌、铜绿假单胞菌及肺炎克雷伯菌等中国呼吸道感染常见的6种病菌制成联合疫苗,从而对预防中国呼吸道感染疾病更具有针对性。本研究结果显示,单个核细胞增殖活性随联合疫苗质量浓度与培养时间的增加而升高,说明在本次实验所用质量浓度区间,质量浓度升高可提高单个核细胞增殖活性。由于单个核细胞可通过吞噬病原体及产生细胞因子等方式参与免疫反应,故当单个核细胞增殖活性越高则反映机体对免疫刺激具有较强应答功能[13-14]。王国征等[15]研究表明,单个核细胞增殖活性越高,则利于促进细胞因子分泌,而本研究亦发现各组INF-γ及IL-2水平均随时间延长而升高,并且在相同时间内,联合疫苗质量浓度越高,INF-γ及IL-2水平越高。INF-γ具有调节免疫反应、增强抗菌能力和促进细胞毒性的功能,并且其不仅可以调节细胞免疫,亦参与体液免疫调节过程中[16]。IL-2可促进T细胞的增殖、分化及生存,同时亦可刺激B细胞增殖及抗体产生,从而增强体液免疫效应[17]。因此,当INF-γ及IL-2水平升高时,则提示联合疫苗能增强淋巴细胞活性,利于调动免疫功能,并起到预防呼吸道感染作用。另外,CD4+及CD8+均为T细胞表面产物,CD19+为B细胞表面产物,三者均参与了细胞及体液免疫,当CD4+及CD19+水平升高及CD8+水平降低,则可表明机体免疫功能越高[18-19]。本研究结果显示,随着联合疫苗质量浓度的增加,小鼠体内CD4+及CD19+水平均增加,CD8+水平降低;提示接种联合疫苗质量浓度越高,对细胞及体液免疫调节能力越强,小鼠免疫功能越高。
迟发型超敏反应由T细胞介导,可对免疫功能进行衡量,因此当肿胀度越高,则提示迟发型超敏反应程度越高,免疫功能越强[20]。脾脏及胸腺可调节免疫细胞以应对感染等,当脾脏指数及胸腺指数升高,则提示免疫反应增强[21]。吞噬指数可反映巨噬细胞等免疫细胞对外来病菌吞噬及清除能力。溶血素参与了机体对抗感染及清除病菌的免疫反应[22],因此当血清溶血素水平升高,则代表机体的免疫反应越高。本研究结果显示,随着接种联合疫苗质量浓度的增加,小鼠的肿胀度、脾脏指数、胸腺指数、吞噬指数、血清溶血素水平均升高;提示接种联合疫苗质量浓度越高,小鼠的体液免疫功能越强。
综上,呼吸道感染细菌联合疫苗有利于提高细胞及体液免疫能力,且在呼吸道感染细菌联合疫苗质量浓度为0.5 g/L时,可获得的免疫效果最佳。
