血清miR-21、miR-30b对乳腺癌患者术后曲妥珠单抗靶向治疗心脏毒性的预测价值
2024-02-24冯晴罗志刚方吉
冯晴, 罗志刚, 方吉
四川省第三人民医院检验科,四川成都 610072
中国乳腺癌发病率为女性恶性肿瘤首位,死亡率高于世界平均水平[1]。近年来,分子靶向治疗被广泛应用于肿瘤,曲妥珠单抗以癌基因为靶点,在乳腺癌治疗中发挥重要作用[2],但临床上靶向药物如曲妥珠单抗常会导致主要心血管不良事件[3]。微小RNA(microRNA,miRNA)是一类具有调控基因表达作用的非编码小分子RNA,在心脏发育和损伤中发挥一定作用,miRNAs对癌症化疗诱导的心脏毒性也具有预测价值[4-5]。miR-21在胶质母细胞瘤、乳腺癌、肝癌和胰腺癌等癌组织中常表现出高表达[6],同时miR-21表达水平与乳腺癌细胞增殖、迁移、凋亡和肿瘤生长密切相关[7]。miR-30b在乳腺癌、膀胱癌、胃癌细胞中低表达,miR-30b可以调节乳腺癌细胞增殖并诱导细胞周期停滞[8]。但目前尚未有关于血清miR-21、miR-30b对乳腺癌术后曲妥珠单抗靶向治疗心脏毒性预测价值的临床报道,本文对此进行了研究,现报道如下。
1 资料和方法
1.1 临床资料
选取本院2019年1月—2022年1月收治的乳腺癌女性患者138例为观察组,年龄(52.6±8.3)岁,体质指数(22.3±2.0)kg/m2。根据是否发生化疗相关心脏毒性事件,将观察组分为非心脏毒性组(115例)和心脏毒性组(23例)2个亚组。纳入标准:①接受切除术;②美国东部肿瘤协作组行为评分≤1分;③左室射血分数(left ventricular ejection fraction,LVEF)≥55%;④预期寿命≥12个月。排除标准:①明显心功能异常;②其他恶性肿瘤病史;③严重感染;④妊娠期或哺乳期女性。另选取同期体检健康女性150例为健康组,年龄(53.02±7.22)岁,体质指数(22.82±3.27)kg/m2。两组上述资料比较差异无显著性(P>0.05)。本研究经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 治疗方法
乳腺癌患者接受乳腺癌改良根治术后,应用EC-D+T方案进行化疗。前3个月给与表柔比星100 mg/m2+环磷酰胺600 mg/m2静脉滴注(每周1次),治疗4个周期,3周/期。第4~6个月在前面基础上加多西他赛100 mg/m2静脉滴注(每周1次),治疗4个周期,3周/期;每个周期第1周滴注4 mg/kg曲妥珠单抗(武汉维斯尔曼生物工程有限公司),后2周滴注2 mg/kg曲妥珠单抗(每周1次)。第7~12个月每3周静脉滴注6 mg/kg曲妥珠单抗1次。
1.3 qRT-PCR检测miR-21、miR-30b水平
采集健康女性体检当天、乳腺癌患者首次化疗当天空腹静脉血5 mL,4 000 r/min离心10 min,分离血清。根据GenBank序列设计引物,miR-21上游引物:5′-ACATCAGCTGGCTCTTCACATGT-3′,下游引物:5′-TGTCGTGGAGTCGCAATTC-3′。miR-30b上游引物:5′-CAGAGTGCACGGTTAAAGG-3′,下游引物:5′-GGTCCAGTTATTATTTTATGC-3′。内参U6上游引物:5′-CTCGCTTCGGCACGACATATACTA-3′,下游引物:5′-ACGAATAAGCGTGTCATCGTTGC-3′。qRT-PCR反应体系:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,最后72 ℃ 30 s,循环40次。采用2-ΔΔCt方法计算miR-21、miR-30b相对表达量。
1.4 化疗后心脏毒性的评估
化疗后,分别在第0、3、6、12个月监测患者LVEF,并计算LVEF的绝对下降值(ΔLVEF)。观察终点为治疗后出现心脏毒性,如出现心力衰竭、ΔLVEF≥10%且LVEF<53%、急性冠状动脉综合征、致命性心律失常。
1.5 统计学方法
2 结 果
2.1 各组miR-21、miR-30b表达水平的比较
观察组血清miR-21高于健康组,而miR-30b低于健康组;心脏毒性组血清miR-21高于非心脏毒性组,而miR-30b低于非心脏毒性组(P<0.05;表1)。
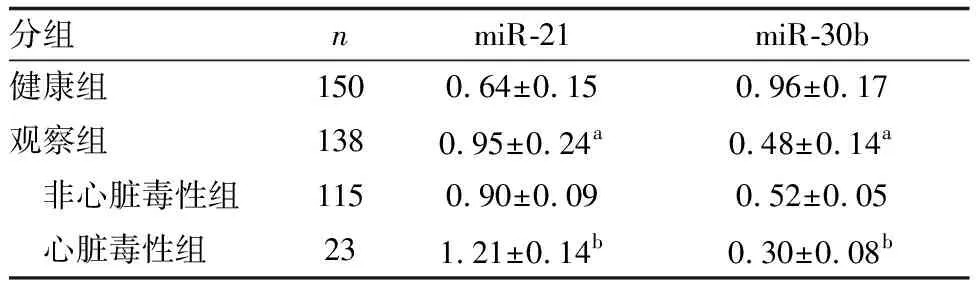
表1 各组血清miR-21、miR-30b表达水平的比较
2.2 不同心脏毒性患者临床资料的比较
心脏毒性组高血压占比高于非心脏毒性组,LVEF低于非心脏毒性组(P<0.05;表2)。
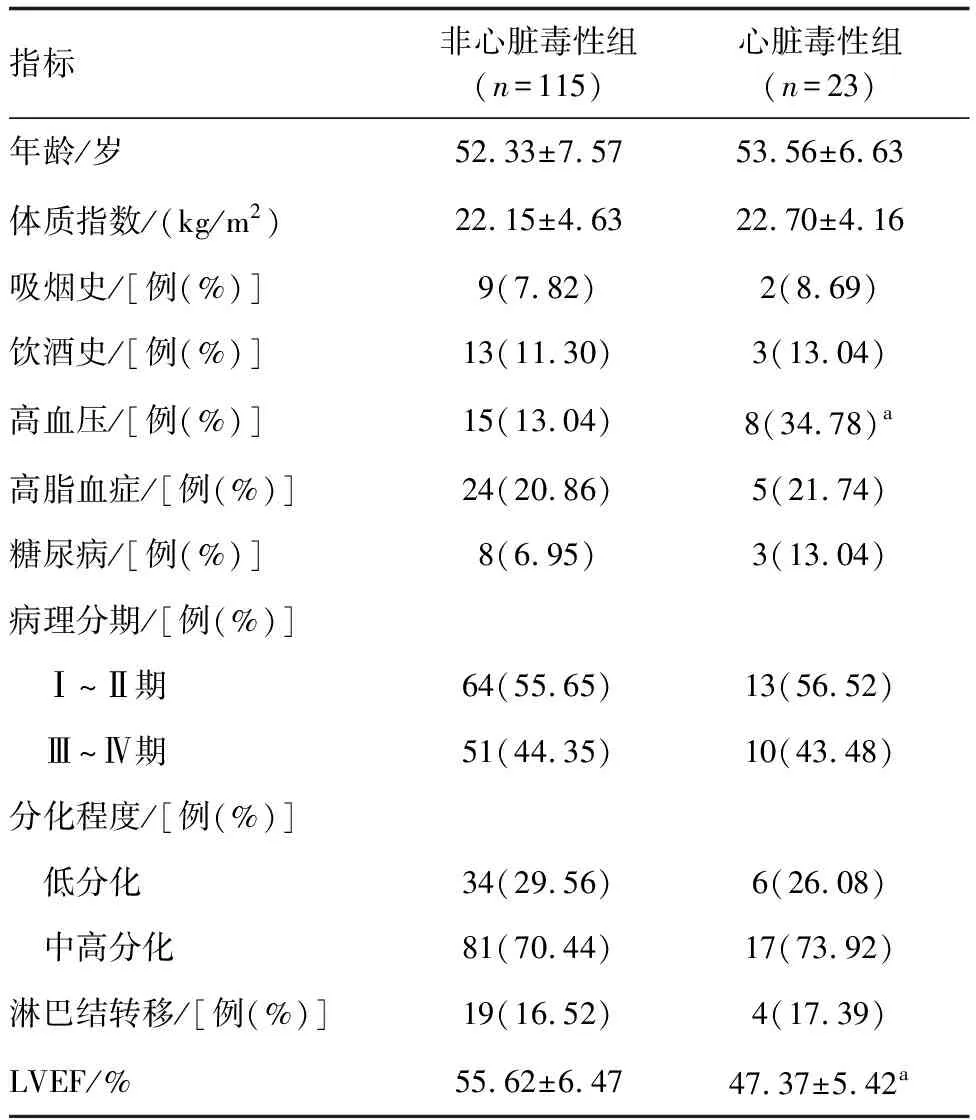
表2 不同心脏毒性患者临床资料的比较
2.3 乳腺癌术后化疗心脏毒性的多因素Logistic回归分析
以是否发生心脏毒性为因变量,以上述有差异指标为自变量,进行多因素Logistic回归分析显示,LVEF、miR-21、miR-30b是乳腺癌术后化疗心脏毒性的影响因素(P<0.05;表3)。
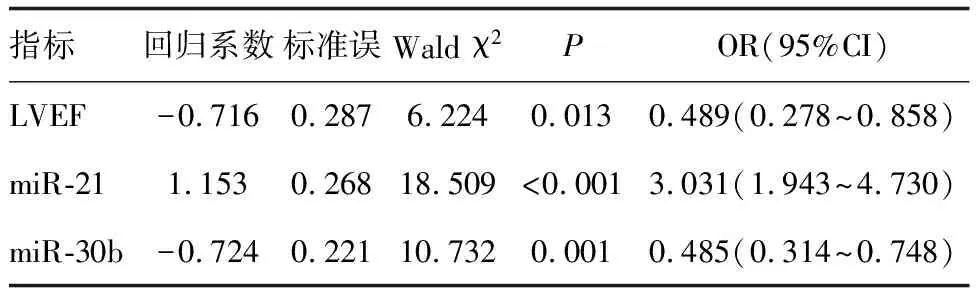
表3 乳腺癌术后化疗心脏毒性的多因素Logistic回归分析
2.4 miR-21、miR-30b对心脏毒性的预测价值
血清miR-21、miR-30b联合预测乳腺癌术后化疗心脏毒性的诊断效能高于miR-21、miR-30b单独预测(P<0.05;表4和图1)。
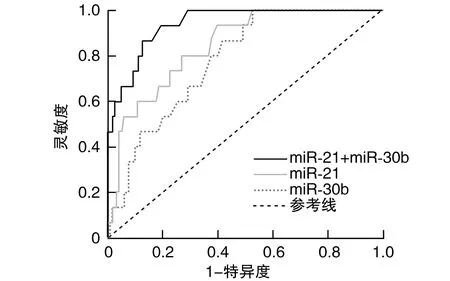
图1 血清miR-21、miR-30b预测乳腺癌术后化疗心脏毒性的ROC曲线
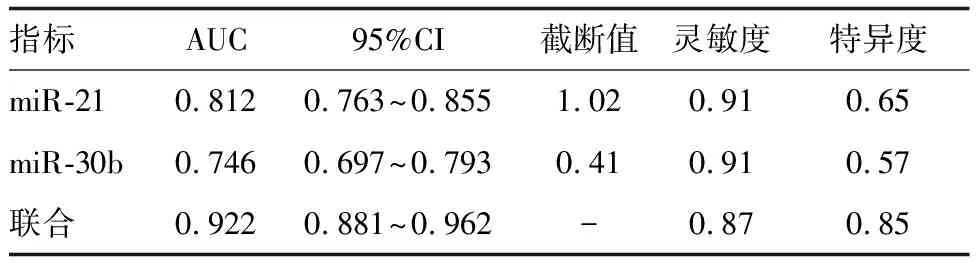
表4 血清miR-21、miR-30b对乳腺癌术后化疗心脏毒性的预测价值
3 讨 论
蒽环类药物具有高效的细胞毒性作用,目前被广泛应用于乳腺癌治疗[9];曲妥珠单抗对乳腺癌细胞具有特异性[10],可显著改善患者躯体功能及健康状况,但接受蒽环类药物联合曲妥珠单抗治疗的乳腺癌患者发生心脏毒性风险高,蒽环类药物在代谢过程中,会产生大量的超氧自由基引起氧化应激,并通过增加细胞内钙离子浓度促使心肌细胞发生凋亡和坏死,进而导致心肌损伤[11]。寻找可及早判断该心脏毒性的特异性的生物标志物在乳腺癌患者临床精准医疗中非常重要。
RNA生物标志物较蛋白质生物标志物更为敏感且更具有特异性,且其检测成本也低于蛋白质标志物。miR-21可通过抑制人第10号染色体缺失的磷酸酶及其他抑癌基因来促进肿瘤的发生和进展,miR-30b被证实在癌症发病机制中起着重要作用[12],在乳腺癌细胞中,曲妥单抗能够诱发miR-30b上调并抑制细胞生长[13]。miR-21和miR-30b对乳腺癌患者术后曲妥珠单抗靶向治疗心脏毒性预测价值的相关研究目前较少。
本研究发现,观察组血清miR-21高于健康组,而miR-30b低于健康组,提示血清miR-21水平在乳腺癌患者中表达上调,miR-30b在乳腺癌患者中表达下调。本研究进一步发现,心脏毒性组血清miR-21高于非心脏毒性组,而miR-30b低于非心脏毒性组,进一步证实miR-21和miR-30b与患者发生化疗相关心脏毒性有关,这与文献[14]报道的动物模型实验结果一致。
本研究发现,血清miR-21、miR-30b是乳腺癌术后化疗心脏毒性的影响因素。血清miR-21是乳腺癌患者术后曲妥珠单抗靶向治疗相关心脏毒性的危险因素,血清miR-30b是乳腺癌患者术后曲妥珠单抗靶向治疗心脏毒性的保护因素,提示检测血清miR-21水平可协助评估宫颈癌患者发生化疗相关心脏毒性事件的风险,血清miR-30b可作为预测乳腺癌患者术后曲妥珠单抗靶向治疗心脏毒性的辅助指标,且miR-30b表达可降低患者发生化疗相关心脏毒性事件的风险。既往研究表明,miR-21可以通过增强心肌氧化应激以增加蒽环类药物诱导的心肌细胞毒性。蒽环类药物联合曲妥珠单抗可促进机体氧化应激和心肌细胞凋亡,从而导致乳腺癌患者发生心脏毒性损伤[15-17]。本研究发现,miR-21在发生心脏毒性和非心脏毒性的乳腺癌患者中表达均增加,且出现心脏毒性患者miR-21增加比非心脏毒性患者更为明显,而miR-30b表达与之相反,推测可能是化疗药物诱导超氧阴离子和活性氧的产生增加,导致氧化损伤。血清miR-21、miR-30b联合预测乳腺癌术后化疗心脏毒性的诊断效能高于miR-21、miR-30b单独预测。
总之,血清miR-21水平升高、miR-30b水平降低与乳腺癌术后化疗心脏毒性密切相关,二者可作为评估乳腺癌术后化疗心脏毒性的生物学指标,且两者联合预测的效能更高,其作用机制有待进一步研究佐证。
