恶性胸膜间皮瘤细胞培养条件及CDKN2B 对癌细胞的作用
2024-02-24尹小川尹瑞扬李冉华蔡方奇童兴和
尹小川 ,尹瑞扬 ,李冉华 ,蔡方奇 ,崔 岳 ,毕 涛 ,童兴和
(1)昆明医科大学第一附属医院胸外科,云南 昆明 650032;2)昆明医科大学海源学院第二临床医学系,云南 昆明 651700)
恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)是一种起源于胸膜腔内间皮细胞的恶性肿瘤细胞,侵袭性较高。MPM 可分为上皮样、肉瘤样以及双相型3 种亚型。其中,上皮样占60%,双相样占30%[1]。石棉纤维的吸入是MPM 的主要危险因素[2]。据统计,从事石棉相关工作人群患MPM 的概率为100/1000000,而普通人群的患病率为1/1000000[3]。MPM 早期无明显症状,潜伏期较长,通常为30~40 a。随着肿瘤的增大,患者会出现气促、胸部疼痛、咳嗽以及呼吸困难。由于早期无显著症状,患者多于晚期确诊,中位生存期为诊断后的12 个月,5 a 生存率低于3%[4]。目前,MPM 的临床治疗方法主要有手术切除、化学药物治疗、放射治疗以及3 者联合治疗[5−7],这些治疗虽然可提高患者的生存率,但治疗效果仍不够理想。靶向治疗是近来提出的治疗策略,早期的临床实验已初显成效[8],寻找可行的标志物成为治疗MPM 的新挑战。
肿瘤细胞是研究肿瘤发生和发展致病机制的关键工具,从肿瘤组织中分离得到的原代细胞生物学和遗传学特性与肿瘤细胞基本一致,体外培养的癌细胞可用于研究癌细胞生物学行为、癌变机制的探索、抗癌药物检测等,在肿瘤研究中起着不可估量的作用。本研究中,笔者取MPM 患者的肿瘤组织,经分离得到原代细胞后分别利用RPMI-1640、DMEM 和DMEM/F12 培养基进行培养,观察3 种培养基对MPM 细胞传代的影响,同时探讨CDKN2B 对MPM 细胞增殖、侵袭和凋亡的作用。
1 材料与方法
1.1 主要试剂
多聚甲醛(天津光复),Triton X-100、Tween 20(Sigma-vetec),PBS、抗淬灭封片剂(含DAPI)(北京中杉金桥),Annexin V-FITC/PI 试剂、CCK-8 试剂盒盒(上海碧云天),瑞士-吉姆萨符合染色液(北京Solarbio)。CDKN2B、N-cadherin、Vimentin、E-cadherin、Bcl-2、Bax、GAPDH 抗体以及二抗(北京博奥森),Cleaved-caspase-3 抗体(英国Abcam),逆转录试剂盒(美国Merck Millipore),Lipofectamine 2000 试剂盒(美国Invitrogen),SYBR II Premix Ex Taq 试剂盒(日本Takara),Transwell小室(美国康宁)。
1.2 临床样本及细胞株建立
本研究中患者知情并签署知情同意书,同时获得了昆明医科大学第一附属医院伦理委员会的批准(2019 伦审L 第25 号)。右侧胸膜结节患者麻醉后,利用高频电刀切割1 个观察孔,分离胸腔黏连并切除纤维囊壁,电刀在不同方向切除部分含结节在内的壁层胸膜,取多个约1 cm×1 cm×1 cm 的样本。样本置于含PBS 的无菌离心管内,用含双抗的PBS 冲洗3 次后转移至实验室内。样本经无菌D-kank’s 溶液清洗2 次,剪碎后将组织碎片黏附于培养瓶内壁,置于细胞培养箱内培养。当细胞融合至85%时,开始传代。
1.3 细胞培养及传代
分别配置含10% FBS 的RPMI-1640、DMEM以及DMEM/F12 培养液,将分离得到的MPM 细胞分别接种于述3 种培养液中,在5% CO2培养箱培养,每48 h 更换1 次培养液。待细胞密度达85%左右时,进行传代。用0.25%胰蛋白酶消化细胞并离心,加入细胞培养液制备单细胞悬液,按1∶3 的比例进行传代,并重复传代操作。
人间皮细胞MET-5A(上海中乔新舟)生长于人间皮完全培养基(上海中乔新舟)内,并置于5% CO2,37 ℃环境中。
1.4 CCK-8 实验
消化后的细胞接种至96 孔板,每孔板2000个细胞,细胞在37 ℃,5% CO2环境中培养。在培养的第0、6、12、24、48、72 h,将10 µL CCK-8 试剂加至每孔,置于黑暗环境中培养1 h,酶标仪测定吸光度值。
1.5 瑞氏吉姆萨染色
细胞经0.25%胰蛋白酶消化,0.01 mol/L PBS漂洗每次5 min,重复3 次。细胞经4%多聚甲醛固定30 min。PBS 漂洗细胞后加入瑞氏-吉姆萨复合液染色1 min。滴加等量的0.01 mol 的磷酸盐缓冲液至玻片,与瑞氏吉姆萨染色液混匀,15 min后蒸馏水漂洗,晾干玻片后显微镜拍照并记录。
1.6 免疫荧光染色
细胞经PBS 漂洗3 次,每次5 min。固定后的细胞加入0.2% Triton X-100 在室温中通透20 min。随后加入5%正常血清封闭,1 h 后取出玻片上多余的封闭液,与稀释后的一抗4 ℃过夜孵育。0.01 mol/L PBST 漂洗玻片,与二抗孵育1 h。漂洗、封片,荧光显微镜观察荧光强度。
1.7 Western blot
收集细胞,通过RIPA 试剂充分裂解细胞,提取细胞中的总蛋白。测定总蛋白浓度,使用SDS-PAGE 在10%凝胶上对蛋白质进行电泳,并转移到PVDF 膜。室温中,用5%牛血清白蛋白封闭1 h,随后分别与稀释后的一抗过夜孵育,再与二抗孵育2 h。通过增强化学发光试剂盒显示目的条带。
1.8 RT-qPCR
收集MPM 细胞,TRIzol 提取细胞中的总RNA,逆转录试剂盒用于合成cDNA。SYBR II Premix Ex Taq 试剂盒用于CDKN2B mRNA 的qPCR 检测。GAPDH 作为CDKN2B 的参照物。2-ΔΔct法用于分析CDKN2B mRNA 表达。
1.9 细胞转染
上海吉凯基因合成pcDNA-NC 和pcDNACDKN2B。根据试剂盒说明书,利用Lipofectamine 2000 试剂盒 将pcDNA-NC 和pcDNA-CDKN2B 分别转染至MPM 细胞中,将细胞置于37 ℃、5%CO2条件下培养48 h。RT-qPCR 和Western blot 检测转染效率。
1.10 Transwell 检测侵袭
8 µm 的Transwell 小室用于检测细胞侵袭能力。无血清培养基稀释的基质胶平铺于小室上室。无血清RPMI-1640 培养液重悬消化后的细胞,再接种于24 孔板(6×104个/孔),下室中加入含10%FBS 的RPMI-1640 培养液。Transwell 小室放入细胞培养箱常规培养。48 h 后,取出下室,用4%多聚甲醛固定细胞,0.1%结晶紫染色,倒置显微镜观察细胞。
1.11 流式细胞术检测凋亡
0.25%胰蛋白酶消化MPM 细胞,PBS 漂洗。加入5 µL FITC 与细胞混合均匀,避光孵育15 min。再与3 µL PI 避光孵育5 min,流式细胞仪分析细胞凋亡率。
1.12 统计学处理
上述实验均进行3 次重复。GraphPad Prism 8用于分析数据及绘图,2 组间数据比较采用学生t检验。多组间差异通过采用单因素方差分析,进一步两两比较采用Tukey’s 检验。数据表示为均值±标准差。P< 0.05 代表差异存在统计学意义。
2 结果
2.1 3 种培养条件对MPM 细胞形态和增殖的作用
分别利用RPMI-1640、DMEM 和DMEM/F12培养液培养细胞并进行传代,观察发现,MPM 细胞主要呈短梭形或不规则多角形、贴壁,相连成片,重叠生长,见图1A。DMEM 和DMEM/F12培养液培养的MPM 细胞在P(passage,P)10 时相对稀疏,细胞多呈长梭形,分散分布。随后,通过CCK-8 实验检测细胞增殖活力,各组中P1 细胞增殖活力无明显差异(P> 0.05),P5 细胞在DMEM 组和DMEM/F12 培养12 h 时增殖活力显著高于RPMI-1640 组,P10 中各组细胞的增殖活力在72 h 时RPMI-1640 组中细胞活力高于DMEM和DMEM/F12 组(P< 0.05)。由此表明,建立的MPM 细胞在RPMI-1640 组细胞的活力较为稳定。
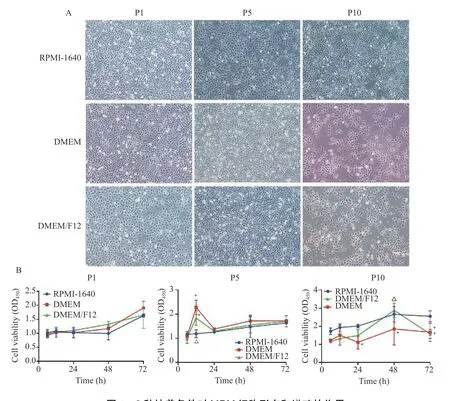
图1 3 种培养条件对MPM 细胞形态和增殖的作用Fig.1 Effect of three culture conditions on morphology and proliferation of MPM cells
2.2 瑞氏-吉姆萨染色结果
瑞氏吉姆萨染色结果,见图2。3 种条件下培养的MPM 细胞多为椭球型或不规则多边形,核呈紫蓝色,胞质为淡紫色,细胞胞体饱满,形态均一。细胞核核大小不一,偶有巨核和多核。
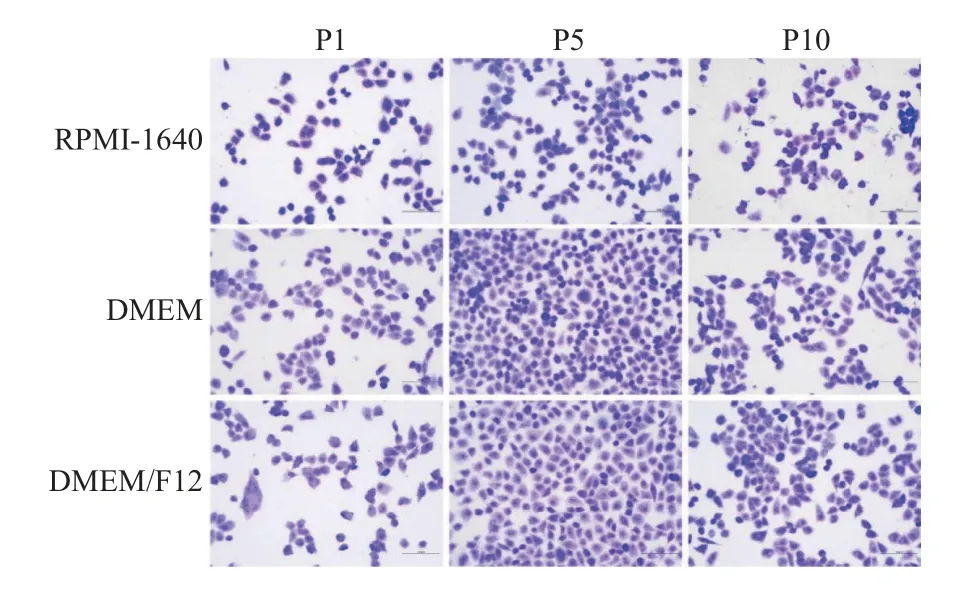
图2 瑞氏-吉姆萨染色结果(20×)Fig.2 The results of Wright Giemsa staining(20×)
2.3 免疫荧光检测MPM 细胞标志物
通过免疫荧光染色检测MPM 标志物Calretinin、CD141、CK5、EMA 和WT-1 的荧光强度,结果显示,3 种培养条件下Calretinin、CD141、CK5、EMA 和WT-1 均在P1、P5 和P10 的MPM 细胞中表达,且Calretinin 和CK5 的荧光强度较高,见图3。
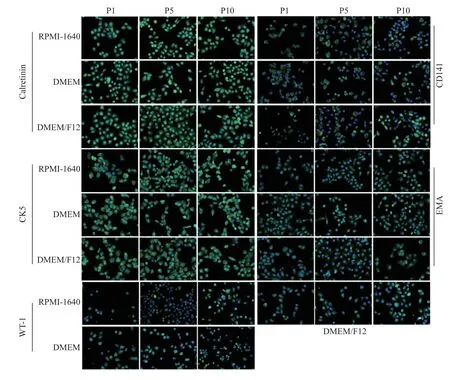
图3 免疫荧光检测MPM 细胞标志物(40×)Fig.3 The MPM cells biomarkers were detected by immunofluorescence assay(40×)
2.4 CDKN2B 调控MPM 细胞增殖、侵袭和凋亡
上述实验结果表明,分离得到的MPM 细胞在RPMI-1640 培养条件下细胞活力相对稳定,笔者选择RPMI-1640 培养基培养分离得到MPM 细胞。RT-qPCR 和Western blot 检测第5 代MPM 细胞中CDKN2B 的表达,发现CDKN2B mRNA 和蛋白表达在MPM 细胞中表达低于人间皮膜细胞MET-5A(P< 0.05),见图4A~4B。随 后,在MPM 细胞中转染pcDNA-CDKN2B,转染后CDKN2B 的表达显著高于对照组(P< 0.05),见图4C~4D。CCK-8、Transwell、Western blot 以及流式细胞术结果表明,相比较于对照组,过表达CDKN2B 组中MPM 细胞的增殖活力降低(P<0.05),见图4E;过表达CDKN2B 抑制细胞侵袭(P< 0.05),见图4F;在过表达CDKN2B 组中间质标志物N-cadherin(P< 0.001)和Vimentin(P<0.01)表达降低,上皮标志物E-cadherin 表达升高(P< 0.01),见图4G;与对照组相比,过表达CDKN2B 组MPM 细胞凋亡率(P< 0.01)和促凋亡蛋白Cleaved-caspase-3(P< 0.01)和Bax(P< 0.001)表达升高,Bcl-2 表达被抑制(P< 0.01),见图4H~4I。由此表明,过表达CDKN2B 可抑制MPM 细胞增殖和转移,促进细胞凋亡。
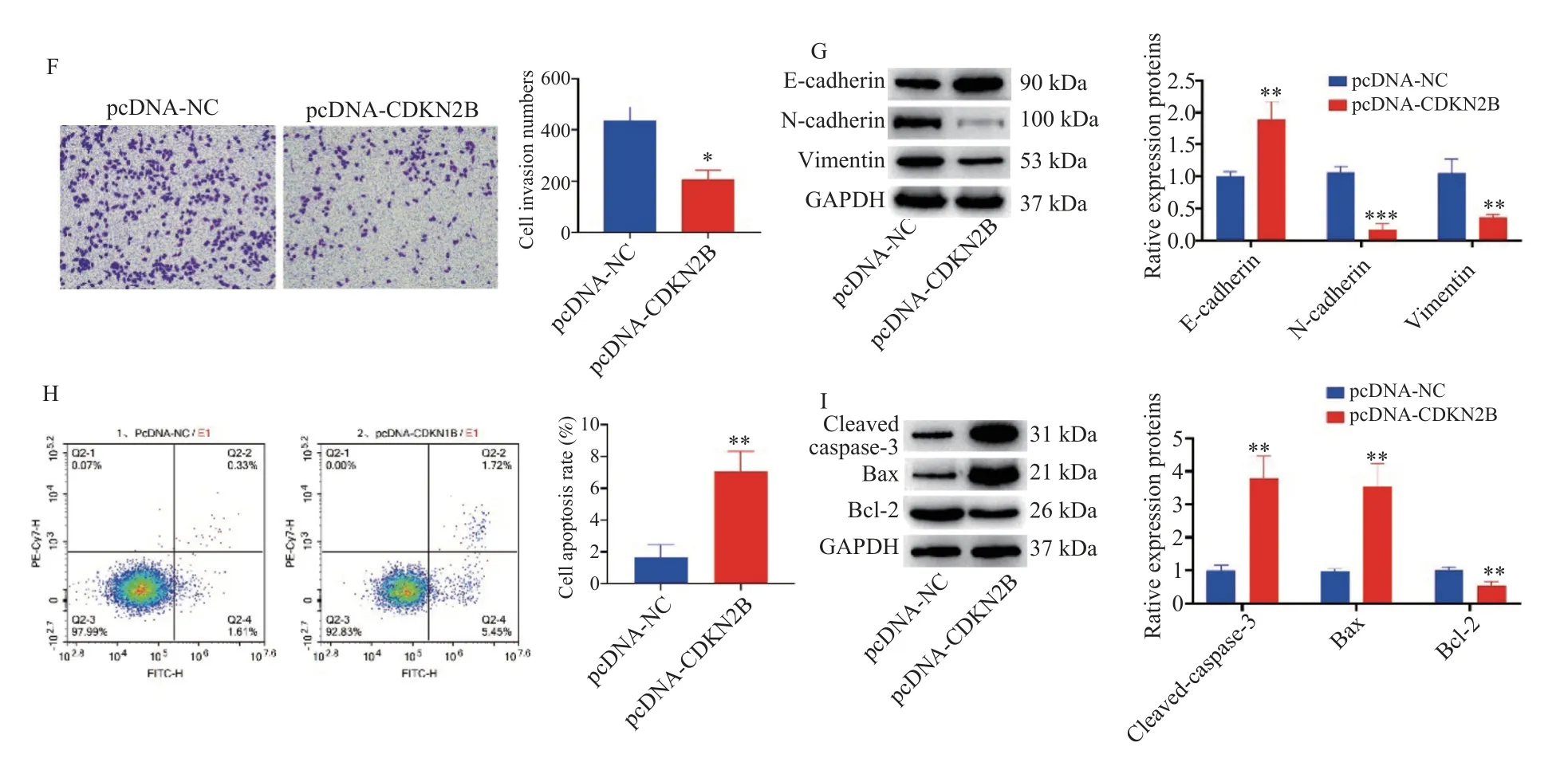
图4 CDKN2B 调控MPM 细胞增殖、侵袭、上皮间质转化和凋亡Fig.4 CDKN2B modulated the proliferation,invasion,epithelial interstitial transformation and apoptosis of MPM cells
3 讨论
MPM 的发生与石棉暴露密切相关,尽管大多数国家已禁止使用石棉,但目前MPM 的发病率仍在继续攀升。因此,了解MPM 发病机制对于对抗MPM 至关重要。体外MPM 模型是研究疾病以及开发新疗法的宝贵工具。本研究中,笔者从MPM 组织中提取MPM 细胞并分别置于RPMI-1640、DMEM 以及DMEM/F12 培养液中培养传代,发现在RPMI-1640 培养液中第1 至第10 代的细胞状态相对稳定,笔者推测RPMI-1640 培养液更适合分离的MPM 细胞培养。
目前,已有报道从肿瘤组织或胸腔液中建立MPM 细胞系,成功率为20%~80%[9−13]。许多细胞系具有MPM 肿瘤中常见的遗传突变,可代表一系列的MPM 组织病理学亚型。然而,大多数研究中建立的细胞系未与原始肿瘤组织中的基因组进行比较,无法确定建立的细胞系与组织病理学的相似程度。Oey 等[14]报道,MPM 细胞培养物中存在大量的单核苷酸取代物聚集在一个点上,而这一现象未在原发性肿瘤组织中观察到。此外,商业MPM 细胞与原代细胞之间的转录组存在明显不同,且商业MPM 细胞代谢向糖酵解表型转移[9],MPM 细胞对药物敏感性存在较大的个体差异[15]。本研究中,笔者培养的MPM细胞均表达MPM 标志物Calretinin、CD141、CK5、EMA 和WT-1。
CDKN2B 是细胞G1 周期进展调节因子,通过与CDK4 或CDK6 形成复合物以及阻止CDK 激酶的活化,从而发挥调控作用。同时,CDKN1B还在细胞应激识别和调节发育和增加阶段的细胞衰老、分化和凋亡中发挥多方面的作用[16]。CDKN2B被发现在肿瘤细胞的恶性转化过程中突变和缺失[17−18]。例如,通过表观遗传抑制CDKN2B 的表达,可促进结直肠癌细胞的增殖和结直肠癌的进展[19]。抑制CDKN2B 可显著促进膀胱癌患者的增殖并抑制细胞的凋亡[20]。CDKN2B 表达增加抑制胆管癌细胞增殖,抑制胆管癌的发展[21]。CDKN2B缺失与儿童急性淋巴细胞白血病患者较差的无复发生存率相关[22]。在本研究中,笔者发现CDKN2B在MPM 细胞中低表达,过表达CDKN2B 显著抑制MPM 细胞的增殖、侵袭和上皮间质转化,并促进细胞凋亡。
综上所述,笔者分离得到的MPM 细胞在RPMI-1640 培养液中可稳定传 代,CDKN2B 在MPM 细胞中低表达,过表达CDKN2B 抑制细胞增殖、侵袭和上皮间质转化并诱导细胞凋亡。
