下调HPV16 E6/E7 表达宫颈癌细胞Siha 上清液代谢组学
2024-02-24肖金宝赵骏达马俊旗
肖金宝,赵骏达,马俊旗
(新疆医科大学第一附属医院妇科门诊,新疆 乌鲁木齐 830000)
子宫颈癌(cervical cancer,CC)作为女性恶性肿瘤之一,其发病率和死亡率持续上升且呈现低龄化,因而受到广泛关注[1]。宫颈癌恶性进展中主要是受到高危型人乳头瘤病毒HPV16、18 型的持续感染,导致癌基因E6 和E7 蛋白的活化,进而影响多条信号途径,促进癌细胞持续增殖,最终形成宫颈癌[2−3]。研究表明,E6 和E7 对葡萄糖[4−5]、脂肪酸[6]、氨基酸[7]代谢具有有一定的影响,宫颈癌细胞的增殖、转移离不开代谢产能的供给。因此,本研究探讨HPV E6/E7 蛋白的活化与宫颈癌相关能量代谢改变的关系,从而对宫颈癌的筛查、治疗、预后提供有利的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞人源宫颈癌Siha(HPV16+)细胞,购买于武汉Pricella 生命科技有限公司。
1.1.2 主要试剂HPV16 E6 抗体(sc-460)、HPV16 E7 ED17 抗体(sc-6981)购买于美国 Santa Cruz Biotechnology 公司。FBS 胎牛血清、青-链霉素、DMEM 培养基购买于BI 公司,X-tremeGENE™HP DNA 转染试剂盒购买于默克生命科学公司,每组质粒由海吉凯生物科技有限公司构建,RNAi 片段引物序列如下,见表1。
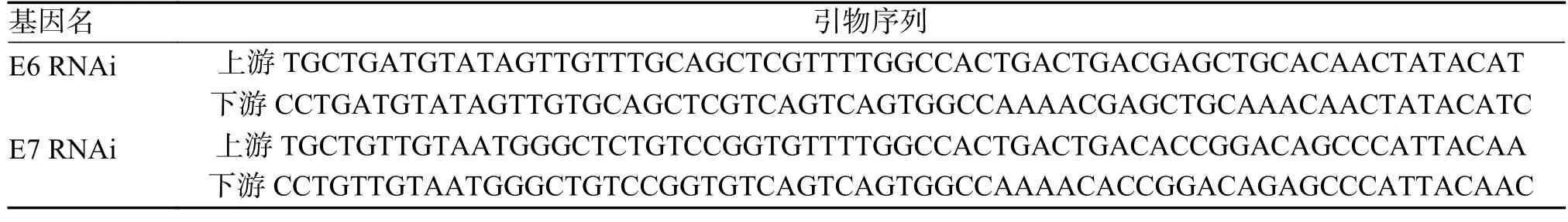
表1 E6 RNAi、E7 RNAi 片段引物序列Tab.1 Primer sequences of E6 RNAi and E7 RNAi fragments
1.2 实验方法
1.2.1 建立宫颈癌细胞Siha 的RNAi 载体转染siRNA 片段、对照(si-NON)构建于由吉凯基因科技有限公司(上海)。本实验根据默克公司生产的质粒转染试剂(名称:X-tremeGENE HP DNA)说明书,其官网http://www.powerful-transfection.com/尚写的详细操作实验步骤,首先调整Siha 细胞生长状态和所需的细胞数量进行试验。其次按照3 µL X-tremeGENE HP DNA Transfection Reagent添加至1 µg 质粒DNA/100uL MEM 培养基中的比例进行转染。48 h 后应用莱卡荧光倒置显微镜(Leica DMIL LED)观察Siha 细胞转染效率,应用Western blot 验证。
1.2.2 细胞培养宫颈癌Siha 培养于DMEM 完全培养基,包含10%FBS 及2%PS,培养于37℃、5%的CO2培养箱内。
1.2.3 核磁共振检测细胞上清液-80℃冰箱中取出样品,准备在室温中4℃的冰水混合物中逐渐解冻,准备无酶EP 管,并加入450 µL 的每组细胞上清液,并加入DSS 缓冲溶液50 µl(配置比例:0.045MNaH2PO4+0.045MK2HPO4inD2O)。本实验中应用的实验仪器微波1HNMR,并采用NOESYPRESAT-ID 脉冲序列进行上清液内的氢谱测定,内标为DSS,将化学位移设定值为0 ppm。最后采用预饱和方式进一步抑制水峰,其时间设置为2 s,采样点数为32 k,谱宽需为10 000 Hz,扫描次数设为为126 次,采样时间平均1.64 s,测试温度为恒温(25℃)。
1.2.4 代谢谱数据分析方法所有1HNMR 谱需要经过相位和基线校正,并用增宽因子为0.5 Hz 的指数窗函数进行处理。数据用SIMCA-P+11 软件进行上清代谢数据的OPLS-DA 分析。各组细胞上清中差异性的代谢物需要经过OPLS-DA 分析,并确定从中得到其变量重要性的参数(variable importance in the projection,VIP)值,要求VIP>1。
1.3 统计学处理
本文所涉及的实验结果均经过3 次独立实验的验证后取平均值。统计学分析采用SPSS17.0 软件。定量资料以()表示,多组数据间的对比需采用单因素方差分析,进一步两两比较采用LSD-t检验。P< 0.05 为差异有统计学意义。
2 结果
2.1 E6-RNAi 和E7-RNAi 的细胞模型建立
通过荧光倒置显微镜对转染HPV16 编码E6或E7 基因序列特异性RNAi 片段的宫颈癌细胞进行观察,明确转染效果见图1A。Western blotting验证各组细胞E6/E7 蛋白表达量。结果显示,与Siha 组比较,si-E6 组与si-E7 组中E6/E7 的表达量降低(F=145.8,P<0.001,图1B,图1C)。
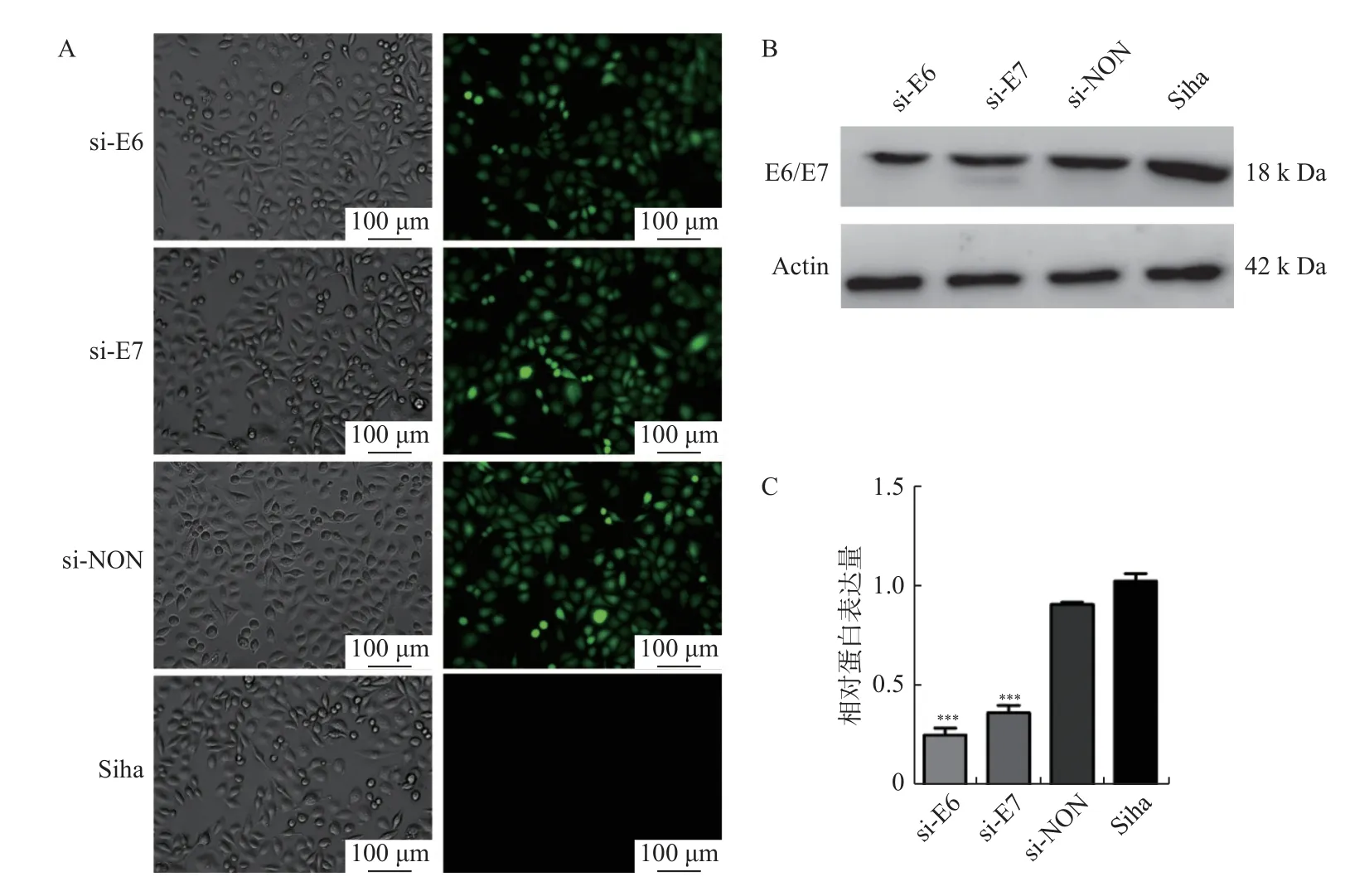
图1 检测Siha 细胞内E6-RNAi 和E7-RNAi 的转染效率Fig.1 The transfection efficiency of E6-RNAi and E7-RNAi in Siha cells was detected
2.2 E6、E7 蛋白表达下调对宫颈癌细胞上清代谢谱变化的影响
利用1H-NMR 代谢谱分析细胞上清液,在si-E6、si-E7 组和Siha 组中共有差异代谢物13 种,见图2。异亮氨酸,亮氨酸,缬氨酸,酪氨酸,β-羟丁酸,苯丙氨酸,甲酸酪氨酸,α-葡萄糖,β-葡萄糖,乙酸,苯丙氨酸含量下降(P< 0.05);乳酸,丙氨酸,甲酸含量上升(P< 0.05),见表2。

图2 RNA 干扰后SiHa 细胞上清1HNMR 谱图Fig.2 1HNMR spectra of SiHa suspention after RNAi
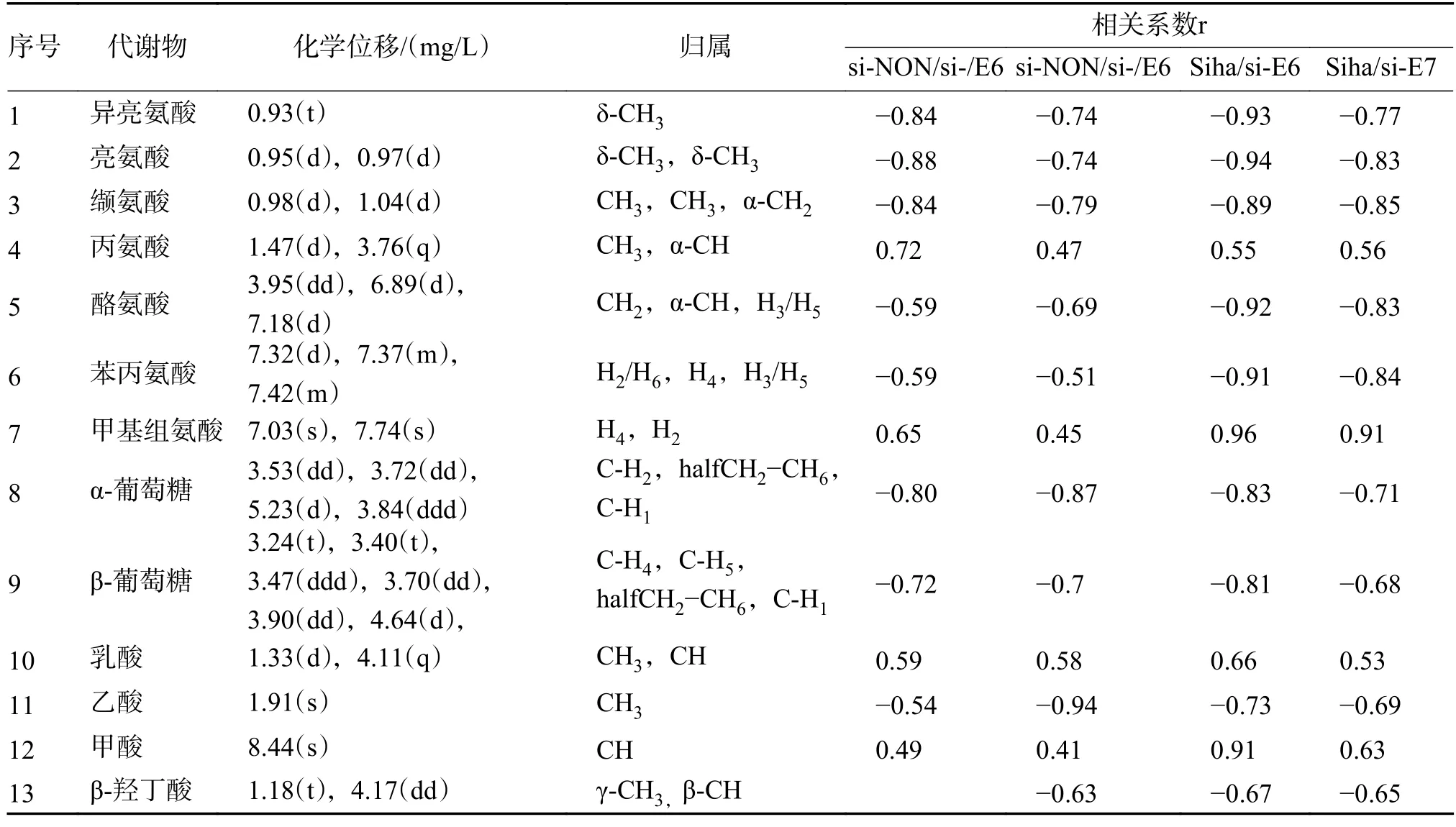
表2 RNA 干扰组与非干扰租1HNMR 谱经过OPLS-DA 分析获得的主要差异性代谢物及其相关系数Tab.2 Otherness metabolites of different cell samples using OPLS-DA based on different normalization methods and its correlation coefficients
2.3 E6、E7 蛋白表达下调对相关代谢通路的影响
利用MetaboAnalyst 5.0 在线软件分析,得到与13 种差异代谢物相关的变化10 条途径(P<0.05),主要分为糖代谢与氨基酸代谢2 类。其中氨基酸代谢主要包含:(1)氨酰-tRNA 生物合成途径;(2)缬氨酸、亮氨酸以及异亮氨酸生物化学代谢途径;(3)苯丙氨酸、酪氨酸和色氨酸的生物化学合成途径;(4)苯丙氨酸合成途径;(5)缬氨酸、亮氨酸和异亮氨酸降解途径;(6)苯丙氨酸的代谢途径;(7)酮体的合成与降解途径;(8)泛醌和其他萜类-醌类生物的合成途径。而糖代谢途径主要包括:(1)糖酵解/糖异生途径;(2)丙酮酸的代谢途径,乙醛酸和二羧酸类的代谢途径,见图3,表3。
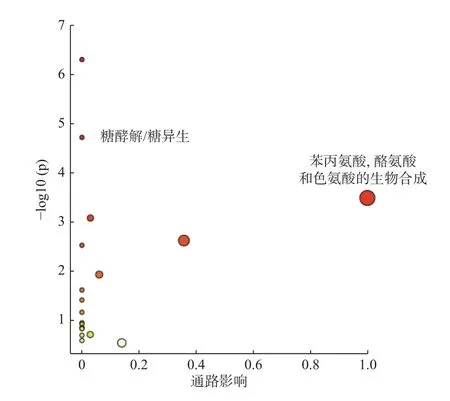
图3 下调Siha 细胞E6/E7 蛋白代谢通路分析图Fig.3 Analysis of down-regulated E6/E7 protein metabolic pathways inSiha cells
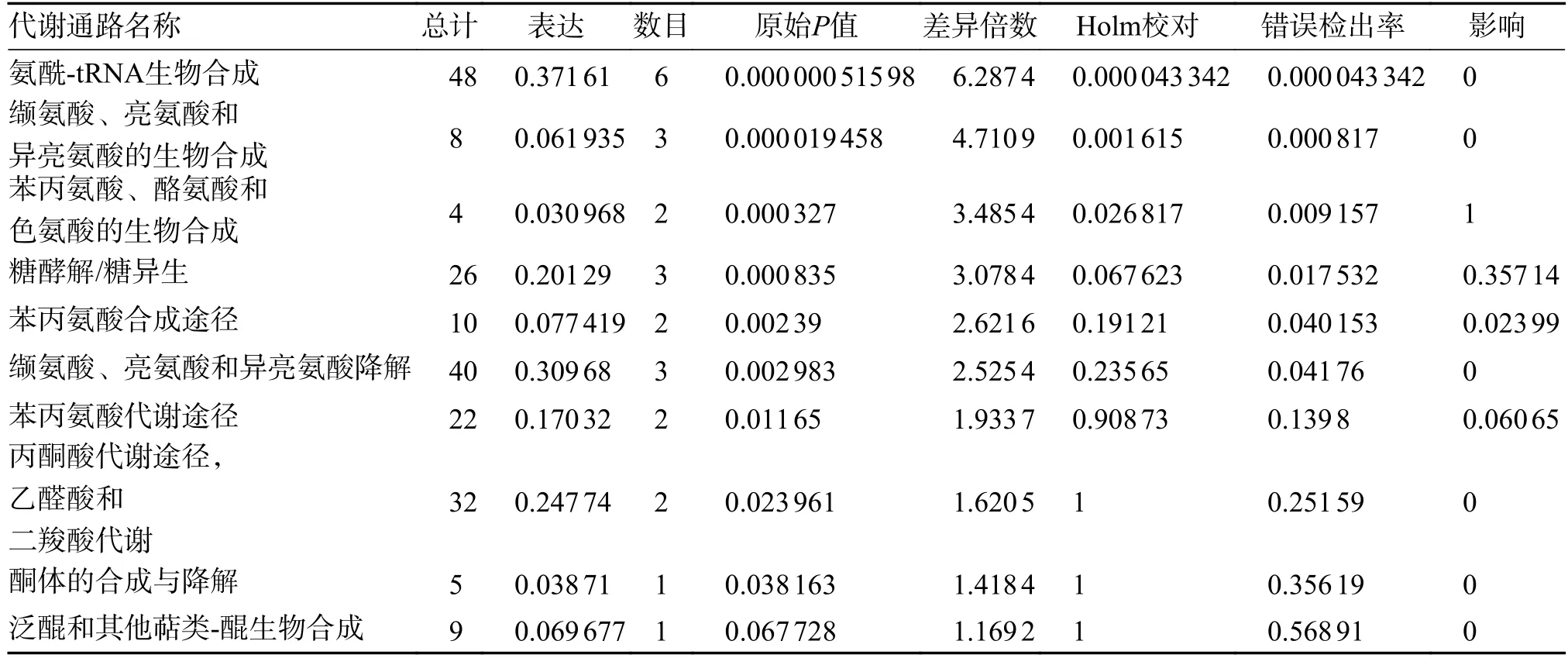
表3 下调Siha 细胞E6/E7 蛋白后10 条相关代谢通路Tab.3 10 metabolic pathways associated with down-regulation of E6/E7 protein in SIHA cells
3 讨论
宫颈癌位居女性妇科恶性肿瘤第2 位,其不但威胁身心健康也会造成一定的经济负担。新疆地区高发肿瘤包括子宫颈癌,其发病率正呈现为年轻化[8−9]。宫颈癌诱发的主要原因是高危型的人乳头瘤病毒(human papilloma virus,HPV)2a 以上的持续性感染,其中常见于HPV16 和18 的感染[10]。其机制为HPV 的DNA 与宿主细胞的DNA整合,通过诱导致癌基因 E6、E7 和调控细胞周期得蛋白存在相互作用,紊乱细胞的周期,从而促进它无限增殖,演变为癌细胞[11]。
近年来,代谢重编程作为癌症标志之一,快速生长的癌细胞可以适应其不断增长的能量需求。癌细胞的是从缺乏营养的环境中获得必要的营养物质,并利用这些营养物质来维持细胞的活力、增殖。癌细胞的异常代谢功能最初是由奥托·瓦博格提出的,对于正常细胞而言,其肿瘤细胞偏向于消耗较多葡萄糖,提出“Warburg effect”[12−13]。自此,众多科学研究集中在与癌症相关其它类型的代谢重编程,如葡萄糖的氧化磷酸化、氨基酸合成和脂质氧化等代谢变化,为寻找癌症进展中其余的潜在的治疗靶点。课题组前期研究发现异常的糖代谢,脂代谢等会影响宫颈癌恶性进展[14−15]。
在宫颈癌进展中,参与糖酵解过程中关键酶如HK2 等呈现过表达,促进宫颈癌细胞的生长、转移等恶性行为[16]。研究显示,在肿瘤细胞中,抑制烯醇化酶1(enolase 1,ENO1)表达将抑制宫颈癌Hela 细胞发生典型上皮-间质转化(epithelialmesenchymal transition,EMT)样形态学改变[17]。前期研究发现RACK1 通过IGF1R/Akt/mTOR 信号通路激活糖酵解途径促进宫颈癌发生淋巴结转移[18]。另1 个常见的代谢变化是氨基酸代谢增加,特别是谷氨酰胺代谢。谷氨酰胺是1 种主要的能量底物,为癌细胞提供额外的能量来源[19]。在肿瘤细胞中多种特定的氨基酸转运体均过表达,如钠离子依赖的中性氨基酸转运蛋白2(sodiumdependent neutral amino acid transporter 2,SNAT2)、丙氨酸-丝氨酸-半胱氨酸转运蛋白2(alanine-serine-cysteine transporter 2,ASCT2)溶、质载体家庭6成员14(solute carrier family 6 member 14,SLC6A14)等[20]。若靶向一些氨基酸的转运体,将会抑制其转运氨基酸,记忆布减弱其细胞捏ATP 能量代谢。
HPV 基因组转录本还含有非编码蛋白,通过蛋白质-蛋白质相互作用,在病毒与宿主的相互作用和感染的发展中发挥关键用途。E6/E7 直接促进糖酵解关键蛋白HK2 表达[21],或HPV E6/p53 信号通路诱导的miR-34a/LDHA 轴调控宫颈癌Warburg 效应促进肿瘤的生长和侵袭[22]。故靶向HR-HPV 感染对抗糖酵解水平也可成为宫颈癌治疗的有效策略。研究显示,2 型转谷氨酰胺酶(transglutaminase 2,TG2)与宫颈癌细胞内HPV16-E6 蛋白的表达水平存在相关性,可作为早期识别的重要指标以及判断预后的重要的分子标记物[23]。本次研究通过下调Siha 细胞中E6、E7 蛋白后,利用1H-NMR 对转染后的细胞上清液进行代谢组学分析,筛选出13 种共有的并变化的差异代谢物,其中,亮氨酸,异亮氨酸,缬氨酸,酪氨酸,β-羟丁酸,苯丙氨酸,酪氨酸,α-葡萄糖,β-葡萄糖,乙酸,苯丙氨酸含量下降,乳酸,丙氨酸,甲酸含量上升。以上差异代谢物涉及10 条代谢通路,见图3 和表3。其主要影响氨基酸代谢以及葡萄糖代谢。提示E6/E7 的表达异常与氨基酸代谢和糖代谢紊乱存在相关性。
综上所述,HPV16 感染导致宫颈癌发生是一个复杂的过程,本研究结果表明,E6、E7 蛋白下调对葡萄糖代谢与氨基酸代谢相关的物质含量有影响,提示HPV16 感染与葡萄糖、氨基酸代谢改变之间存在着相互的关联,随着对E6/E7 蛋白诱导HPV 相关癌症的分子机制研究的不断深入,其可能会成为临床宫颈癌治疗的新靶点。本研究不足是缺少对E6、E7 影响葡萄糖、氨基酸代谢的调控机制的研究,后续实验将会继续探索其存在的主要调控机制。
