一种可视化检测肼的苯并噁唑类荧光增强型探针
2024-02-23王汉林黄杰勋黄卫东杨龙元
王汉林 郑 汉 黄杰勋 黄卫东 杨龙元 李 武
(1湖北理工学院环境科学与工程学院,黄石 435003)
(2矿区环境污染控制与修复湖北省重点实验室,黄石 435003)
(3湖北理工学院化学与化工学院,黄石 435003)
肼(N2H4)是一种有毒的物质,具有良好的水溶性、较强的碱性和还原性。作为一种重要的化工原料,它广泛应用于染料、制药和农业等领域[1-2]。然而,N2H4在生产、运输、使用和处理的过程中的泄露或者不合理排放会对环境安全和人体健康造成重大威胁[3]。研究表明,N2H4通过呼吸或皮肤接触等途径被人体吸收后,会对人的肾、肝、肺和中枢神经系统等造成严重的损伤[4-6]。美国环境保护署(EPA)已将N2H4列为潜在的致癌物,规定它在饮用水中的最高容许浓度为0.31 μmol·L-1[7]。因此,迫切需要开发一种简单方便、灵敏快捷的方法来检测环境和生物样品中N2H4的含量。
荧光探针技术目前已广泛应用于检测各种重金属离子、农药、有机或无机污染物等有毒有害物质[8-9]。该检测方法简便快捷,具有成本低、灵敏度和选择性高、能原位实时监测等优点,受到了广大科研人员越来越多的重视[10-11]。自2011年首次报道了第一例用于检测N2H4的荧光探针以来,到目前为止已经开发了多种这类荧光探针[12-13]。它们绝大多数是荧光增强型的反应型探针,N2H4作为亲核试剂,可与探针的识别基团发生环化、开环、基团转化和脱保护等特异性反应[1,14]。然而,许多探针仍存在抗干扰能力差、响应慢等缺陷,难以在复杂环境中实现N2H4的检测[7,13,15]。开发灵敏快捷、选择性好的高性能荧光探针仍然是当前一项挑战性的研究工作。
苯并噁唑类化合物具有优异的光物理和光化学性能,可用于构建检测金属离子或小分子的荧光探针[16-18]。基于Gabriel 合成法,我们以邻苯二甲酸酐等为原料,设计并合成了一种苯并噁唑类荧光增强型探针2-(2-(苯并[d]噁唑-2-基)苯基)异吲哚啉-1,3-二酮(HL2),其合成路线如Scheme 1 所示。HL2 以苯并噁唑结构单元为荧光团,邻苯二甲酰亚胺结构单元为识别位点,可实现对N2H4的选择性识别。HL2 对N2H4表现出较高的灵敏度和选择性,不仅能应用于水体样品中N2H4的检测,还可对HeLa 活细胞中的N2H4进行荧光成像。
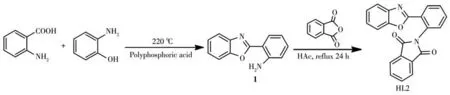
Scheme 1 Synthesis of fluorescent probe HL2
1 实验部分
1.1 仪器与试剂
实验所用试剂均为市售分析纯。所用仪器包括XT4A型显微熔点仪、Perkin-Elmer 2400元素分析仪、pHS-3C pH 计、Analytik jena Specord 210 紫外光谱仪、Varian-Cary-Eclipse 荧光光谱仪、Applied Biosystems API 2000 LC/MS/MS 质谱仪、Varian 640-IR 红外光谱仪(KBr 压片法)、Bruker 400 MHz 核磁共振波谱仪、Brucker APEX-ⅡCCD 单晶衍射仪、Leica DMI 3000B荧光倒置显微镜。
1.2 探针HL2的合成
2-(2-氨基苯基)苯并噁唑(1)按照文献[17]的方法制备。先将邻苯二甲酸酐(1.48 g,10 mmol)和1(1.05 g,5 mmol)溶于乙酸(30 mL)中,然后将反应混合物搅拌,并于120 ℃回流24 h。反应结束后,将反应液倒入500 mL 冰水中,用1.0 mol·L-1NaOH 水溶液将pH值调至8。抽滤,用蒸馏水洗涤滤饼(30 mL×3),所得固体于80 ℃干燥12 h 后,再用硅胶柱分离(V石油醚∶V乙酸乙酯=10∶1),产率为67.8%。m.p.165~167 ℃。1H NMR(400 MHz,DMSO-d6):7.10~7.28(m,4H),7.43(d,J=8.0 Hz,1H),7.58~7.62(m,2H),7.73~7.78(m,2H),7.90(d,J=8.0 Hz,2H),8.36(m,1H)。13C NMR(100 MHz,DMSO-d6):109.0,119.0,122.4,123.1,124.1,128.4,128.9,129.9,130.7,131.3,132.8,140.4,148.1,158.5,166.7。ESI-MS(m/z):341.15[M+H]+。IR(KBr,cm-1):1 717(s),1 612(w),1 496(m),1 227(w),733(m),707(w)。C21H12N2O3元素分析计算值(%):C 74.11;H 3.55;N 8.23;实验值(%):C 74.32;H 3.79;N 8.01。
1.3 晶体的测定
选取大小为0.30 mm×0.20 mm×0.20 mm 的浅黄色HL2 晶体,置于Brucker APEX-ⅡCCD 单晶衍射仪上收集X 射线衍射数据,辐射源是石墨单色化的MoKα射线(λ=0.071 073 nm),温度为296.15 K,以ω-2θ方式扫描,在2.44°<θ<32.03°范围内收集衍射点数据。全部衍射数据经Lp 因子和经验吸收校正。晶体结构通过SHELXS-2014 采用直接法进行解析,部分非氢原子坐标在以后的数轮差值傅里叶合成中陆续确定。对所有非氢原子坐标及其温度因子用全矩阵最小二乘法进行精修[19]。所有氢原子均为理论加氢并按跨式模型(riding model)精修,其温度因子为其母原子温度因子平均值的1.2倍~1.5倍。
CCDC:2268187。
1.4 光谱实验
首先将HL2 配制成1 mmol·L-1的乙醇溶液,各种分析物(F-、Cl-、Br-、I-、SCN-、HSO3-、SO32-、N3-、NO3-、NO2-、NH3、NH2OH、CO(NH2)2、CH3NH2和N2H4)用二次蒸馏水配制成1 mmol·L-1的储备溶液。测试前,将HL2 和各种分析物混合,然后用EtOH/Tris-HCl缓冲溶液(体积比1∶9,pH=7.4)稀释至所需浓度。将混合溶液涡旋混匀2 min 后,在室温下进行紫外光谱和荧光光谱测试(λex=352 nm,λem=445 nm,狭缝:10 nm/10 nm)。
1.5 水体样品中N2H4的检测
选取农夫山泉瓶装矿泉水(中国杭州市)、自来水(黄石市自来水有限公司)和湖水(中国湖北省黄石市磁湖)3 种水样进行N2H4检测的回收实验。3 种水样在使用前都没有过滤,直接以其代替荧光测试所用的蒸馏水。采用标准加入法测定3种水样中不同浓度的N2H4溶液(4.00、8.00 和12.00 μmol·L-1)。测试前,将探针HL2 和加入N2H4的水体样品涡旋混匀2 min,然后进行荧光光谱测试。
1.6 细胞毒性和荧光成像
在Tris-HCl 缓冲体系中,将事先培养好的HeLa细胞加入5 μmol·L-1的探针HL2 溶液(pH=7.4,VH2O∶VEtOH=9∶1),于37 ℃分别恒温培养12 和24 h,不加探针的细胞作为对照组,然后采用MTT 法测定细胞活力。
将探针HL2(5 μmol·L-1)加入到用磷酸盐缓冲溶液(PBS)清洗3 次后的HeLa 细胞中,于37 ℃恒温孵育30 min 后,再用PBS 洗3 次以便除去HL2 溶液,然后进行细胞的荧光成像。进一步向上述含HL2 的细胞培养液中加入N2H4溶液(15 μmol·L-1),在37℃恒温培养30 min 后,用PBS 清洗3 次,再次进行细胞的荧光成像。
2 结果与讨论
2.1 HL2的晶体结构
荧光探针HL2 是一种通过酸酐与有机胺(1)反应得到的酰胺类化合物。将探针HL2 溶解在丙酮中,然后于室温下静置2 d 后可得浅黄色的晶体。单晶X 射线衍射分析表明,HL2 的结晶属于单斜晶系,空间群为C2/c(表1)。在HL2 晶体结构中,苯并噁唑环和相邻的苯环几乎共面,二者之间的二面角为5.99(2)°,邻苯二甲酰亚胺环和它们之间的二面角分别为61.38(1)°和63.03(1)°(图1)。C—N 键的键长范围为0.129 2(2)~0.142 7(2)nm,且C2—N1(氨基)键长大于C15—N2(苯并噁唑)键长(表2)。邻苯二甲酰亚胺环上的2 个羰基的C—O(C7—O1 和C8—O2)键长基本相等,但它们短于苯并噁唑环上的2 个C—O(C15—O3 和C17—O3)键长。C1—C2—N1 和C2—C1—C15 的键角分别为121.79(12)°和123.53(12)°,这导致探针HL2呈现V形结构。

表1 HL2的晶体学数据和结构参数Table 1 Crystal data and structure refinements of HL2

表2 HL2的部分键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)of HL2
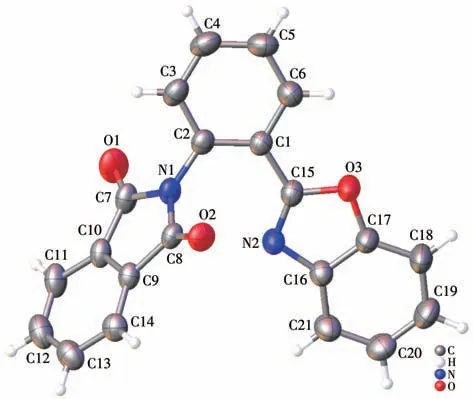
图1 HL2的椭球概率50%的晶体结构Fig.1 Crystal structure of HL2 with 50% ellipsoid probability
2.2 HL2对N2H4的响应
为了考察探针的选择性,向10 μmol·L-1HL2 中加入30 μmol·L-1的各种分析物(F-、Cl-、Br-、I-、SCN-、HSO3-、SO32-、N3-、NO3-、NO2-、NH3、NH2OH、CO(NH2)2、CH3NH2和N2H4),然后测试探针在发射波长(λem=445 nm)处的荧光强度(λex=352 nm)。如图2所示,N2H4对HL2 表现出显著的荧光增强效应,而其它分析物几乎不会明显改变HL2 的荧光强度,这表明HL2 有优异的选择性识别N2H4的能力。紫外可见光谱显示,向HL2(10 μmol·L-1)中加入N2H4(30 μmol·L-1)后,它的最大吸收波长基本没有变化,但其吸收强度增强(图3)。向HL2(10 μmol·L-1)与N2H4(30 μmol·L-1)的反应体系中加入各种干扰物(300 μmol·L-1)后,可发现HL2 对N2H4的荧光响应几乎不受影响(图4)。故HL2 对N2H4具有良好的选择性和较强的抗干扰能力,可适合复杂环境中N2H4的检测。

图2 HL2对各种分析物的荧光响应Fig.2 Fluorescent response of HL2 to various analytes

图3 HL2在加入N2H4前后的紫外可见光谱Fig.3 UV-Vis spectra of HL2 before and after addition of N2H4

图4 在各种干扰物的存在下,HL2识别N2H4(30 μmol·L-1)的荧光响应Fig.4 Fluorescence response of HL2 to N2H4 in the presence of various interferents
进一步利用荧光滴定实验测试了HL2 对N2H4的灵敏度(图5a)。HL2 自身的荧光强度较弱,它的量子产率(Φ)为0.08。当向HL2(10 μmol·L-1)中逐渐加入3倍的N2H4后,它的荧光强度逐渐增大,直至达到稳定,此时反应体系的荧光强度增大了15 倍(Φ=0.69)。此外,在实验中还发现HL2 的荧光强度与N2H4的浓度(0.1~25 μmol·L-1)之间存在良好的线性关系(y=103.61+115.96x,线性相关系数R2=0.987 5,图5b)。HL2对N2H4的检出限(3σ/k,σ指空白标准偏差,k是线性方程的斜率)为0.072 μmol·L-1,它远低于EPA 规定的N2H4的阈限值(0.31 μmol·L-1)。因此,HL2 对N2H4有较高的灵敏度,可以用于定量检测N2H4。
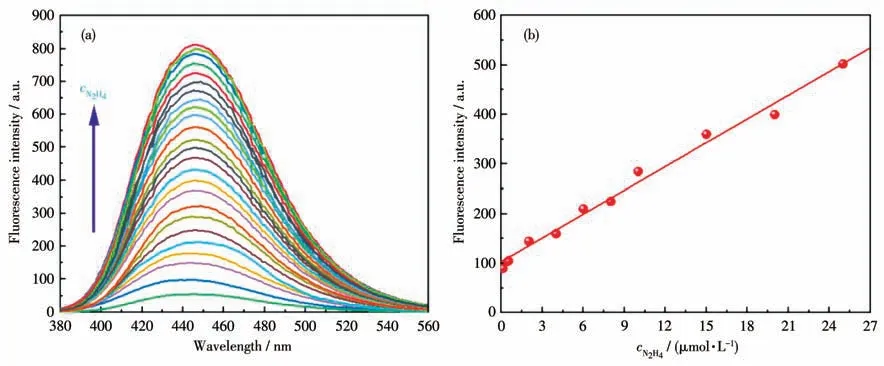
图5 (a)滴加不同浓度的N2H4后HL2的荧光光谱;(b)HL2的荧光强度与N2H4浓度之间的线性关系Fig.5 (a)Fluorescence spectra of HL2 upon addition of N2H4 with various concentrations;(b)Linear relationship between the fluorescence intensity of HL2 and the concentration of N2H4
不同pH 值对HL2 的影响如图6 所示。HL2 的荧光强度在pH=3~10 的范围内几乎保持稳定。当加入N2H4后,HL2 的荧光强度随pH 值增大而逐渐增强,而在pH=5~10 的较宽范围内,它的荧光强度趋于稳定。考虑到环境和生物体系中的应用,选择在生理pH(7.4)下进行所有光谱实验的测试。HL2对N2H4的响应快速(图7)。向HL2(10 μmol·L-1)中加入N2H4(30 μmol·L-1)后,反应体系的荧光强度随着时间的延长逐渐增大,在2 min 后达到最大值,且荧光强度基本保持稳定,证实HL2 是一种快速检测N2H4的荧光增强型探针。将此时的反应液用波长为365 nm 的紫外灯照射,可用肉眼观察到加入N2H4前后HL2 溶液的荧光颜色由无色变为蓝色(图7 插图)。这种明显的颜色变化和荧光“关-开”响应,表明HL2可以实现对N2H4的可视化检测。
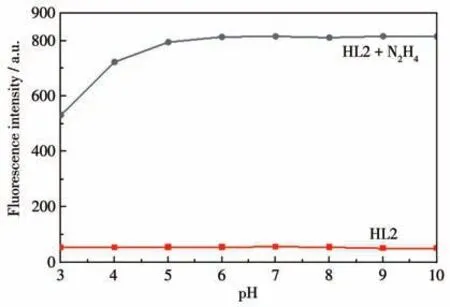
图6 在N2H4加入或不加入的条件下,不同pH值对HL2荧光强度的影响Fig.6 Effect of different pH values on the fluorescence intensity of HL2 with and without the addition of N2H4

图7 HL2在加入N2H4后荧光强度随时间的变化Fig.7 Time-dependent fluorescence intensity changes of HL2 with the addition of N2H4
2.3 HL2对N2H4的识别机理
为了探索HL2 对N2H4的可能识别机理,进行了核磁氢谱测试。与HL2 的核磁谱图对比,当加入N2H4后,HL2 的邻苯二甲酰亚胺基团在δ7.90~8.36处的质子信号消失,并且在δ6.18 处出现新的氨基峰(图8)。此外,发现HL2与N2H4反应产物的核磁氢谱与化合物1 高度相似,说明HL2 的邻苯二甲酰亚胺基团肼解后生成了1。这个结果也可通过红外光谱进一步证实。如图9 所示,比较HL2、1 和HL2 与N2H4的反应产物的红外光谱,可发现HL2 在1 717 cm-1处显示的是邻苯二甲酰亚胺的羰基特征吸收峰,而在HL2 和N2H4的反应产物中,该峰的信号消失,却在3 428 和3 323 cm-1处出现了2 个新的氨基吸收峰,并且该产物的红外谱图与1 基本相同。基于上述结果,推测了一种HL2 对N2H4的识别机理(Scheme 2)。HL2的邻苯二甲酰亚胺基团被肼解后,释放出含有氨基的化合物1,它会产生激发态分子内质子转移(ESIPT)效应,从而导致了荧光的增强。这种机理也与以前报道的Gabriel 反应型荧光探针检测N2H4的机理一致[20-21]。
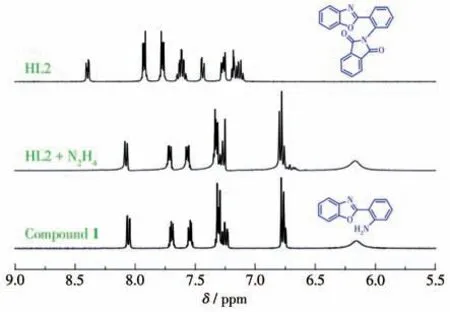
图8 HL2、HL2+N2H4和化合物1在DMSO-d6中的1H NMR谱图Fig.81H NMR spectra of HL2,HL2+N2H4 and compound 1 in DMSO-d6

图9 探针HL2、化合物1和HL2与N2H4反应产物的红外光谱Fig.9 IR spectra of probe HL2,compound 1 and the product of HL2 and N2H4

Scheme 2 Possible reaction mechanism of probe HL2 and N2H4
2.4 水体样品中N2H4的检测
为了考察HL2 的实际应用价值,选取矿泉水、自来水和湖水进行N2H4的加标回收实验。
向3 种待测水样中加入不同浓度的N2H4溶液(0、4.00、8.00 和12.00 μmol·L-1),通过荧光光谱检测水样中N2H4的浓度。如表3 所示,HL2 检测不出矿泉水、自来水和湖水中的N2H4,而向这3个水体样品中加入外源的N2H4后,N2H4的回收率在95.75%~104.25%之间,相对标准偏差(RSD)在1.27%~4.79%之间,这表明HL2 可定量检测不同水体样品中的N2H4,具有较好的准确度和精密度。
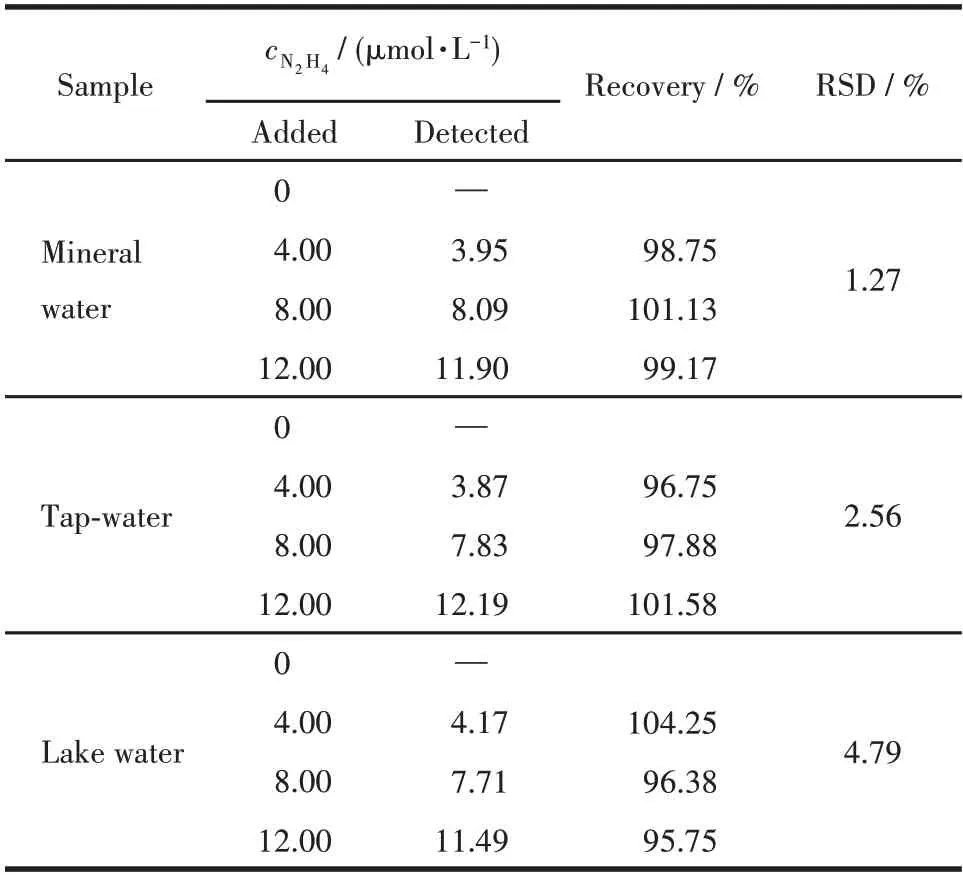
表3 不同水样中N2H4的检测Table 3 Detection of N2H4 in various water samples
2.5 HL2检测细胞中的N2H4
首先,采用MTT 法在HeLa 细胞中对HL2 的细胞毒性进行了测试(图10)。将HL2(5 μmol·L-1)在HeLa 细胞中分别孵育12 或24 h,发现HeLa 细胞的存活率仍保持在90%以上,这证实HL2(5 μmol·L-1)对HeLa细胞没有明显的毒性。其次,进一步研究了HL2在HeLa细胞中对N2H4的荧光成像。将5 μmol·L-1HL2 在HeLa 细胞中于37 ℃孵育30 min 后,没有观察到荧光信号(图11A)。再向上述含HL2 的细胞培养液中加入15 μmol·L-1N2H4,继续在37 ℃孵育30 min后,可发现HeLa细胞呈现出明显的蓝色荧光(图11C)。同时,与之对应的亮场图像没有观察到HeLa 细胞的凋亡现象(图11B 和11D),这说明HL2具有良好的细胞膜通透性,在检测生物样品中的N2H4方面有潜在应用。

图10 与探针HL2共孵育12或24 h后HeLa细胞的存活率Fig.10 Cell viability of HeLa cells incubated with probeHL2 for 12 or 24 h

图11 探针HL2孵育的HeLa细胞的荧光图像Fig.11 Fluorescence images of HeLa cells incubated with probe HL2
3 结 论
合成了一种用于可视化检测N2H4的苯并噁唑类荧光增强型探针HL2,它能在2 min内快速地识别N2H4,并伴随着荧光颜色由无色变为蓝色的明显变化。HL2 对N2H4具有较高的选择性和灵敏度,抗干扰能力强,它在各种水体样品和HeLa 活细胞中对N2H4的检测表明,HL2 在生物和环境方面具有潜在的应用价值。
