PI3K、NF-κB p65蛋白在宫颈癌组织中的表达及其临床意义
2024-02-23王秋香喻春霞夏小飞
王秋香 喻春霞 夏小飞
作者单位:450000 河南省直第三人民医院
宫颈癌是原发于子宫颈部位的恶性肿瘤,受到遗传因素和环境因素的共同影响,目前医学上认为主要是由于持续性感染高危性人乳头瘤病毒(HPV)造成[1]。我国每年宫颈癌的新发病例占总患病人数的28.8%,且呈现年轻化趋势,据《2020年世界癌症报告》分析,预计未来10年国内宫颈癌死亡人数会提高25%[2]。随着癌前筛查技术的成熟以及HPV疫苗的普及,宫颈癌的早期筛查、疾病控制以及预防得到了巨大进步[3-4]。然而对于宫颈癌中晚期或已发生肿瘤细胞远端转移的患者仍然缺乏治疗手段,预后极差。随着蛋白质组学技术发展,众多研究发现,磷脂酰肌醇-3-激酶(PI3K)能够调控细胞周期,促进新生血管生成;真核细胞核因子κB(NF-κB)则参与了机体炎症反应及免疫系统的调节,两者均与多种肿瘤生物学行为密切相关[5-6]。综上,本次研究将检测PI3K、NF-κB p65蛋白在宫颈癌组织中的表达,分析其表达水平与宫颈癌患者临床病理参数的关系,以期为防治宫颈癌提高一定的参考价值,现报告如下。
1 资料与方法
1.1 临床资料
选取2016年1月至2022年7月收治的宫颈癌患者62例作为研究对象,年龄28~70岁,平均年龄(46.38±8.37)岁,术后提取患者宫颈癌组织标本和癌旁正常组织。根据《国际妇产科联盟2012宫颈癌诊治指南》[7]中的诊断标准,经过病理组织检查,确认组织标本为恶性肿瘤。病理分型:宫颈鳞癌42例,宫颈腺癌20例;按2013年国际妇产科学联合会(FIGO)的临床分期标准:Ⅰ期9例,Ⅱ期14例,Ⅲ期29例,Ⅳ期10例;分化程度:高、中、低分化依次为8、36、18例;淋巴结转移情况:未转移39例,已转移23例。纳入标准:①临床资料完整;②首次确诊;③未接受过放疗或化疗。排除标准:①存在其他恶性肿瘤;②存在影响本次研究的其他妇科疾病;③妊娠期或哺乳期妇女;④中途退出或随访失联患者。
1.2 方法
采用免疫组织化学染色法检测PI3K、NF-κB p65蛋白。取出两组的宫颈组织标本,以10%甲醛固定,石蜡包埋后4 μm厚切,每例组织蜡块切2份,再进行常规脱蜡和漂片,加入过氧化氢溶液室温孵育30 min,阻断内源性过氧化物酶,加入无免疫血清封闭后,分别滴加PI3K和NF-κB p65单抗(美国Acbam公司)室温孵育60 min。PBS缓冲液冲洗3次,滴加二抗培养,苏木精染色,脱水干燥,最后以中性树胶封片。阳性对照:选用已有的PI3K、NF-κB p65蛋白阳性切片;阴性对照:采用PBS缓冲液代替一抗。
1.3 评估标准
根据胞质染色强度和阳性细胞率评估PI3K、NF-κB p65蛋白的表达情况。染色强度:0为不着色,1为淡黄色,2为棕黄色,3为黄褐色;阳性细胞率:<15%为0,15%~25%为1,26%~50%为2,51%~75%为3,>75%为4。计算二项乘积判断是否阳性,≥3分为阳性,<3分为阴性。
1.4 统计学处理

2 结果
2.1 两组宫颈组织中PI3K、NF-κB p65蛋白的表达情况
宫颈癌组织中PI3K阳性39例(62.90%),NF-κB p65阳性43例(69.35%);癌旁正常组织中PI3K和NF-κB p65均无阳性表达,两组阳性表达率比较P<0.05,见表1。
2.2 PI3K、NF-κB p65蛋白与临床病理参数的关系
不同年龄、病理分型、肿瘤直径宫颈癌患者的PI3K、NF-κB p65蛋白阳性表达比较,差异无统计学意义(P>0.05);FIGO Ⅲ~Ⅳ期宫颈癌患者PI3K和NF-κB p65阳性表达率高于FIGO Ⅰ~Ⅱ期宫颈癌患者(P<0.05);低分化宫颈癌患者PI3K和NF-κB p65阳性表达率高于中分化及高分化宫颈癌患者(P<0.05);淋巴结转移宫颈癌患者PI3K和NF-κB p65阳性表达率高于无淋巴结转移患者(P<0.05),见表2。
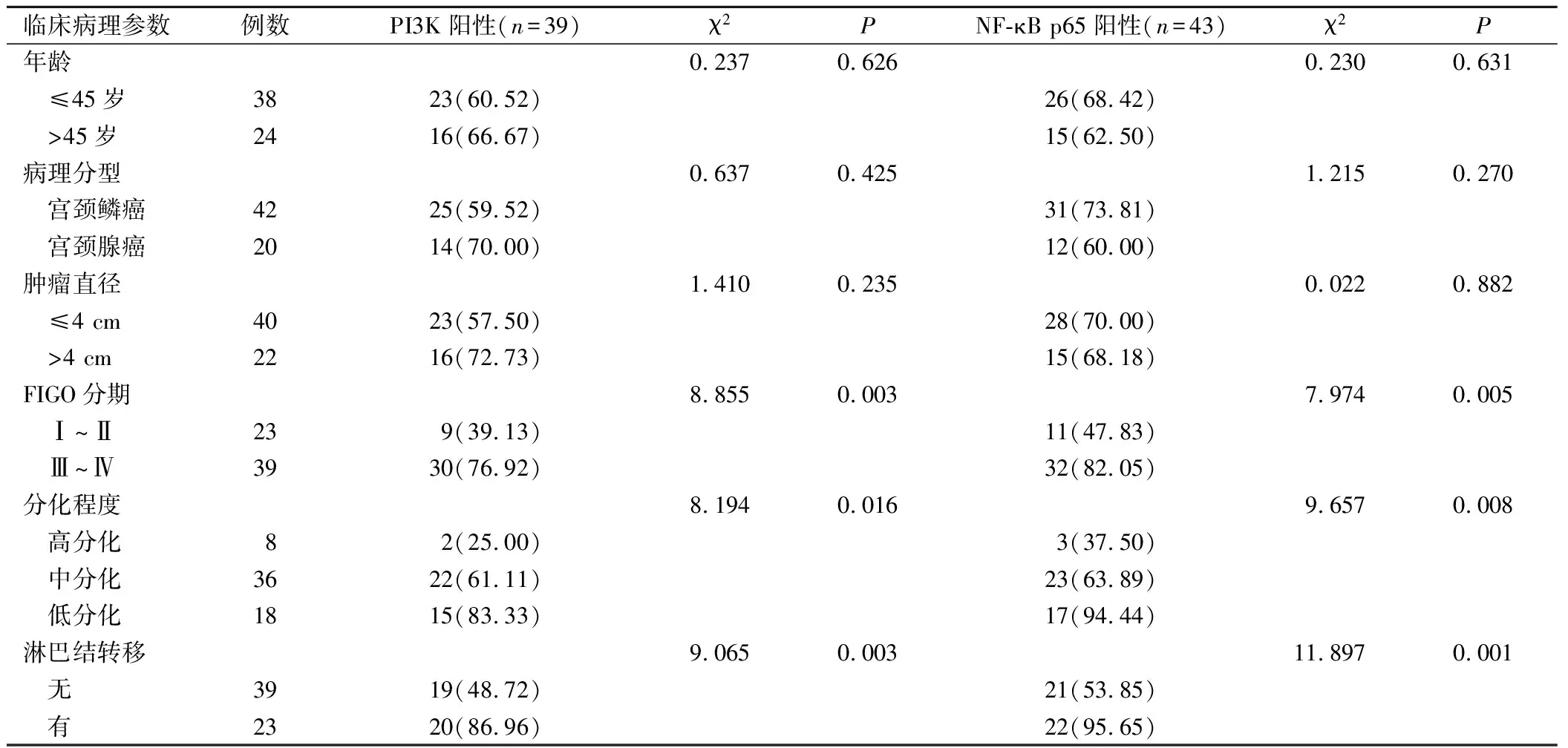
表2 PI3K、NF-κB p65蛋白阳性表达与其临床病理参数的关系(例,%)
2.3 PI3K、NF-κB p65蛋白与临床病理参数的相关性分析
经Spearman相关性分析,PI3K和NF-κB p65的表达水平与宫颈癌FIGO分期、淋巴结转移呈正相关,与分化程度呈负相关(P<0.05),见表3。
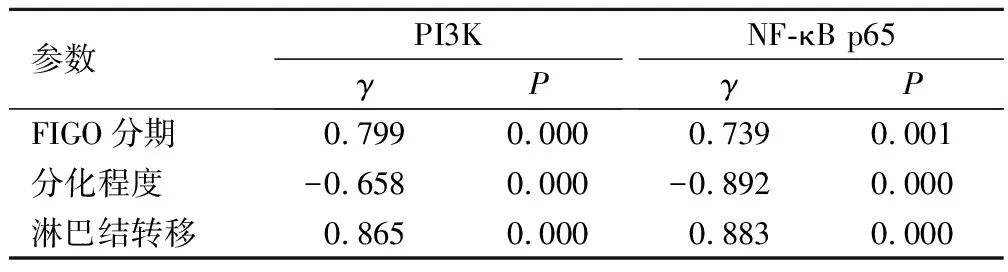
表3 PI3K、NF-κB p65蛋白表达与宫颈癌临床病理参数的相关性分析
3 讨论
宫颈癌发病的重要因素之一是长期的HPV持续感染,但单纯的HPV感染并不能促进肿瘤的进展,可能还与宫颈癌进程中患者体内相关蛋白分子的结构与功能有关。为了监控宫颈癌,目前主要采用细胞学、阴道镜及病理学检查进行递进性的早期筛查[8]。治疗手段则以手术切除和放疗、化疗为主,但因缺乏对宫颈癌病理进程中相关分子靶点的研究,治疗效果差异性较大,部分患者预后较差,因此探究宫颈癌病理进程中相关的生物标志物,对于防治宫颈癌至关重要[9]。
P13K是一种被生长因子和上游因子激活的磷脂激酶,能将二磷酸磷脂酰肌醇转变成三磷酸磷脂酰肌醇,通过PI3K/Akt/mTOR信号通路传导,导致基质蛋白磷酸化,从而缩短细胞G1周期,加速细胞周期。P13K的下游的靶蛋白Akt能与三磷酸磷脂酰肌醇结合,转至细胞膜,使得Akt激活,提高细胞凋亡耐受能力,同时启动其下游底物,诱导新生血管生成,给肿瘤细胞供给养分,促进肿瘤组织生长。黄作香的研究[10]显示,P13K在宫颈癌组织中表达水平高于宫颈上皮癌变组织及癌旁正常组织。本次研究显示,宫颈癌组织中PI3K阳性表达率(62.90%)明显高于癌旁正常组织(0.00%)(P<0.05),与上述研究一致。说明REG4的高水平表达与宫颈癌病情进展相关。分析可能是P13K改变细胞周期,导致肿瘤细胞增殖,并调节下游相关抗调亡因子,抑制肿瘤细胞的凋亡,导致宫颈癌肿瘤组织生长。
NF-κB是一类具有多向转录调节作用的Rel家族转录因子,参与细胞增殖和凋亡过程,其中的RelA即为NF-κB p65,是NF-κB二聚体复合物的核心因子,能够调节多种细胞基因的转录及生长因子的表达,并且机体的炎症反应有关。在细胞静息状态下,NF-κB p65会处于细胞质中,等到接受信息传导激活后,NF-κB p65会进入细胞核,发挥转录调节作用,促进细胞增殖及生长因子的表达。有研究[11]指出,NF-κB p65的过量表达会促进肿瘤细胞新生血管的生成,提高肿瘤细胞的浸润转移能力。祁海云等[12]的研究发现,阻断NF-κB信号通道能有效抑制人宫颈癌上皮细胞的增殖,并且诱导其调亡。本次研究显示,宫颈癌组织中NF-κB p65阳性表达率(69.35%)明显高于癌旁正常组织(0.00%)(P<0.05)。说明NF-κB p65对于宫颈肿瘤细胞的增殖起到了促进作用。分析可能是NF-κB p65提高了肿瘤细胞基因的转录效率,促进了其增殖,同时提高肿瘤组织中生长因子的表达水平,帮助肿瘤组织新生血管的生成,供其养分,防止其凋亡。
本次研究结果显示,FIGO分期中Ⅲ~Ⅳ期、低分化程度及淋巴转移患者PI3K和NF-κB p65阳性表达率均高于同类型其他病理参数其他阳性表达率(P<0.05),说明PI3K和NF-κB p65阳性表达受到宫颈癌的临床病理参数的影响。经Spearman相关性分析,PI3K和NF-κB p65的表达水平与宫颈癌患者的FIGO分期、淋巴结转移呈正相关,与分化程度呈负相关(P<0.05)。牟大英等[13]的研究表明,宫颈癌患者的FIGO分期Ⅲ~Ⅳ期、分化程度较低或出现淋巴结转移,其体内的PI3K蛋白阳性表达率更高。李莉玲等[14]的研究发现,宫颈癌细胞中NF-κB的表达水平越高,宫颈癌的分期及恶性程度越高,两者呈正相关,本次研究结果与其一致,说明PI3K和NF-κB p65的表达水平与宫颈癌患者的临床病理特征存在相关性,可用于判断宫颈癌的病程程度,对于宫颈癌的联合诊断具有一定的临床意义。
综上所述,PI3K、NF-κB p65蛋白在宫颈癌组织中的阳性表达率均高于癌旁正常组织,参与了宫颈肿瘤细胞的增殖,同时抑制调亡过程,促进肿瘤细胞侵袭与转移,同时与临床病理参数中的FIGO分期、分化程度及淋巴结转移存在相关性,对于宫颈癌的诊治及今后的靶向治疗研究具有一定的临床意义。
